第二章 第三节 化学平衡导学案(第1课时)
- 格式:doc
- 大小:53.50 KB
- 文档页数:3

《选修四第二章第三节可逆、不可逆反应化学平衡状态》导学案(第1课时)高二班第组姓名组内评价教师评价【课标要求】1、了解可逆反应与不可逆反应的概念。
2、掌握化学平衡建立的过程、化学平衡的概念。
【难点重点】1、化学平衡的建立;平衡移动原理的应用2、化学平衡的特征;浓度、压强和温度对化学平衡的影响【新课导学】一、可逆反应与不可逆反应结合初中你学过的溶解平衡问题,说一说日常生活中你遇到的平衡现象。
通过对以上平衡现象的分析,你能否为可逆反应下一定义:可逆反应:可逆反应的特征:“两同”是指可逆反应的重要特征是转化率永远不可能达到,也就是反应一旦开始,那么,就只存在反应物,或只存在生成物。
例1.密闭容器中充入SO2和由18O原子组成的O2,一定条件下反应,在达到平衡前,18O存在于()A、只存在于氧气中B、只存在于和SO3中C、只存在于SO2和SO3中D、SO2、SO3、O2中都有可能存在。
例2.在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是()A.Z为0.3mol/LB.Y2为0.35mol/LC.X2为0.2mol/LD.Z为0.4mol/L二.化学平衡状态讨论1:可逆反应CO+H2O(g)CO2+H2,在1L密闭容器中进行,已知起始时,CO和H2O(g)的物质的量均为0.05mol,请你画出反应物浓度和生成物浓度随时间变化的图形(c—t图)及反应速率(v正、v逆)随时间变化的图形(v—t图)并总结规律。
化学平衡状态是指:化学平衡状态研究的对象是:例3.在一定条件下,某容器内充入N2和H2合成氨,以下叙述中错误的是( )A、开始反应时,正反应速率最大,逆反应速率为零。
B、随着反应的进行,正反应速率减小,最后降为零。
C、随着反应的进行,正反应速率减小,逆反应速率增大,最后相等。

选修四第二章第三节化学平衡状态本章导学:1.掌握化学反应速率的计算和比较,掌握外界因素对化学反应速率的影响;2.掌握化学平衡状态的特征、标志和外界因素对化学平衡状态的影响;3.掌握化学平衡常数的应用和判断化学平衡移动的方向;4.掌握有关化学平衡的计算题和图像题的做法和技巧。
第三节第一课时化学平衡状态学习目标:1.掌握化学平衡状态的特点2.掌握化学平衡状态的判断方法想一想:1.影响化学反应速率的外界条件有:等,此外还有光、固体表面积等其他因素。
2.列举三个学过的可逆反应:特点:特点:特点:3. 溶解平衡:当固体物质溶解进行到一定程度,固体溶质的速率与溶液中溶质的速率相等,此时溶液处于饱和状态,溶液的浓度和固体溶质的质量都。
填一填:一.可逆反应与不可逆反应1.概念:在下,既能向方向进行又能向方向进行的化学反应。
2.表示方法:约定采用“”表示,把从左向右的反应称作,从右向左的反应称作。
例如:。
3.特征:;;。
4. 不可逆反应:有些化学反应的正反应进行程度特别大,逆反应进行程度太小因而可以忽略,把这类反应叫做不可逆反应,用“”符号表示,例如:。
二.化学平衡状态1. 化学平衡状态的建立:在一定的条件下,把一个可逆反应的反应物加入固定体积的密闭容器中,反应过程如下:反应过程可表示如下:2.化学平衡状态(1). 概念:一定条件下,可逆反应中,正反应速率与逆反应速率相等,反应混合物中各种物质的保持不变的状态。
(2). 特征:注意事项(1)化学平衡状态是一定条件下的可逆反应进行到最大限度的结果。
(2)对于一个既定的可逆反应,如果其他条件一定,不论采取何种途径(反应是从反应物开始或从生成物开始),最后都能建立化学平衡状态。
(3)化学平衡状态不会因时间变化而变化。
(4)可逆反应达到化学平衡状态的根本原因是v(正)=v(逆),正是由于各物质的消耗速率与生成速率相等,才会有反应混合物中各组分的浓度保持不变。
(3).判断化学平衡状态的标志对于可逆反应m A(g)+n B(g) p C(g)+q D(g)。

1第三节 化学平衡---化学平衡状态教学目标1.使学生建立化学平衡的观点,并通过分析化学平衡的建立,增强学生的归纳和形象思维能力。
2.使学生理解化学平衡的特征,从而使学生树立对立统一的辩证唯物主义观点。
教学重点:化学平衡的建立和特征。
教学难点:化学平衡观点的建立。
一、化学平衡的研究对象可逆反应:,既可以向正反应进行,又可以向逆反应进行方向的反应。
【注】任何一个可逆反应都不会进行到底的,最终达到平衡状态时,一定是每一种反应物和生成物都存在。
【练习1】下列为可逆反应的是…………………………………………………………( ) A 氢气与氧气点燃可化合成水,水电解可生成氢气和氧气,因此氢气与氧气的反应是可逆反应。
B 在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又有分解。
C 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这二个反应互为可逆反应。
【注】只有在“同一条件下”同时进行的才互为可逆反应。
二、化学平衡的建立某温度时,在一个2L 的密闭容器中,X 、Y 、Z 三种物质的物质的量随时间的变化曲线如右图所示,根据图中数据,填写下列空白:(1)该反应的化学方程式为______________________________ (2)反应开始至2min ,气体Z 的平均反应速率为____________ (3)请画出该反应从开始到平衡时的速率-时间图:三、化学平衡状态的定义化学平衡状态,就是指在一定条件下的可逆反应里,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
注意三点1.前提(适用范围):2.内在本质3.外在标志四、化学平衡状态的特征 (1)逆(2)等 (3)动(4) 定 (5)变五、化学平衡状态的标志 直接判断法①正反应速率等于逆反应速率v(正)= v(逆) ②各成分的浓度保持不变 间接判断法①化学键的断裂与形成②各成分的质量、物质的量、质量分数、物质的量分数、转化率等不随时间变化而变化 ③各气体的体积不随时间变化而变化 特殊标志判断法反应体系的总压强、总物质的量、总质量、混合气体的平均分子量、密度等都是有条件的特殊规律,视具体反应、具体条件决定是否可作为平衡的标志。

第十课酎《化学平衡》第1课时导学案学平衡将被打破,直到建立新的平衡。
【我的疑问】【课堂探究】探究一:如果你是一家工厂的老板,你肯定希望生产快而且反应物最好全部转化为生成物,这样的愿望都能实现吗?请先回答下列问题。
(1) ImoL氮气与3moL氢气充分反应,能生成2moL氨气吗?请根据方程式做解释说明。
C2)从符号、各物质存在情况、反应进行的方向、速率的种类等方面列表比较可逆反应与非可逆反应的区别。
常见可逆反应有哪些?写出方程式。
探究二:以合成氨为例解释,在可逆反应的过程中,各物质的物质的量和浓度会有什么样的变化?速率会有什么样的变化?当正逆反应速率相等时,各物质的量和浓度还会变化吗?为什么探究三:结合探究一和二的知识回答。
(1)哪类反应才有化学平衡?平衡后速率有什么关系?C2)平衡后量和浓度还变化吗?反应真的停止了吗?C3)什么情况下,能使化学平衡改变?【课堂小结】3化学平衡.可逆反应1.定义:2.特征:.化学平衡1.定义:2.化学平衡的建立:(用速率与时间的关系图表示)3.化学平衡的特征:【课堂检测】1.在容积固定为1L的容器中进行以下反应:X2(g)+Y2(g)=2Z(g)(可逆反应),已知的起始物质的量分别为0. ImoL、0.3 moL、0.2 moL,在一定条件下,当反应进行到某一时刻,各物质的量可能是:()A、Z 为 0. 3 moLB、Z 为 0. 4moLC、X?为 0. 2 moLD、Y?为 0. 4 moL2.在一定条件下,使N0与Q在一容积不变的容器中反应,下列说法不正确的是:()A、反应开始时,正反应速率最大,逆反应速率为零B、随着反应的进行,正反应速率逐渐减小,最后为零C、随着反应的进行,逆反应速率逐渐增大,最后不变D、随着反应的进行,正反应速率逐渐减小,中不变3.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)=H2(g)+L(g)在反应趋向平衡状态的过程中,下列说法正确的是()A. HI的生成速率等于其分解速率B. HI的生成速率小于其分解速率C. HI的生成速率大于其分解速率D.无法判断HI的生成速率和分解速率的相对大小【课堂反思】。


化学平衡图像导学案(第一课时 )学习目标:1.掌握化学平衡图像的一般分析方法2.学会利用“先拐先平”“定一议二”的方法,解释常见的速率及平衡图像问题。
【知识回顾】一、影响化学平衡移动的因素化学平衡移动原理:如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够这种改变的方向移动。
1.浓度:增大反应物浓度,平衡向移动,减小生成物浓度,平衡向移动;减小反应物浓度,平衡向移动,增大生成物浓度,平衡向移动。
2.温度:温度升高,会使化学平衡向反应的方向移动;温度降低,会使化学平衡向反应的方向移动。
3.压强:(1)增大压强,平衡向气体体积的方向移动;减小压强,平衡向气体体积的方向移动。
(2)反应前后气体体积没有变化的反应,改变压强平衡移动。
4.催化剂:使正逆反应速率同等程度的增大而平衡不移动【新课预习】二、化学平衡图象的分析思路解题步骤:(1)看图像:一看面(即纵坐标与横坐标的意义),二看线(即线的走向和变化趋势),三看点(即起点、折点、交点、终点),四看辅助线(如等温线、等压线、平衡线等),五看量的变化(如浓度变化、温度变化等)。
(2)想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3)作判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断解题关键:(1)“先拐先平,数值大”原则:在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度高或表示的压强较大。
(2)“定一议二”原则:在含量---温度(或压强)曲线中,图像中若有三个变量,先确定一个量不变,再讨论另外两个量的关系(因为化学平衡移动原理只适用于外界“单因素”的改变所导致的平衡移动的分析),即确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后(通常作一条横坐标的垂线),讨论横坐标与曲线的关系。
三、化学平衡图象的类型1、物质的量(或浓度)--时间图像[例1] 600℃时,A、B、C三种气体在密闭容器中浓度的变化情况如图1所示,试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为__ ___.(4)4min后,若增大压强,平衡(填“正反应方向,逆反应方向”)移动,A的转化率。

第三节 化学平衡(第一课时)【目标】1.建立化学平衡的观点,并通过分析化学平衡的建立,增强归纳和形象思维能力。
2.理解化学平衡的特征,从而树立对立统一的辩证唯物主义观点。
【重点】 化学平衡的建立和特征。
【课前回顾】在合成氨工业中,除了需要考虑如何使N 2和H 2尽快地转变成NH 3外,还需要考虑怎样才能使更多的N 2和H 2转变为NH 3,因为该反应(还有很多反应)是可逆反应。
一、可逆反应与不可逆反应复习:什么叫可逆反应?可逆反应有哪些特点?【预习】阅读25页,然后分析:在一定温度下,将过量的蔗糖溶于100mL 水的过程中,溶解和结晶的速率发生了什么变化? 刚开始: 过程中: 一定时间后:【讨论】在一定条件下,达到溶解平衡后,剩余蔗糖晶体的质量和溶液的浓度是否变化?溶解和结晶过程是否停止?【讨论】可逆反应为什么有“度”的限制?“度”是怎样产生的?二、化学平衡的建立过程那么对于可逆反应来说,又是怎样的情形呢?我们以CO 和H 2O (g)的反应为例来说明化学平衡的建立过程。
在反应CO + H 2O CO 2 + H 2中,将0.01mol CO 和0.01mol H 2O (g)通入1L 密闭容器中,反应一段时间后,各物质浓度不再变化。
①、反应刚开始时: 反应物浓度___________,正反应速率____________生成物浓度为_________,逆反应速率为__________②、反应过程中: 反应物浓度___________,正反应速率___________生成物浓度____________,逆反应速率___________③、一定时间后,必然出现_________________________,即正反应消耗的量与______ ___________________,反应物和生成物的浓度____________________。
1、化学平衡的定义:在 反应,正反应和逆反应速率 ,反应混合物中各组分的 或 保持 的状态。
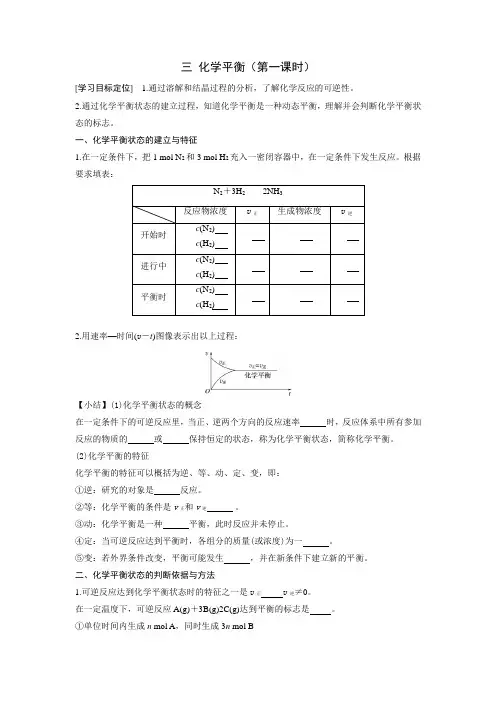
三化学平衡(第一课时)[学习目标定位] 1.通过溶解和结晶过程的分析,了解化学反应的可逆性。
2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判断化学平衡状态的标志。
一、化学平衡状态的建立与特征1.在一定条件下,把1 mol N2和3 mol H2充入一密闭容器中,在一定条件下发生反应。
根据要求填表:N2+3H22NH3反应物浓度v正生成物浓度v逆开始时c(N2) c(H2)进行中c(N2) c(H2)平衡时c(N2) c(H2)2.用速率—时间(v-t)图像表示出以上过程:【小结】(1)化学平衡状态的概念在一定条件下的可逆反应里,当正、逆两个方向的反应速率时,反应体系中所有参加反应的物质的或保持恒定的状态,称为化学平衡状态,简称化学平衡。
(2)化学平衡的特征化学平衡的特征可以概括为逆、等、动、定、变,即:①逆:研究的对象是反应。
②等:化学平衡的条件是v正和v逆。
③动:化学平衡是一种平衡,此时反应并未停止。
④定:当可逆反应达到平衡时,各组分的质量(或浓度)为一。
⑤变:若外界条件改变,平衡可能发生,并在新条件下建立新的平衡。
二、化学平衡状态的判断依据与方法1.可逆反应达到化学平衡状态时的特征之一是v正v逆≠0。
在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是。
①单位时间内生成n mol A,同时生成3n mol B②C的生成速率与C的分解速率相等③3v正(A)=v逆(B)④单位时间内生成n mol A,同时生成2n mol C2.可逆反应达到化学平衡状态时的另一特征是反应混合物中各组分的百分含量保持不变。
一定温度下,在容积恒定的密闭容器中进行如下反应:A(s)+2B(g)C(g)+D(g)。
当下列物理量不发生变化时,能表明该反应已达到平衡状态的是。
①混合气体的总物质的量②B的物质的量浓度③容器内气体的压强④混合气体的密度【达标检测】1.下列关于化学平衡状态的理解正确的是()A.所有反应都存在平衡状态B.反应物与生成物的浓度相等C.正反应与逆反应停止进行D.正反应和逆反应的速率相等2.14CO2与碳在高温条件下发生反应:14CO2+C2CO,达到化学平衡后,平衡混合物中含14C 的粒子有()A.14CO2B.14CO2、14COC.14CO2、14CO、14CD.14CO3.下列关系中能说明反应N2(g)+3H2(g)2NH3(g)已经达到平衡状态的是()A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)4.工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是()A.单位时间内消耗2 mol的CO同时生成2 mol的CO2B.两个H—O键断裂的同时有一个H—H键断裂C.反应容器内的压强不再发生变化D.混合气体的相对分子质量不发生变化5.在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g)2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,达到平衡时浓度可能正确的是()A.SO2、O2分别为0.4 mol·L-1、0.2 mol·L-1B.SO2为0.25 mol·L-1C.SO2、SO3均为0.15 mol·L-1D.SO2为0.24 mol·L-1,SO3为0.14 mol·L-1。
化学平衡计算教案王瑞燕课题化学平衡计算课型习题课授课时间4月2日(星期二)第1课时(共1课时)教学目标知识与技能:通过练习使学生理解转化率、百分含量、化学平衡常数的含义。
过程与方法:通过练习使学生掌握化学平衡的基本计算方法—三段式法。
情感态度与价值观:培养学生的逻辑思维能力和科学态度,培养学生的归纳总结能力。
教学重点理解化学平衡常数概念及化学平衡的简单计算教学难点化学平衡综合计算主要教法例题讲解,讨论,归纳教具导学案,课件学法指导练习,总结,应用板书设计化学平衡计算一基本方法—三段式法二常见考点1 恒温、恒容时:p1/p2=n1/n2恒温、恒压时:V1/V2 = n1/n22 v=△C/△t3 A的转化率=A的消耗量/A的起始量4 恒容时,化学反应速率之比=化学计量数之比=浓度变化量之比例题:2SO2(g)+O2(g)2SO3(g)起始(mol/L)2 2 0变化(mol/L)x x/2 x平衡(mol/L)2-x 2-x/2 x教学后记本节课小组讨论充分,组长组织讨论效率较高,全体学生都积极参与了讨论。
参与展示的4位同学均为化学成绩中等的学生,但他们都书写工整,正确达率75%。
参与点评的3位优秀学生中,有两位讲解清楚,知识点讲解到位,得到在场老师的鼓掌和表扬。
本节课不足之处:我预计教授13分钟,结果讲了18分钟。
其原因,不应在课堂上推导密度之比等于物质的量反比,导致没有时间做小测。
所选的拓展提升的题目,应把密度之比改为压强之比。
本节课也体现了我高三教学经验欠缺,知识面窄的弊端。
本节课成功之处:教学环节设计合理,导学案选题数量合理,基础练习和难题相结合,知识归纳与习题环环相扣,体现了从例题归纳方法,然后利用方法解答习题的教学过程。
教师讲解习题清楚,规范,注意细节。
教师对学生的学习情况掌握十分清楚,提问有针对性。
本次课堂小测应作为下次课的课前小测。
教学过程(含时间分配)。
教学活动及教师活动学生活动【引入】本次月考题得分率最低的一道题就是最后一道计算题。

化学平衡教学设计【优秀6篇】(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如总结报告、合同协议、规章制度、条据文书、策划方案、心得体会、演讲致辞、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample essays, such as summary reports, contract agreements, rules and regulations, doctrinal documents, planning plans, insights, speeches, teaching materials, complete essays, and other sample essays. If you want to learn about different sample formats and writing methods, please pay attention!化学平衡教学设计【优秀6篇】作为一名教学工作者,时常需要编写教案,教案是教材及大纲与课堂教学的纽带和桥梁。

第三节-化学平衡移动(1)导学案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第三节化学平衡——平衡移动(第一课时)【学习目标】1、知识目标:正确理解浓度、温度对化学平衡的影响。
2、能力目标:通过实验探究温度、浓度对化学平衡的影响,培养学生利用实验探究、分析、解决问题能力。
3、情感目标:培养学生透过现象看本质的科学态度与科学素养。
【重点难点】浓度、温度对化学平衡的影响。
【复习回顾】1、可逆反应:在同一条件下,既能向进行,同时又能向向进行的反应,叫做可逆反应。
2、化学平衡状态的定义:在一定条件下的可逆反应里,和相等,反应混合物中各组分的保持不变的状态,称为化学平衡状态,简称化学平衡。
3、平衡状态的特征(用五个字概括):4、影响化学反应速率的外界因素主要有:【学习过程】自主学习——思考交流1、什么是化学平衡状态的移动?(1)定义:把可逆反应中的破坏、建立的过程叫做化学平衡的移动。
思考1:归纳平衡移动的根本原因平衡移动的标志(2)总结:化学平衡移动的根本原因是,化学平衡移动的标志是。
(3)化学平衡的移动方向的速率判断:①若外界条件变化引起v(正)>v(逆):平衡向移动;V 正V 逆 V 逆V 正 V ′正 V ′逆②若外界条件变化引起v (正)<v (逆):平衡向 移动;③若外界条件变化引起v (正)=v (逆):旧平衡未被破坏,平衡 。
2、影响化学平衡状态的因素有哪些?3、4、浓度如何影响化学平衡?(1)增大反应物浓度,平衡向 移动; (2)减小生成物浓度,平衡向 移动; (3)减小反应物浓度,平衡向 移动; (4)增大生成物浓度,平衡向 移动。
5、温度如何影响化学平衡?6、温度升高,会使化学平衡向着 反应的方向移动; 温度降低,会使化学平衡向着 反应的方向移动。
课堂探究考点一 浓度对化学平衡的影响观察[实验2—5] 方程式: Cr 2O 72-+H 2O2 CrO 42-+2H +(橙色) (黄色)[实验2—6] 方程式:FeCl 3 + 3KSCNFe(SCN)3 + 3KCl(浅黄色) (无色) (血红色)(无色)填写课本上表格,并判断上述化学平衡发生了怎样的变化?1、规律:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,都可以使平衡向 移动;增大生成物浓度或减小反应物浓度,都可以使平衡向 移动。
第26讲化学平衡考点一可逆反应与化学平衡状态导学案知识目标:1.了解化学反应的可逆性;2.了解化学平衡建立的过程,掌握化学平衡的概念;3.理解化学平衡状态的标志。
核心素养:1.变化观念与平衡思想:知道化学变化需要一定的条件,并遵循一定规律;认识化学变化有一定限度,是可以调控的。
能多角度、动态地分析化学反应,运用化学反应原理解决实际问题。
2.证据推理与模型认知:建立观点、结论和证据之间的逻辑关系;知道可以通过分析、推理等方法认识化学平衡的特征,建立模型。
通过运用模型解释化学现象,揭示现象的本质和规律。
重点:化学平衡状态的标志难点:化学平衡状态的标志复习知识:1.可逆反应(1)定义在同一条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点①二同:a.相同条件下;b.正、逆反应同时进行。
②一小:反应物与生成物同时存在;任一组分的转化率都小于(填“大于”或“小于”)100%。
(3)表示在方程式中用“”表示。
(4)说明:严格说来,几乎所有的化学反应都是可逆的(可逆是绝对的,不可逆是相对的),但各种化学反应的可逆程度有很大的差别。
例如:由H2和F2化合生成HF,由Ag+和Cl—生成AgCl沉淀,这些反应的可逆程度很小,一般看作不可逆反应或单向反应,用“=”表示。
思考一:可逆反应N2+3H2 2NH3,在体积为10L的密闭容器中进行,开始时加入2mol N2和3mol H2,达到平衡时,NH3的浓度不可能是()A、0.1mol/LB、0.02mol/LC、0.05mol/L D 、0.2mol/L2.化学平衡状态(1)概念一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持不变的状态。
(2)建立(3)平衡特点逆:化学平衡的研究对象是可逆反应;等:v(正)= v(逆);动:化学平衡是一种动态平衡,即v(正)= v(逆)≠0;定:条件不变时,各组分浓度保持不变;变:条件改变时,化学平衡发生移动。
内蒙古赤峰市高中化学第二章第三节化学平衡1导学案新人教版选修4 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(内蒙古赤峰市高中化学第二章第三节化学平衡1导学案新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为内蒙古赤峰市高中化学第二章第三节化学平衡1导学案新人教版选修4的全部内容。
第三节化学平衡第二课时【目标分解】: 理解压强、温度对化学平衡的影响,并能利用勒夏特列原理加以解释。
【重、难点】:压强、温度对化学平衡的影响【复习】:1。
他条件不变的情况下,增大反应物浓度,或减小生成物浓度,化学平衡移动。
减小反应物浓度,或增大生成物浓度,化学平衡移动。
2.已知氯水中存在如下平衡: Cl 2+H2O HCl+HClO。
常温下,在一个体积为50ml的针筒内吸入40mL氯气后,再吸入10mL的水。
写出针筒中可能观察到的现象。
若将此针筒长时间放置,又可以看到何种变化?试用平衡的观点加以解释。
【学习过程】2. 压强对化学平衡的影响:如可逆反应aA (g) + bB(g) cC (g)(1)推断:若a+b ﹥c 即反应前气体体积大于反应后气体体积:①增大体系的压强,V正和V逆都增大,但V正增大的倍数于V逆增大的倍数,则平衡向反应方向移动。
②减小体系的压强,V正和V逆都减小,但V正减小的倍数于V逆减小的倍数,则平衡向反应方向移动。
(2)v — t图:如下图。
注意:与浓度的影响v — t图有何差别?【练习一】:作出a+b ﹤c 和a+b = c 时的v—t图(3)规律:①.对反应前后气体总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,会使化学平衡向着体积____的方向移动;减小压强,会使化学平衡向着体积______的方向移动.②.反应前后气态物质的总体积没有发生变化,增大或减小压强都使化学平衡移动。
第三节影响化学平衡的因素导学案学习目标:1.化学平衡移动的意义。
2.描述浓度、压强、温度等条件对化学平衡的影响3.理解勒沙特列原理的涵义学习重点:2.描述浓度、压强、温度等条件对化学平衡的影响3.理解勒沙特列原理的涵义学习难点:理解勒沙特列原理的涵义 一、温故互查请你说出浓度、压强、温度、催化剂等外界条件对化学反应速率的影响1. 浓度2.压强 2. 温度 4.催化剂 二、 设问导读1.浓度对平衡的影响观察试验2-5:结论是,在其他条件不变的情况下:增大反应物浓度,增大正反应速率,v(正)﹥v(逆)。
化学平衡向 移动。
减小生成物浓度,减小逆反应速率,v(正)﹥v(逆)。
化学平衡 移动。
增大生成物浓度,增大逆反应速率,v(逆)﹥v(正)。
化学平衡向 移动。
减小反应物浓度,减小正反应速率,v(逆)﹥v(正)。
化学平衡 移动。
注意:固体物质和纯液体无所谓浓度,其量改变,不影响平衡。
2、压强对平衡的影响⑴对反应前后气体总体积发生变化的化学反应,在其他条件不变的情况下:增大压强,相当于增大反应物、生成物的 ,正逆反应速率都 ,会使化学平衡向着气体 方向移动。
减小压强,相当于减小反应物、生成物的 ,正逆反应速率都 ,会使化学平衡向着气体 方向移动。
⑵对于有些可逆反应里,反应前后气态物质的总体积没有发生变化,如2HI(g)H 2(g)+I 2(g)在这种情况下,增大压强 ,即v(正)=v(逆),减小压强 ,即v(正)=v(逆)。
因而都不能使化学平衡移动。
3、温度对化学平衡的影响任何反应都伴随着能量的变化,通常表现为放热或吸热;所以温度对化学平衡移动也有影响。
大家观察试验2-7,得出结论:如果升高温度,v(正) 、v(逆)都增大,平衡向 的方向移动; 如果降低温度,v(正) 、v(逆)都减小,平衡向 的方向移动。
4、催化剂能够同等程度的改变正逆反应的速率,v(正)=v(逆)。
所以使用催化剂 使平衡发生移动,但是可以改变达到平衡所需要的 。
《等效平衡》教学设计(第1课时)西安铁一中张宁一、教材分析本节是新课程人教版高中化学选修4第二章《化学反应速率和化学平衡》第三节后的补充内容,学生已经学习了化学平衡建立条件,影响平衡移动的因素和化学平衡常数等知识,在学生已有的这些知识基础之上再次螺旋上升式,课本中无此相关内容,但2002年全国高考化学卷第一次出现该知识点的考查,学生得分率仅为2℅,此后凡讲授到《化学平衡》知识点时的必加内容,同时本节知识也是对化学平衡知识的一种典型应用。
二、学情分析化学平衡移动反应机理不是高中讲述的重点知识,中学只是强调应用,等效平衡本身抽象,不易理解,加之学生的抽象逻辑思维和相关机理知识都不太充分,不易理解本节知识,针对高二学生年龄及思维特点,通过建立化学模型,可以将抽象思维形象化,逻辑思维具体化,同时搭建小组研讨平台,集思广益、思维碰撞更能激发学生学习和思考积极性,帮助学生加强对知识的深入理解和探究。
三、教学目标1.知识与技能(1)通过构建化学模型,了解等效平衡的概念(2)理解等效平衡的判断方法,对简单的等效平衡会进行判断及相关计算2.过程与方法通过小组探究活动的开展、化学模型的构建,完成对等效平衡的概念的建立和简单使用。
3.情感态度与价值观目标:通过组内合作、组间评价体会探究化学问题的一般过程,激发化学学习热情。
四、教学重点: 等效平衡的概念建立和判断方法;五、教学难点:构建化学模型分析和判断不同种类的等效平衡六、重难点突破策略采用“模型构建+问题解决式”教学模式,先创设问题情景引入本课题,再通过化学模型建构引导学生建立合理分析思路,直观得出建立化学平衡状态的几种途径,接着分学习小组开展问题讨论,完成恒温、恒容和恒温、恒压条件下的等效平衡特点和判定方法总结。
然后小组内学生讲解,组间学生提问,进一步完善结论,突破难点,最后教师归纳总结,并进行教学评价——例题演练,反馈知识学习情况。
七、课时设计 2课时八、教学过程。
第三节 化学平衡第1课时 可逆反应与化学平衡状态1.了解化学反应的可逆性,了解可逆反应的概念。
2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡。
3.能根据化学平衡状态的特征,判断化学平衡状态的标志。
可逆反应与不可逆反应1.可逆反应(1)概念:在相同条件下,既能向正反应方向进行同时又能向逆反应方向进行的化学反应。
(2)表示方法:采用“”连接,把从左向右进行的反应称作正反应,把从右向左进行的反应称作逆反应。
例如:SO 2和O 2的反应可表示为2SO 2+O 2催化剂△2SO 3。
2.不可逆反应有些反应的逆反应进行程度太小因而可忽略,把这类反应称作不可逆反应,用“===”连接。
例如:Ba 2++SO 2-4===BaSO 4↓。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)酯化反应属于可逆反应。
( )(2)NH 3和HCl 生成NH 4Cl 与NH 4Cl 分解生成NH 3和HCl 互为可逆反应。
( )(3)可逆反应中反应物的转化率能达到100%。
( )答案:(1)√ (2)× (3)×2.下列各组两个反应互为可逆反应的是( )①H 2+Cl 2=====点燃2HCl 与2HCl=====电解H 2↑+Cl 2↑②H 2SO 4(浓)+2HBr===2H 2O +Br 2+SO 2↑与Br 2+SO 2+2H 2O===2HBr +H 2SO 4③2NO 2===N 2O 4与N 2O 4===2NO 2④2SO 2+O 2=====催化剂△2SO 3与2SO 3=====催化剂△2SO 2+O 2 A .①②B .②③C .③④D .②④ 解析:选C 。
可逆反应必须是在相同条件下同时向正、逆两个方向都能进行的反应,③④互为可逆反应。
可逆反应的特征(1)双向性:可逆反应分为方向相反的两个反应:正反应和逆反应。
(2)双同性:正、逆反应在相同条件下是同时进行的。
姓名 班级 小组 评价 使用时间
第三节 化学平衡
第一课时
学习目标
1、理解化学平衡状态等基本概念。
2、理解化学平衡状态形成的条件、适用范围、特征。
重 点、难 点
1、化学平衡的概念及特征;
2、化学平衡状态的判断。
自主学习
一.可逆反应与不可逆反应
1.溶解平衡:当温度一定时,饱和溶液中的固体溶质溶解和溶液中的溶质分子回到固体溶质表面的结晶过程两种过程的速率 ___,于是饱和溶液的浓度和固体溶质的质量都 ___。
我们把这类过程称作 __。
表述这类过程时,采用“ ”来代替反应式中原来用的“====”号,把从左向右的过程称作 ___;由右向左的反应称作 _。
溶解、结晶过程可表示为:固体溶质溶液中的溶质
2.可逆反应:在同一条件下,既能向 进行,同时又能向 向进行的反应,叫
做可逆反应。
绝大部分的反应都存在可逆性,一些反应在一般条件下并非可逆反应,只不过可逆程度小而将其忽略了而已。
3.不可逆反应:能进行到底的反应。
如:H 2的燃烧、酸碱中和、生成沉淀的发应、生成气体的反
应、一些氧化还原反应。
二、化学平衡状态
化学平衡状态的定义:在一定条件下的可逆反应里, 和 相等,反应混合物中各组分的 保持不变的状态,称为化学平衡状态,简称化学平衡。
合作探究
一.探究化学平衡状态
1.探究问题:当蔗糖不再溶解时,我们说它形成了饱和溶液。
这是大
家对蔗糖的宏观认识,那微观世界有时一个怎样的过程呢?
分析:一方面蔗糖分子不停的脱离蔗糖晶体表面溶解浸入水中;另
一方面,溶解进入水中的蔗糖分子又不停地聚集在蔗糖晶体的表面。
开始时 :v (溶解) v (结晶)=0;
过程中:v (溶解)逐渐减小,v (结晶)逐渐增大;
形成饱和溶液后 :v (溶解) v (结晶)。
2.通过蔗糖溶解平衡的规律总结化学平衡的特征: (1)动 : ,达平衡后,正逆反应仍在进行(v (正)= v (逆)≠0)
(2)等 : (注意是同一物质的正逆反应速率)
(3)定 :反应混合物中各组分的 ,各组分的 。
(4)变 :条件改变,原平衡被破坏,在新的条件下建立新的平衡。
3.化学平衡状态的建立
以可逆反应mA(g)+nB(g)pC(g)为例,若开始只有反应物,
没有生成物,此时A 和B 的浓度最大,因而, ____最大;
而C 起始浓度为零,因而_ _____为零。
随着反应的进行,
反应物不断减少,生成物不断增多,v (正)越来越小,v (逆)越来
υ溶解 υ结晶 υ溶解=υ结晶 υ
越大,反应进行到某一时刻,v (正)=v (逆),这时就达到了化学平衡,
请画出化学平衡状态的建立的速率—时间图:
二、探究化学平衡状态的标志
某可逆反应是否处于化学平衡状态的标志:可以通过化学平衡状态的本质特征(即v 正=v 逆)和宏观
表现(即各组分浓度保持不变)来进行衡量,以N 2+3H 2 2NH 3 为例,反应在一恒容密闭容器中
进行,请各举三例:
1.v 正=v 逆,它是判断化学平衡状态的主要标志【提示:从同一物质、不同物质和断键数目方面考
虑】:
2.反应混合物中各组分的浓度保持不变,是判断化学平衡状态的另一个主要标志【提示:从物质
的量、物质的量浓度、质量分数、体积分数、颜色(若有颜色物质的反应)、压强、平均摩尔质量以及
混合气体的密度等方面考虑】:
巩固提高
Ⅰ
1.化学平衡主要研究下列哪一类反应的规律( )。
A.可逆反应
B.任何反应
C.部分反应
D.气体反应
2.在已达到平衡的可逆反应2SO 2(g)+O 2(g)
2SO 3(g),充入由18O 组成的氧气一段时间后,18O 存在下列物质中的( )
A .多余的氧气中
B .生成的三氧化硫中
C .氧气和二氧化硫中
D .二氧化硫、氧气和三氧化硫中
3.下列有关可逆反应的说法不正确的是( )
A .可逆反应是指在同一条件下能同时向正逆两个方向进行的反应
B .2HI H 2+I 2是可逆反应
C .2H 2+O 2,2H 2O 与2H 2O ,2H 2↑+O 2↑互为可逆反应
D .只有可逆反应才存在化学平衡
4.下列哪个说法可以证明反应N 2+3H 22NH 3已达到平衡状态( )。
A.1个N ≡N 键断裂的同时,有3个H-H 键形成
B.1个N ≡N 键断裂的同时,有3个H-H 键断裂
C.1个N ≡N 键断裂的同时,有6个N-H 键形成
D.1个N ≡N 键断裂的同时,有6个H-H 键形成
5.在2NO 2 N 2O 4的可逆反应中,下列状态属于平衡状态的是( )。
A.υ(NO 2消耗 )=υ(N 2O 4生成)≠0时的状态
B.NO 2全部转变成N 2O 4的状态
C.c (NO 2)=c (N 2O 4)的状态
D.体系的颜色不再发生变化的状态
6.一定温度下,可逆反应2NO 2(g) 2NO(g)+O 2(g)在体积固定的密闭容器中反应,达到平衡状态的
标志是( )
①单位时间内生成n mol O 2,同时生成2n mol NO 2
②单位时间内生成n mol O 2,同时生成2n mol NO
③用NO 2、NO 、O 2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A .①④⑤⑥
B .①②③⑤
C .②③④⑥
D .以上全部
7.在一定条件下,使NO 和O 2在一密闭容器中进行反应,下列说法中不正确的是( )
△
点燃 电解
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
8.在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,表明反应
A(s)+2B(g)C(g)+D(g)已达平衡状态的是()
A.混合气体的密度B.混合气体的总物质的量
C.混合气体的压强D.混合气体的总体积
Ⅱ
9.一定条件下密闭容器中,可逆反应2A(g)B(g)+3C(g)在下列四种状态中处于平衡状态的是() 速率
mol/(L·min)
A B C D
v正v(A)=2 v(A)=1 v(A)=1 v(B)=3
v逆v(B)=2 v(B)=1.5 v(C)=1.5 v(C)=1
10.在2升的密闭容器中,发生以下反应:2A(g)+B(g)2C(g)+D(g)。
若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是() A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
11.在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:
I 2(g)+H2(g)2HI(g)。
(1)反应刚开始时,由于c(H2)=mol/L,c(I2)=mol/L,而c(HI)=,所以化学反应速率____________最大,而________最小(为零);
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2) ,c(I2)______ __,而c(HI)____ ______,从而化学反应速率v正_____ _______,而v逆______ __;
(3)当反应进行到v正与v逆________时,此可逆反应就达到了平衡,若保持外界条件不变时,反应混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
12. 将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)x C(g)+2D(g),经5min 后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min) 。
求:(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值是多少?
Ⅲ
参考答案
自主学习
一、1.相等保持不变可逆过程“”正反应逆反应
2.正反应方向逆反应的方向
二、 1.正反应速率逆反应速率浓度
合作探究
一、1.﹥ = 2.(1)动态平衡 (2)v(正)= v(逆)) (3)浓度保持一定含量保持不变。
3.v(正) v(逆) (图略)
二、1.v(N2)消耗=v(N2)生成;3v(N2)消耗 =v(H2)生成;断1个N≡N键的同时,断3个H-H(其它合理也可)
2.N2的物质的量浓度不变;N2的体积分数不变;平均摩尔质量不变(其它合理也可)
巩固提高
I:1.A 2.D 3.C 4.A 5.D 6.A 7.B 8.A II: 9.C 10.B
11.(1)a
V b
V0v正v逆(2)减小减小增大减小增大(3)相等保持不变
(2)反应放热使温度升高,故反应速率加快HNO3浓度降低,故反应速率又逐渐减小(3)AB
12.(1),c(A)=0.75mol/L n(A)=3mol n(B)=3mol (2)0.05mol/(L·min) (3)2。