九年级化学上册 2.3 原子的构成(第2课时)复习 (新版)鲁教版.doc
- 格式:doc
- 大小:2.47 MB
- 文档页数:5

课题第三节原子的构成课型新授第2 课时第周年月日教学目标1.了解原子的实际质量和相对原子质量的关系,理解相对原子质量的概念。
2.学会计算原子的相对原子质量。
学情分析通过前面的学习,学生道分子、原子的根本性质;原子的质量主要集中在原子核上。
但使用、书写、记忆都不方便,所以引入相对原子质量的概念。
重点相对原子质量的概念难点相对原子质量的意义关键点理解“相对〞的含义教学媒体多媒体素材教学方法自学研究法、讲述法、谈话法、讨论法、练习法板书设计第三节原子的构成一、原子的构造二、原子中的电子三、相对原子质量公式1 公式2相对原子质量=质子数+中子数填表:原子种类质子数中子数核外电子数相对原子质量氢 1 0氧8 16镁12 12铁26 56相对原子质量=三、相对原子质量公式1公式2相对原子质量=质子数+中子数第三节原子的构成〔第二课时〕复习:3.原子的质量主要集中在什么地方?×10-26Kg×10-26Kg书写、记忆、使用都不方便×10-27Kg〕作为标准,其他原子的质量跟它的比值,就是这种原子的相对原子质量。
原子的质量主要集中在原子核上,那么,原子的相对原子质量也是由原子核决定的。
总结:1.2.3.4.5.请看下表,按要求答复以下问题原子种类质子数中子数核外电子数相对原子质量氢 1 0氧8 16镁12 12铁26 56个别答复、书写以下说法是否正确?1.相对原子质量就是原子的真实质量。
3.原子的实际质量越大,其相对原子质量越大。
观察P39几种常见原子的相对原子质量,并与原子构造相比拟。
在线测试P401.,2.长话短说P43讨论:科学家发现相对原子质量为1、2、3的三种氢原子,你认为它们在构造上有什么异同。
挑战自我P43 1,2,3⑴请把左图中的空白处填完整。
⑵通过填表,分析数据,你从中得出什么规律〔至少写两条〕①②③相对原子质量=。


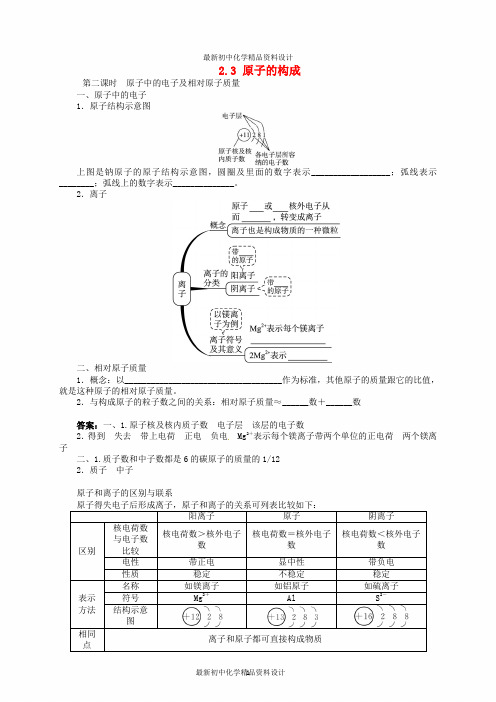
2.3 原子的构成第二课时 原子中的电子及相对原子质量一、原子中的电子1.原子结构示意图上图是钠原子的原子结构示意图,圆圈及里面的数字表示__________________;弧线表示________;弧线上的数字表示______________。
2.离子二、相对原子质量1.概念:以____________________________________作为标准,其他原子的质量跟它的比值,就是这种原子的相对原子质量。
2.与构成原子的粒子数之间的关系:相对原子质量≈______数+______数答案:一、1.原子核及核内质子数 电子层 该层的电子数2.得到 失去 带上电荷 正电 负电 Mg 2+表示每个镁离子带两个单位的正电荷 两个镁离子二、1.质子数和中子数都是6的碳原子的质量的1/122.质子 中子原子和离子的区别与联系 原子得失电子后形成离子,原子和离子的关系可列表比较如下:阳离子 原子 阴离子区别核电荷数与电子数比较 核电荷数>核外电子数 核电荷数=核外电子数 核电荷数<核外电子数 电性 带正电 显中性 带负电性质 稳定 不稳定 稳定表示方法 名称 如镁离子 如铝原子 如硫离子符号 Mg 2+ Al S 2- 结构示意图相同点离子和原子都可直接构成物质联系①具有相同核电荷数的离子和原子属同种元素②阳离子原子阴离子【例题】(2011·攀枝花中考改编)(1)氯原子的原子结构示意图为,氯原子的最外层电子数为______。
下列图中微粒共表示__________种原子,另一种是__________;其中与氯原子具有相似化学性质的是________(填序号)。
(2)某阳离子的结构示意图为,则x的数值可能是下列中的。
A.9B.10C.11D.12解析:(1)质子数与核外电子数相等的表示原子,B、C、D均表示原子;A中质子数大于核外电子数,表示阳离子。
最外层电子数相同的原子化学性质相似,氯原子的最外层电子数是7,与D最外层电子数相同,所以化学性质相似。


优质资料---欢迎下载课题:第二单元探秘水世界第三节原子的构成(第2课时)总第11课时●教学目标:1、认识原子中的电子是怎样运动的,了解原子结构示意图,并会应用。
2、知道稀有气体原子结构、金属原子结构、非金属原子结构的特点,在化学反应中是怎样得失电子的。
3、初步认识核外电子在化学反应中的作用,知道离子是怎样形成的,学会离子的表示方法,知道离子也是构成物质的基本离子。
●教学重点:原子结构示意图、离子的形成过程、离子符号的表示方法。
●教学难点:离子的形成过程。
●考点、易错点:原子结构示意图的应用●学情分析:学生通过第一课时已经认识原子结构,并知道了电子围绕原子核做高速运动,但怎样做高速运动不容易想象,到底有什么规律,核外电子对原子在化学变化中有什么作用,这都将成为本节课学习的难点。
●课时:第1课时●教学流程设计教学设计们无法知道它在某一时刻所处的位置。
但有一点是确定的,电子能运动,说明电子本身有一定的能量。
【质疑】你认为原子中的电子是怎样运动的呢?【课件】介绍波尔的原子模型,引导学生说明原子结构示意图各部分的含义。
【课件】展示1-20号原子结构示意图,你能总结出核外电子的排布有什么规律吗?【质疑】由原子结构示意图能否总结出金属原子,非金属原子、稀有气体原子的最外层电子数的一般规律?【简介】稀有气体元素:8(He为2),是一种稳定结构。
【说明】在化学反应中,原子核是不变的,改变的是原子核外的电子,因此,原子是化学变化中的最小粒子。
【活动二】认识离子的形成:以氯化钠的形成过程为例讲解离子的形成过程。
【小结】离子的符号、意义、分类。
【质疑】钠、镁、铝原子容易形成什么离子?氧、氟、氯原子容易形成什么离子?(资料:得到一个电子和失去一个电子消耗的能量相同)【小结】电子在化学反应中的作用:金属原子:小于4,不稳定,易失去电子,形成阳离子;非金属原子:大于或等于4,不稳定,易等到电子,形成阴离子;稀有气体原子:8,稳定。
2.3 原子的构成
第二课时原子中的电子及相对原子质量
一、原子中的电子
1.原子结构示意图
上图是钠原子的原子结构示意图,圆圈及里面的数字表示__________________;弧线表示________;弧线上的数字表示______________。
2.离子
二、相对原子质量
1.概念:以____________________________________作为标准,其他原子的质量跟它的比值,就是这种原子的相对原子质量。
2.与构成原子的粒子数之间的关系:相对原子质量≈______数+______数
答案:一、1.原子核及核内质子数电子层该层的电子数
2.得到失去带上电荷正电负电Mg2+表示每个镁离子带两个单位的正电荷两个镁离子
二、1.质子数和中子数都是6的碳原子的质量的1/12
2.质子中子
原子和离子的区别与联系
原子得失电子后形成离子,原子和离子的关系可列表比较如下:
②阳离子
原子
阴离子【例题】 (2011·攀枝花中考改编)(1)氯原子的原子结构示意图为,氯原子的最
外层电子数为______。
下列图中微粒共表示__________种原子,另一种是__________;其中与氯原子具有相似化学性质的是________(填序号)。
(2)某阳离子的结构示意图为,则x 的数值可能是下列中的 。
A.9
B.10
C.11
D.12
解析:(1)质子数与核外电子数相等的表示原子,B 、C 、D 均表示原子;A 中质子数大于核外电子数,表示阳离子。
最外层电子数相同的原子化学性质相似,氯原子的最外层电子数是7,与D 最外层电子数相同,所以化学性质相似。
(2)当此结构为原子结构示意图时,质子数=核外电子数,x =2+8=10;此结构为阳离子结构示意图时,则x >10,当x =11,该微粒为Na +
,当x =12时,该微粒为Mg 2+
,所以选C 、
D 。
答案:(1)三 离子 D (2)CD
1.参考下列物质的微观结构图示,其中由阴、阳离子构成的物质是( )。
2.(2011·济南中考)下列各结构示意图表示的原子中,最容易形成阳离子的是()。
3.(2011·无锡中考改编)镁原子的结构示意图为:
,下列说法错误的是()。
A.镁原子核外有3个电子层
B.镁原子在化学反应中容易失去电子
C.镁离子最外层有2个电子
D.镁原子与镁离子的化学性质不同
4.(2011·泰州中考改编)下图是三种微粒的结构示意图,有关它们的说法正确的是()。
A.它们原子的最外层电子数相同
B.它们的核外都有两个电子层
C.它们的性质相同
D.它们都是原子
5.物质是由原子、分子、离子等粒子构成。
今有一粒子,其原子核内有16个质子、16个中子,原子核外有18个电子,该粒子是()。
A.原子B.阳离子
C.阴离子D.分子
6.下列有关分子、原子和离子的说法正确的是()。
A.分子是保持物质性质的一种粒子
B.物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变
C.分子、原子、离子都可以直接构成物质
D.在化学反应中,任何粒子都不能再分
7.如图是钠原子结构示意图。
根据图可知钠原子中质子数为______,在化学反应中钠原子
容易______(填得失几个电子),而变成________ (用符号表示)。
8.A、B、C三种粒子结构示意图如下图所示:
A B C
(1)当A、B为原子时,x=______;y=______。
(2)C表示的粒子符号是______,该粒子与B粒子形成的物质是由______ (填“分子”“原子”或“离子”)构成的。
答案
1.C 2.C 3.C 4.B 5.C 6.C
7.答案:11失去一个电子Na+
8.答案:(1)81(2)Cl-离子
解析:(1)当A、B为原子时,质子数=核外电子数,故x=2+6=8,2+8+y=11,y=1。
(2)C 表示的粒子核外电子数>质子数,属于阴离子,根据质子数为17,电子数比质子数大1,可判断该粒子为Cl-,B粒子为钠原子,两者形成的物质为氯化钠,是由离子构成的。