(完整版)ACS抗血小板与抗凝治疗新进展
- 格式:doc
- 大小:37.51 KB
- 文档页数:8

NSTE-ACS综合治疗策略新进展-2019年华医网继续教育答案2019年华医网继续教育答案-403-NSTE-ACS综合治疗策略新进展备注:红色选项或后方标记“[正确答案]”为正确选项一)NSTE-ACS治疗策略指南解读1、中国NSTE-ACS指南建议对具有至少1条极高危标准的患者选择紧急侵入治疗策略(<2h),如()A、心肌梗死相关的肌钙蛋白上升或下降B、ST段或T波的动态改变(有或无症状)C、糖尿病D、致命性心律失常或心脏骤停[正确答案]E、PCI史2、中国指南建议所有NSTE-ACS患者双抗疗程至少()A、3个月B、6个月C、12个月[正确答案]D、18个月E、24个月3、中国NSTE-ACS指南建议对具有至少1条高危标准的患者选择早期侵入策略(<24h),如()A、血活动力学不不乱或心原性休克B、药物治疗无效的重复发作或延续性胸痛C、GRACE评分>140[正确答案]D、初期心肌梗死后心绞痛E、PCI史4、根据XXX指南,如果入院时hs-cTn水平(),此后1小时内显著升高,提示NSTEMI可能性极大A、≥5ng/LB、≥12ng/LC、≥32ng/LD、≥50ng/LE、≥52ng/L[正确答案]5、中国NSTE-ACS指南建议进行高敏肌钙蛋白的检测并在()内获得结果A、30minB、60min[精确谜底]C、2hD、3hE、6h6、中国NSTE-ACS指南推荐对心律失常风险低危的NSTEMI患者,心电监测()或直至PCIA、6hB、12hC、24h[正确答案]D、36hE、48h7、中国NSTE-ACS指南中替格瑞洛的负荷剂量为()A、75mgB、90mgC、180mg[精确谜底]D、300mgE、600mg8、多半NSTE-ACS患者心律变态变乱产生在症状发作()以内A、6hB、12h[正确答案]C、24hD、36hE、48h9、中国指南发起NSTE-ACS归并糖尿病患者降压治疗舒张压的方针值为()A、<80mmHgB、<85mmHg[精确谜底]C、<90mmHgD、<95mmHgE、<100mmHg10、NSTE-ACS最敏锐和最特异的生物标志物是()A、心肌肌钙卵白[精确谜底]B、肌红卵白C、CK-MBD、CKE、LD1二)NSTE-ACS抗凝治疗战略1、以下关于UFH与XXX有误的是()A、UFH的平均分子量为B、XXX难监测C、UFH的生物利费用>90%[精确谜底]D、LMWH的清除以肾脏为主E、UFH的抗Xa/抗IIa为1:12、比伐芦定对已经结合的凝血酶抑制率可达到()A、0.5B、0.6C、0.8D、0.9E、1[精确谜底]3、磺达肝癸钠的半衰期为()A、11小时B、13小时C、15小时D、17小时[正确答案]E、19小时4、在PCI或经皮腔内冠状动脉成形术中,比伐芦定滴注时间可延长至术后()A、2小时B、4小时[正确答案]C、6小时D、8小时E、10小时5、以下关于磺达肝癸钠有误的是()A、单一化学实体成份B、靶位高度选择性C、经肝脏代谢肃清[精确谜底]D、高度特异结合抗凝血酶E、无药物间相互作用6、中国NSTE-ACS指南建议,无论采用何种治疗策略,磺达肝癸钠()皮下注射的药效和安全性最好A、1.0mg/dB、1.5mg/dC、2.0mg/dD、2.5mg/d[正确答案]E、3.0mg/d7、以下关于比伐芦定特点的特点有误的是()A、是凝血酶的直接、特异抑制剂B、与游离和结合的凝血酶均能直接结合C、与凝血酶的结合过程是可逆的D、抗凝结果可展望,且耐受性好E、会激活血小板[精确谜底]8、磺达肝癸钠抑制凝血酶的作用靶点为()A、凝血酶ⅠB、凝血酶ⅡC、凝血酶ⅡaD、凝血酶XE、凝血酶Xa[正确答案]9、比伐芦定的半衰期约为()A、5分钟B、15分钟C、25分钟[正确答案]D、35分钟E、45分钟10、华法林属于()A、间接凝血酶抑制剂B、间接凝血酶抑制剂C、凝血酶受体拮抗剂D、维生素K依赖性抗凝剂[正确答案]E、去纤维蛋白原制剂三)NSTE-ACS抗血小板治疗进展1、根据2017ESCDAPT指南,推荐ACS患者抗血小板治疗优选替格瑞洛;推荐替格瑞洛()用于高缺血风险心梗史患者延长期治疗A、30mgB、60mg[正确答案]C、90mgD、120mgE、180mg2、根据2016中国PCI指南对NSTE-ACS患者的推荐,所有无禁忌证、缺血中-高危风险的患者,建议首选()A、XXXB、氯吡格雷C、XXXD、替格XXX[正确答案]E、依诺格雷3、NSTE-ACS患者口服阿司匹林首剂负荷量为()A、50~100mgB、75~150mgC、100~200mgD、150~300mg[精确谜底]E、200~400mg4、NSTE-ACS抗血小板治疗中,P2Y12受体抑制剂除非有极横跨血风险等忌讳证,在阿司匹林基础上应结合使用1种P2Y12受体抑制剂,并维持最少()A、3个月B、6个月C、12个月[正确答案]D、18个月E、24个月5、以下必需静脉给药的是()A、XXXB、氯吡格雷C、XXX[精确谜底]D、XXXE、依诺格雷6、NSTE-ACS抗血小板治疗的基石是(),如无禁忌证,无论采用何种治疗策略,所有患者均应口服A、阿司匹林[正确答案]B、氯吡格雷C、XXXD、替XXXE、XXX7、以下属于可逆性非噻吩并吡啶类P2Y12受体抑制剂的是()A、噻氯匹定B、氯吡格雷C、XXXD、替格XXX[正确答案]E、替XXX8、替XXX的失活工夫为()A、30-60minB、6-12hC、1-3天D、3-5天[精确谜底]E、5-7天9、XXX禁止与()联合用药A、XXXB、头孢克肟C、XXXD、克拉霉素[精确谜底]E、阿奇霉素10、以部属于噻吩并吡啶类P2Y12受体抑制剂的是()A、阿司匹林B、氯吡格雷[精确谜底]C、XXXD、XXX。



2021年ACS合并肾功能不全患者的抗血小板治疗(全文)急性冠脉综合征是在冠状动脉粥样硬化不稳定斑块破裂或糜烂的基础上继发血栓形成、冠状动脉痉挛狭窄甚至闭塞,心肌缺血缺氧而产生的一系列临床综合症。
主要包括不稳定型心绞痛和非ST段抬高型心肌梗死,合称为非ST段抬高型急性冠脉综合症(non-ST segment elevation acute coronary syndrome,NSTEACS);急性ST段抬高型心肌梗死(ST segment elevation acute coronary syndrome,STEACS )。
ACS的治疗原则是尽快恢复血流灌注,预防严重不良反应后果,其中抗血小板治疗是必不可少的重要治理措施。
但是,对于伴有肾功能不全患者来说,因为抗血小板药物在体内的药物代谢动力学和药物效应动力学的改变,导致出血风险增加,所以临床上应密切结合患者肾功能情况合理选择药物及其剂量。
本文旨在通过对国内外近期研究进行分析总结ACS合并肾功能不全患者抗血小板治疗策略。
1.流行病学现状2019年一项前瞻性城乡流行病学研究[1]揭示全球疾病死亡新趋势:心血管疾病是最常见的死亡原因,总占比为40%,低收入和中等收入国家分别为43%和41%,而在高收入国家为23%,这与过去二十年高收入国家心血管疾病死亡率数据相比发生了明显下降。
心血管疾病是全球处于35-70岁阶段内成年人死亡的主要原因。
Baber等研究[2]选择了19832例ACS行PCI治疗患者,其中合并慢性肾功不全的患者占28.3%。
Sattar等人做的一项回顾性队列研究[3]观察了160名接受PCI治疗的ACS合并肾功能不全患者,在住院期间三分之一的患者发生肾功能恶化,经常出现不良事件,住院死亡率高达17.5%。
一项研究[4]表明肾功能不全使ACS患者的心血管病风险更大,预后更差,一旦透析患者出现STEMI或NSTEMI,2年死亡率均超过70%。

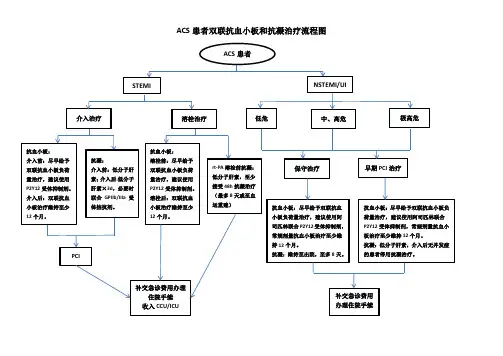
急性冠脉综合征(ACS)的抗血小板双联抗血小板实用总结急性冠脉综合征(ACS):冠脉不稳定斑块破裂或糜烂继发新鲜血栓致急性缺血综合征,包括:STEMI和非ST段抬高型心肌梗死(NSTEMI)、不稳定性心绞痛(UA),NSTEMI与UA合称NSTE-ACS o基本治疗抗血小板、抗缺血。
无论ACS是否血运重建史,接受长期DAPT(双联抗血小板)是获益的。
-:非血运重建ACS者的DAPT(双联抗血小板)建议:(目前尚缺乏ACS患者P2Y12受体抑制剂单独使用临床证据)1 :接受单纯药物治疗者建议DAPT至少12个月。
2 :既往有心梗病史且存在高缺血风险者,若12个月内耐受DAPT 且无出血并发症,可阿司匹林基础上予替格瑞洛60mgbid延长方案,最长36个月。
3 :处于高出血风险(如PREQSE-DAPT>25分或符合ARC-HBR 标准)者至少1个月DAPT o4 :P2Y12受体抑制剂建议用替格瑞洛而非氯毗格雷,除非出血风险大于潜在缺血获益。
因替格瑞洛疗效优于氯叱格雷且不增加主要出血事件。
对于未计划血运重建且无高出血风险可予P2Y12负荷量预治疗。
(注:ACS为急性冠状动脉综合征;DAPT为双联抗血小板治疗;ARC-HBR为学术研究联合会高出血风险工作组)二:ACS者接受PCI术后DAPT的建议:1:PCI术前均阿司匹林150~300mg负荷剂量联合P2Y12受体抑制剂负荷剂量预治疗:P2Y12受体抑制剂首选替格瑞洛(负荷剂量18Omg,维持剂量90mgbid),当替格瑞洛不可及、无法耐受或有禁忌证时,用氯叱格雷(负荷剂量300〜600mg,维持齐(]量75mgqd)o①替格瑞洛与氯叱格雷相比作用更强、起效更快。
PQ术前服用替格瑞洛后1年的MACE(心血管事件)发生率低于氯叱格雷组且主要出血风险无差异。
院前启用替格瑞洛较院内启用降低术后24h和30d 内支架血栓形成发生率。
在排除主动脉夹层/脑出血后,对低危出血风险者尽早予替格瑞洛预治疗。


抗凝治疗及研究新进展近年来对于心房颤动(AF,房颤)和静脉血栓栓塞等的预防和治疗都是热点话题,特别是新型口服抗凝药(NOAC)的广泛应用给临床医生和患者提供了更多、更优的选择。
2018年ESC上公布了关于抗凝治疗的临床试验结果,现简略介绍如下。
一、心肌血运重建指南抗栓治疗部分更新要点抗栓治疗作为心肌血运重建围术期的基本治疗策略,对于急性冠脉综合征(ACS)患者减少心血管事件风险、改善近远期预后具有重要意义。
2018欧洲心脏病学会(ESC)/欧洲心胸外科学会(EACTS)公布的《心肌血运重建指南》关于抗栓抗凝首次提出对于非瓣膜性房颤患者同时接受抗凝和抗血小板治疗时,新型口服抗凝药(NOAC)优于维生素K拮抗剂(VKA)(Ⅱa)。
二、有关抗凝的临床试验研究结果2018年ESC上公布了17项最新的临床试验研究结果,有关抗凝的研究如下:1、MARINER研究:因心力衰竭、呼吸功能不全、卒中和传染性/炎症性疾病而住院的患者在出院后仍有静脉血栓栓塞(VTE)的风险,但出院后延长血栓预防策略的作用仍存在争议。
MARINER研究是一项大型国际、多中心、随机、双盲、安慰剂对照试验,旨在评估患者出院后口服利伐沙班预防VTE的安全性和有效性。
该研究于2014年6月至2018年1月共在全球36个国家671个中心纳入了12024名VTE风险升高的患者,入组患者随机分为两组,从出院时开始分别接受45天的利伐沙班(10 mg,每日一次)或安慰剂治疗,主要效益终点为症状性静脉血栓栓塞症或因静脉血栓栓塞症死亡的复合终点。
研究结果表明,利伐沙班组主要终点事件发生率较安慰剂组更低(0.83%vs1.10%),但差异无统计学意义;次要终点非致死性静脉血栓栓塞症在利伐沙班组和安慰剂组的发生率分别为0.18%和0.42%,差异有统计学意义;在安全性方面,与安慰剂组相比,利伐沙班组未显著增加大出血风险。
综上,从统计学的角度来说,MARINER研究的结果是阴性的,但在慢性疾病和重症疾病患者的抗凝治疗方面,由于既往研究结果并不一致,MARINER研究做了积极的探索。

急性冠脉综合征如何进行抗血小板治疗(完整版)一、抗血小板药物分类(一)抑制花生四烯酸代谢药物阿司匹林为代表的抗血小板药物,通过抑制血小板环氧化酶产生,从而阻断花生四烯酸氧化合成血栓烷A2(TXA2),从而对TXA2的合成产生抑制作用,进而对血小板聚集产生抑制作用,最终起到抑制血栓形成作用[1]。
目前阿司匹林作为用于ACS的一线抗血小板的药物被广泛应用,其有效性被大量证据所证实,但仍有部分患者使用阿司匹林后出现血栓事件,其中部分患者已证实存在“阿司匹林抵抗”。
阿司匹林抵抗机制尚未被完整清晰阐述,但目前可通过血栓弹力图及基因诊断等检查发现其存在,并通过更换药物和调整剂量,增加抗血小板聚集作用。
(二)增高环磷酸腺苷(cAMP)水平药物增高cAMP水平药物主要包括腺苷酸环化酶抑制剂和选择性血小板磷酸二酯酶抑制剂两种。
腺苷酸环化酶抑制剂常见药物如贝前列素、伊洛前列腺素等,但因其半衰期短,稳定性差等原因,不适合应用于ACS长期治疗,因此临床上应用较少。
选择性血小板磷酸二酯酶抑制剂中常见药物包括西洛他唑、双嘧达莫等。
两种药物作用机制相似,均以抑制磷酸二酯酶活性,提高血小板内cAMP浓度,使血小板聚集受到抑制。
其中西洛他唑可通过抑制血管内膜基质中金属蛋白酶的表达,进而抑制血管内膜的过度增生。
西洛他唑常用无法耐受阿司匹林同时需进行ACS双抗治疗的患者中,替代阿司匹林抗血小板治疗[2]。
(三)血小板膜受体抑制剂药物1.二磷酸腺苷P2Y12抑制剂抗剂(1)不可逆P2Y12受体抑制剂:噻吩吡啶类药物,进入体内经肝细胞色素P450代谢为活性物质,阻断ADP通道,从而抑制血小板聚集。
代表药物氯吡格雷,普拉格雷,噻氯匹定。
其中氯吡格雷在我国广泛应用于抗血小板聚集治疗,其作用优于噻氯匹定,普拉格雷国内尚无上市。
在广泛应用氯吡格雷过程中发现,其具有明确有效的抗血小板聚集作用,又具有安全、出现风险较低等优势,但同时又存在诸多缺陷。

ESC2023急性冠脉综合征(ACS)指南:更新要点总结欧洲心脏病学会(ESC)于2023年8月25日发表了新版《急性冠脉综合征管理指南》(以下简称《指南》),列出的推荐意见共有193条,I 类推荐106条,∏类推荐70条,HI类推荐17条。
指南内容包括:急性冠脉综合征的诊断,疑似患者的初步治疗,该类患者急性期管理、抗血栓治疗、住院期间管理、侵入性治疗技术及多支血管病变的管理,以及冠状动脉非阻塞性心肌梗死(MINOCA)的管理和长期治疗等。
一、急性冠脉综合征的综合管理:新《指南》强调急性冠脉综合征(ACS)临床表现多种多样,患者可以从无症状到持续胸部疼痛、血流动力学不稳定或心源性休克、甚至心脏骤停,通过综合考虑症状、体征、心电图以及高敏肌钙蛋白的变化,可以对疑似ACS的患者进行诊断、分级和风险评估。
(图1):■ESC)新《指南》强调根据初诊时的12导联心电图,快速将ACS 患者分为 ST 段抬高型心肌梗死(STEMI )和非-ST 段抬高型ACS (NSTE-ACS ), 以便引导相应的治疗路径(图2)。
新《指南》建议通过5个〃Think 〃,掌握ACS 患者管理策略(图3)。
第一个〃Think 〃是在初步诊断和评估时,根据"ACS.〃进行判断:A (Abnorma1ities 心电图异常)、C (Context 临床表现)和S (Stabi1ity 病情是否稳定)。
这些是医生接诊ACS 患者时首先需要考虑的因素。
第二个〃Think 〃是根据初步评估结果,决定是否立即进行侵入性诊疗:对于STEM1患者,需要立即直接经皮冠状动脉介入治疗(PPCI );而对于具有非常高风险特征的NSTE-ACS 患者,则需要立即实施紧急策略,包括血管造影术,如果需要,可以立即行PCI 治疗;对于具有高危特征的 NSTE-ACS 患者,应该考虑早期介入干预策略,应考虑24小时内进行血管造影。
C1inka1presentation ECG∕→ IfapM<f⅞chiss⅞n√sympcormwggeι<jveofACS.performanECGwithinIOmmofFMC hι-cTnIeveii 十[Furtherinvestigations] [WOrkingdiagnosis'] STEMNSTE-ACSFina1diagnosis。
临床急性冠脉综合征综合征临床治疗建议、流行病学、诊断工具、抗栓治疗、护理措施及治疗原则建议1.ACS患者的抗血小板和抗凝治疗如因进行冠状动脉搭桥术而停止双联抗血小板治疗,建议其在手术后恢复DAPT至少12个月。
对于老年ACS患者,尤其是高出血风险患者,可考虑应用P2Y12抑制剂氯吡格雷进行抗血小板治疗。
2.抗血栓治疗的替代方案对于已进行3-6个月DAPT治疗患者,如缺血事件风险不高,应考虑单联抗血小板治疗。
在某些患者中,P2Y12受体抑制剂单药治疗可被认为是阿司匹林单药长期治疗的替代方案。
对于HBR患者,在进行DAPT治疗1个月后,可考虑应用阿司匹林或P2Y12受体抑制剂进行单药治疗。
对于需要应用口服抗凝剂可考虑在6个月时停用抗血小板治疗,同时继续OAC治疗。
不在ACS事件发生后的前30天内进行抗血小板降阶治疗。
3.心脏骤停和院外心脏骤停对所有心脏骤停后昏迷的幸存者,应入院72h后神经预后评估。
对于院外心脏骤停的患者,考虑根据当地协议将患者转运至心脏骤停中心。
4.侵入性治疗策略对于自发性冠状动脉夹层患者,仅建议有持续性心肌缺血症状/体征、大面积心肌高危和前向血流减少的患者进行PCI。
应考虑应用血管内成像来指导PCI。
对于尚未确定罪犯血管,可考虑应用血管内成像,且可优选光学相干断层扫描。
5.以心源性休克为表现的ACS伴多支血管病变患者,非罪犯血管(IRA)可考虑进行分期PCI。
6.合并MVD的血流动力学稳定的STEMI患者进行直接PCI。
对非IRA,基于血管造影显的严重程度来制定PCI治疗策略。
对于首次PCI的患者,不建议对IRA的非罪犯节段进行侵入性心外膜功能评估。
7.ACS并发症对于在心梗后至少5天的等待期内,高度房室传导阻滞仍未解决的患者,建议进行永久性起搏器植入。
对超声心动图不明确或临床高度怀疑左心室血栓的患者,应考虑进行心脏磁共振检查。
对于急性前壁心梗患者,如果超声心动图无法清楚的显示心尖,则可考虑使用造影超声心动图来检测左室血栓。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ ACS抗血小板与抗凝治疗新进展急性冠脉综合征抗血小板与抗凝治疗新进展急性冠脉综合征(ACS) 是以冠状动脉粥样硬化斑块破裂或糜烂,继发斑块表面血栓形成和/或远端血栓栓塞,造成完全或不完全心肌缺血为特征的一组疾病。
根据心电图表现, ACS 分为 STE-ACS和 NSTE-ACS。
STE-ACS 反映了冠状动脉急性完全闭塞,血栓成分以纤维蛋白和红细胞为主,即红血栓。
NSTE-ACS 反映了冠状动脉非完全闭塞,血栓成分以血小板为主,即白血栓。
无论 STE-ACS 还是 NSTE-ACS,血栓形成和/或血栓栓塞都是最主要的病理生理机制,因此,抗栓在 ACS 的治疗中占据极为重要的地位。
血小板活化与凝血系统激活是血栓形成和/或血栓栓塞过程中具有决定性作用的两个关键环节,两者在体内紧密联系,凝血系统激活后产生的凝血酶,是一个强有力的血小板活化因子,血小板活化后又将促进凝血过程。
抗栓治疗应针对凝血系统和血小板两个环节,分别称为抗凝治疗和抗血小板治疗。
全球每年有 1700 万人死于心血管疾病, ACS 患者住院期间及远期死亡率分别为 6%和 12%。
1/ 8大量的研究证明,抗凝和抗血小板药物的联合使用一方面可以降低 ACS 患者血栓事件的发生率,改善预后;但另一方面,各种出血并发症的发生率增加同样威胁患者的生命。
因此,平衡血栓与出血风险是 ACS 患者抗血小板与抗凝治疗的重点及难点,尤其在高危患者和某些特殊人群如高龄、肾功能不全等。
一、抗血小板治疗首先,无论 STE-ACS 还是 NSTE-ACS,急性期双联(甚至多联)抗血小板治疗是必须的。
抗血小板药物主要有阿司匹林、氯吡格雷、血小板膜糖蛋白Ⅱ b/Ⅲa(GPⅡ b/Ⅲa)受体拮抗剂和西洛他唑等。
阿司匹林是目前应用最广泛的抗血小板药物,是冠心病抗血小板治疗的基石。
大量临床试验和荟萃分析已经证实了它可降低冠心病患者的缺血事件。
目前,多数指南推荐 ACS 患者起始负荷剂量为 160~325 mg (非肠溶制剂),急性期剂量应在 150~300 mg/d 之间,3 天后可改为小剂量即 75~100 mg/d 维持治疗。
所有患者在口服阿司匹林的基础上还推荐联合应用氯吡格雷,急性期立即给予氯吡格雷 300~600 mg 的负荷剂量,然后每天 75 mg 维持。
在考虑行 PCI的患者,可使用 600 mg 氯吡格雷作为负荷剂量以更迅速地抑制血小板的功能。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 无论接受内科保守治疗、 PCI 还是 CABG 的患者,均能从双联抗血小板治疗中获益。
多数指南推荐置入药物洗脱支架(DES)后应使用双联抗血小板药物至少 1 年。
为预防 PCI 术后极晚期血栓形成,是否应将阿司匹林和氯吡格雷的联合使用时间从目前的 9~12 个月疗程延长至 2 年或更长时间?最新发表的 PCI 术后的随访研究结果显示,使用氯吡格雷>12 个月组的患者 24 个月死亡率明显低于使用氯吡格雷<12 个月组的患者,死亡和心肌梗死(myocardial infarction, MI)的联合终点也低于后者,由此证实,延长氯吡格雷使用时间(>1 年)会给 DES 患者带来益处,但这仍需要进一步的试验研究。
目前,在临床实践中决定双联抗血小板药物的使用时间应综合考虑出血并发症和费用效益比。
正在进行的INSIGHT 试验也比较了置入 DES 患者氯吡格雷的标准治疗和延长治疗的疗效,期待它的结果会为我们带来更准确的答案。
在中危和高危的患者,尤其是存在肌钙蛋白升高或糖尿病者,建议在双联抗血小板治疗的基础上,加用 GP IIb/IIIa 受体拮抗剂。
大规模临床试验结果显示GPⅡ b/Ⅲa 受体拮抗剂可使接受 PCI 术的ACS 患者的死亡率和缺血事件的发生率明显降低。
3/ 8荟萃分析表明,GPⅡ b/Ⅲa 受体拮抗剂对接受 PCI 的 ACS 患者益处最大;对未常规计划进行但可能接受 PCI 的患者有中等益处;对不进行 PCI 的患者益处最小。
2007 年 ACC/AHA/SCAI 关于 UA/NSTEMI 的 PCI 指南指出:对预行 PCI 的 UA/NSTEMI 患者,尤其是高危患者,应静脉应用GPⅡ b/Ⅲa 拮抗剂。
对可能行 PCI 的患者,阿昔单抗是上游GPⅡ b/Ⅲa 受体拮抗剂的首选药物,对于不行 PCI 的患者,依替巴肽或替罗非班是首选药物。
ACC/AHA 2007 年关于 STEMI 的 PCI 指南指出,对于已接受抗凝、拟行 PCI 的患者,应考虑应用GPⅡ b/Ⅲa 受体拮抗剂。
西洛他唑为选择性的磷酸二酯酶Ⅲ抑制剂,除有抗血小板聚集和舒张周围血管的作用外,它还具有抗平滑肌细胞增生、改善内皮功能等作用。
近年来,一些基础和临床研究显示,西洛他唑可降低PCI 术后支架内血栓的形成和再狭窄。
DECLARE-LONG 及DECLARE-DIABETES 研究结果显示与标准的双联抗血小板治疗相比,包括西洛他唑的三联抗血小板治疗可显著降低支架内再狭窄率及主要不良心脏事件,且不显著增加出血事件。
但西洛他唑预防 PCI术后急性并发症的研究证据尚不充分。
目前,欧美冠心病指南中尚没有对西洛他唑的推荐,但 PCI 术后有氯吡格雷禁忌证的患者,可以考虑用西洛他唑替代。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 近年来新研制出的 ADP P2Y12 受体拮抗剂包括普拉格雷( Prasugrel)、替格雷洛( Ticagrelor, AZD6140)和坎格雷洛(Cangrelor),研究数据显示,三者的抗血小板作用均强于氯吡格雷。
目前, 3 种新型抗血小板药物正在进行大规模、前瞻性、随机临床试验的研究。
二、抗凝治疗对于 ACS 患者,推荐在抗血小板治疗的基础上同时根据缺血和出血事件的风险决定是否使用抗凝治疗。
目前临床上最常使用的抗凝药物包括普通肝素(UFH)、低分子肝素(LMWH)等,这些药物的临床价值已得到许多大型临床试验的证实而广泛应用于临床实践。
而一系列新型抗凝药物包括磺达肝癸钠(fondaparinux)、比伐卢定(bivalirudin)等凭借各自的特点,新近也已开始应用于 ACS 患者的治疗。
LMWH 疗效稳定,不需监测 APTT 或 ACT,出血、血小板减少等合并症少。
在急诊介入治疗方案中,应立即开始使用 UFH 或LMWH; PCI 术时,无论最初使用的抗凝药是 UFH 还是 LMWH,应在术中继续使用;PCI 术后 24 小时内可以停用抗凝药物。
在药物治疗方案中, LMWH 可持续使用至出院时。
多项临床研究的荟萃分析显示:对于非 ST 段抬高的急性冠脉综5/ 8合征患者,依诺肝素治疗的疗效优于普通肝素,而出血的风险两者相当。
依诺肝素治疗的优越性在 1 年随访期内持续存在。
华法林低强度或中等强度抗凝不能使NSTE-ACS 患者受益,因而不宜使用;但是如果合并心房颤动或人工机械瓣,则应使用华法林。
磺达肝癸钠是第一个人工合成的 Xa 因子选择性抑制剂,以1:1 的比例与抗凝血酶(AT)上的戊糖结构结合而抑制因子 Xa,这种结合是可逆的。
磺达肝癸钠不影响 AT 对凝血酶(IIa 因子)的抑制,与血小板也没有相互作用,经静脉或者皮下给药后,仅导致 aPTT或 PT 时间轻度异常,且不影响 AT 水平和出血时间。
PENTUA 研究显示,小剂量磺达肝癸钠有效性与依诺肝素组相似,但出血发生率显著降低,该研究确立了 2.5 mg/d 是治疗 ACS 患者的标准剂量。
OASIS 5 研究奠定了磺达肝癸钠在 NSTE-ASC 患者抗凝治疗的地位,磺达肝癸钠(2.5 mg/d 皮下注射8 天)近期疗效不劣于依诺肝素(1 mg/kg 一天两次),严重出血事件发生率显著低于依诺肝素,但磺达肝癸钠冠脉导管内的血栓形成高于依诺肝素(0.9%和0.4%,P=0.001)。
ESC 指南中在非急症情况下如果尚未决定是否采用早期有创性---------------------------------------------------------------最新资料推荐------------------------------------------------------ 治疗策略均推荐磺达肝癸钠(IA)。
ACC/AHA 指南中对保守策略推荐推荐磺达肝癸钠(IB)并对出血风险增加的患者更推荐使用(IB)。
OASIS 6 研究是一项在 STE-AMI 患者中评价磺达肝癸钠与对照治疗的疗效和安全性的随机、双盲对照研究。
结果显示,与常规治疗相比,磺达肝癸钠显著降低近期事件发生率。
ACC/AHA及 ESC STEMI 指南对接受非再灌注治疗患者均推荐磺达肝癸钠(IB)。
ACC/AHA 指南对接受纤维蛋白溶解再灌注治疗患者推荐磺达肝癸钠(IB)。
ESC 指南对接受链激酶溶栓治疗患者推荐磺达肝癸钠(IIaB)。
高龄是抗栓治疗出血的危险因素,肾功能不全也是出血的独立危险因素。
所有 ACS 患者应该常规进行肾脏功能评价,尤其是老年人、低体重和女性患者,建议采用 Cockroft-Gault 公式计算肌酐清除率。
现有循证医学表明,磺达肝癸钠不宜用于肌酐清除率20ml/min 的患者,肌酐清除率为 20~50 ml/min 的患者进行静脉血栓栓塞预防时,给药剂量应减少至 1.5 mg,每日一次。
OASIS 5 研究中, 65 岁以上患者出血发生率明显高于 65 岁以下患者,但是与依诺肝素比较,磺达肝癸钠出血危险仍较低,无7/ 8肾功能受损的老年患者(75 岁)无需调整剂量。
肝素诱导的血小板减少(HIT)是肝素的常见并发症,也是药物相关性免疫介导血小板减少最常见的原因, UFH 和 LMWH 均可诱发 HIT。
磺达肝癸钠与血小板没有相互作用,不会导致 HIT,目前尚未见相关的报道。
发生 HIT 时往往会导致严重的血栓栓塞事件,血小板严重下降(超过 50%)。