全血基因组DNA的提取
- 格式:ppt
- 大小:1.71 MB
- 文档页数:22

全血基因组DNA提取试剂盒使用说明一、试剂盒组成及存储条件:1.试剂盒包括蛋白酶K、缓冲液、洗涤缓冲液、脱水溶液等。
2.试剂盒应存放在4℃以下避光干燥处,避免冻结。
二、实验前准备:1.准备所需的实验耗材和设备,如离心管、恒温振荡器、离心机等。
2.取出全血样品,可以是新鲜全血或已离心制备的全血细胞。
三、DNA提取步骤:1.取出全血样品,用洗涤液洗涤细胞沉淀并离心收集,去除红细胞。
2.加入蛋白酶K将细胞裂解,释放DNA。
3.加入缓冲液和脱水溶液,沉淀DNA并洗涤。
4.最终稀释DNA并保存在适当的条件下。
四、实验注意事项:1.操作过程中需注意无菌操作,避免污染。
2.加入蛋白酶K的量应准确控制,不要过多或过少。
3.混合溶液时需轻轻摇匀,避免气泡的产生。
4.稀释保存DNA时,需使用无核酸酶的载体溶液,如TE缓冲液。
五、质控及结果分析:1.可以通过琼脂糖凝胶电泳或比色法检测提取的DNA质量。
2.检测DNA浓度和纯度,确保提取的DNA适用于后续实验。
3.可以保存提取好的DNA样品,以备后续实验使用。
六、应用领域:1.该试剂盒适用于从全血样品中提取DNA,可用于基因分析、疾病诊断、遗传研究等领域。
2.可以用于个体基因检测、种群遗传学研究、药物反应性研究等。
总结:全血基因组DNA提取试剂盒是用于从全血样品中提取DNA的重要工具,操作简便、提取效率高。
在实验中需注意操作规范,保证提取的DNA质量和纯度。
该试剂盒广泛应用于科研领域,为基因研究和临床诊断提供了有力支持。
希望上述使用说明能够帮助用户正确、高效地使用全血基因组DNA提取试剂盒。

实验二:全血基因组DNA的提取一实验目的:1.学习并掌握动物全血提取DNA的方法2.从全血中提取到一定量的纯净的DNA样品二实验原理DNA存在于细胞核中,用细胞裂解液除取红细胞,核裂解液破坏白细胞,氯仿使蛋白质变性,用无水乙醇洗涤DNA,从而得到纯净的DNA分子。
三、实验仪器、材料、试剂(一)仪器1.高速离心机 2.烘箱 3.冰箱4.水浴锅5.微量移液器6.高压灭菌锅(二)材料1.鸡血、2.细胞裂解液3.核裂解液、4.饱和NaCl、5.氯仿、6.无水乙醇、7.ddHO、8.滤纸、9.微量取液器、10.1.5mL/2mL 离心管、11.一次性2手套、12.离心管架、13.记号笔等(三)试剂配制细胞裂解液:10mm/l Tris-Hcl(1mol/L) ,11%w/l蔗糖,5 mmol/L Mgcl2,1%v/vEDTA, 10mm/L Triton 核裂解液:10mm/l Tris-Hcl, 1%w/v SDS, 10mm/L Na2柠檬酸三钠四、实验步骤1.吸取500ul血液至2ml离心管,加入1000ul的细胞裂解液,上下颠倒2-3min。
2.在4°C,6000rpm转速离心3min,弃上清液。
3.重复1-2步(1-3次),直至洗净红细胞,颜色变白为止。
4.加入300ul核裂解液,上下颠倒2min,室温静置2min。
5.加入100ul饱和NaCl和600ul氯仿,轻轻上下颠倒2min, 4°C,6000rpm 转速离心5min。
6.小心吸取上清液(不能吸入下层液体),移至新的1.5ml的离心管。
7.加入600ul冷藏无水乙醇,轻轻摇动,观察有无絮状物质。
8. 4°C,13000rpm转速离心3min,小心倒掉上清液,用滤纸吸取管壁周围的液体,室温下是离心管完全干燥。
(1h左右)9.沿管壁慢慢加入50ul ddHO,然后轻轻吹打均匀。
210.-20°C的冰箱保存。
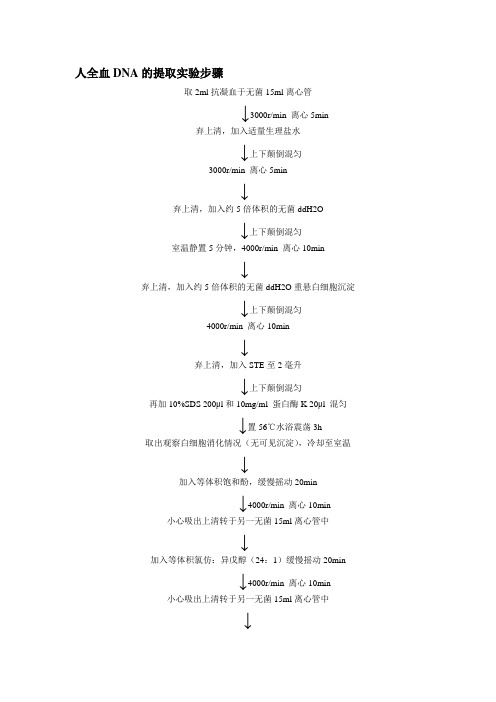
人全血DNA的提取实验步骤
取2ml抗凝血于无菌15ml离心管
↓3000r/min 离心5min
弃上清,加入适量生理盐水
↓上下颠倒混匀
3000r/min 离心5min
↓
弃上清,加入约5倍体积的无菌ddH2O
↓上下颠倒混匀
室温静置5分钟,4000r/min 离心10min
↓
弃上清,加入约5倍体积的无菌ddH2O重悬白细胞沉淀
↓上下颠倒混匀
4000r/min 离心10min
↓
弃上清,加入STE至2毫升
↓上下颠倒混匀
再加10%SDS 200μl和10mg/ml 蛋白酶K 20μl 混匀
↓置56℃水浴震荡3h
取出观察白细胞消化情况(无可见沉淀),冷却至室温
↓
加入等体积饱和酚,缓慢摇动20min
↓4000r/min 离心10min
小心吸出上清转于另一无菌15ml离心管中
↓
加入等体积氯仿:异戊醇(24:1)缓慢摇动20min
↓4000r/min 离心10min
小心吸出上清转于另一无菌15ml离心管中
↓
向上清中加入1/10体积的3M NaAC(pH5.2),混匀
↓
再加入2倍体积的无水乙醇,缓慢摇动即可见DNA丝状体
↓
用无菌吸管吸出DNA丝状体移至装有1ml70%乙醇的Epp管内
↓
12000r/min 离心3~5min,弃上清。
沉淀用1ml 70%乙醇洗涤1~2次
↓
12000 r/min 离心3~5min,弃上清。
↓
室温风干或DNA风干机抽干
↓
用100μl TE溶解DNA 沉淀。

从全血和体液中提取基因组DNA 的操作步骤提取DNA 需要的仪器和试剂:⑴ 1.5ml 离心管⑵ 移液管: 1000ul, 200ul, 40ul 各一支和移液管尖头: 100-1000ul, 1-200ul 各一盒⑶ 微型滤柱(备用)⑷ 小型旋转混合器一台⑸ 小型离心机: 可放入1.5ml 离心管和2ml 收集管.⑹ 恒温水浴⑺ 电冰箱: -20 C, 4 C⑻ 无水乙醇(自备)⑼ 70% 乙醇(自备)⑽ 利普生DNA 提取试剂盒。
内含: ⑴ 裂解液1 ⑵ 裂解液2 ⑶消化液 ⑷纯化液⑸弥散液 ⑹蛋白酶K ⑺ 带钩细玻棒一盒 ⑻ 微型滤柱若干。
提取DNA 前注意:⑴ 使血样品内容物达到室温(15 – 25 C )。
⑵ 预热水浴到58 C , 为步骤3作准备。
⑶ 置弥散液于58 C 内,为步骤4或步骤7作准备。
⑷ 所有的离心步骤均在室温下进行。
⑸ lml 全血可提得15-60ug DNA 。
一.从1ml 全血或体液中提取DNA 的步骤:⑴ 裂解1: 取1ml 全血,血桨,血清,淋巴细胞放入到1.5ml 的离心管中,加入400ul 裂解液1。
上下翻转,使沉淀物分散,旋转脉动15秒后放入离心机中离心,离心速率为8000rpm ,1min.。
倒掉上层液,可见离心管底部有血色沉淀。
重复此裂解步骤一次,这次是加入1ml 裂解液1。
最后用移液管吸净所有上层液弃去, 以使离心管底部的血色沉淀不再残留有裂解液1。
⑵ 裂解2: 在上面离心管中加入1ml 裂解液2。
上下翻转,务必使沉淀物分散, 旋转脉动15秒后放入离心机中离心,8000rpm ,1 min.。
倒掉上清液,可见离心管底部有微量淡红色沉淀。
重复此裂解步骤一次,这次仍然是加入1ml 裂解液2,最后用移液管吸净所有上清液弃去,以使离心管底部的灰白色沉淀不再残留有裂解液2。
⑶ 消化: 吸取蛋白酶K 10ul ( = 0.2mg )加入到上面的离心管中,用移液管尖头反复吹打, 使蛋白酶K 与沉淀物均匀接触后, 加入320ul 消化液,上下翻转离心管, 务必使沉淀物分散于消化液中。

全血基因组DNA提取试剂盒使用说明DNA提取是生物学、遗传学和分子生物学等领域的一项重要实验操作。
全血基因组DNA提取试剂盒是用于从全血样本中提取DNA的试剂盒,本文将详细介绍其使用说明。
一、试剂准备:1.预先将试剂盒从-20℃的冷冻器中转移到4℃的冰箱中解冻,取出所需试剂。
2.将试剂A和试剂B随机摇匀,避免沉淀的产生。
二、样本处理:1.取出需要提取DNA的全血样本,将其加入离心管中。
2.加入适量的蒸馏水和样本量相等体积的10%梳酸混匀,使血细胞溶解。
三、样本裂解:1.准备离心管和4℃的离心机。
2.加入适量的样本处理试剂(试剂A和试剂B),混匀离心管。
4.将裂解后的样本置于冰上放置10分钟。
四、DNA纯化:1.准备离心管和4℃的离心机。
2.将样本离心管中的上清转移至新的离心管中,并加入适量的试剂C,混匀并置于冰上放置5分钟。
4.弃去上清,避免悬浮细胞的干扰。
五、脱脂:1.准备脱脂离心管和4℃的离心机。
2.加入适量的试剂D,混匀离心管,置于冰上放置5分钟。
4.弃去上清,避免沉淀的干扰。
六、洗涤:1.准备洗涤离心管和4℃的离心机。
2.加入适量的试剂E和试剂F,混匀离心管,置于冰上放置5分钟。
4.弃去上清,避免沉淀的干扰。
七、DNA溶解:1.准备离心管和4℃的离心机。
2.加入适量的试剂G,混匀并置于冰上放置5分钟。
八、DNA浓缩:1.准备离心管和4℃的离心机。
2.加入适量的试剂H,混匀离心管,置于冰上放置5分钟。
4.弃去上清,避免纯化后的DNA丢失。
九、DNA溶解:1.加入适量的蒸馏水,混匀使DNA溶解。
十、质检:1.准备质检相关设备和试剂。
2.使用紫外分光光度计检测DNA纯度和浓度。
3.对提取的DNA进行PCR扩增、酶切鉴定等质检步骤。
以上就是全血基因组DNA提取试剂盒的使用说明,希望对您在实验中提取DNA有所帮助。
在操作中,请严格按照试剂盒说明书和实验室操作规范进行操作,确保实验的准确性和可重复性。

从全血中抽提基因组DNA的方法1、取全血700µL离心,5000rpm,5min,弃去上清液。
2、沉淀物用1mL的红细胞裂解液洗涤3次,5000rpm,5min,弃去上清液,倒干。
3、加入450µL细胞裂解液和6µL蛋白酶K(20mg/mL),55℃~66℃水浴4小时。
4、用等体积的酚、氯仿、异戊醇(25︰24︰1)抽提2次,12000rpm,5min。
5、用2倍体积冰预冷的无水乙醇沉淀(无水乙醇),有絮状沉淀后置于―20℃,沉淀30min。
6、沉淀结束后,12000rpm,5min,弃上清液。
7、用800µlL70%的乙醇洗涤沉淀,12000rpm,3min。
8、弃上清液,干燥。
9、加入50µL 1×TE缓冲液溶解,―20℃保存备用。
附:DNA提取相关试剂配制1、红细胞裂解液(PH 7.4)配制量:1L配制方法:(1)、称量NH4CL 0.802g、NaHCO3 0.84g、Na2EDTA·2H2O37.22g,置于1L烧杯中。
(2)、向烧杯中加入约800ml的去离子水,充分搅拌溶解。
(3)、加去离子水将溶液定容至1L后,高压灭菌。
(4)、室温保存。
2、细胞裂解液(PH 8.0)配制量:500Ml配制方法:(1)、称量NaCL 2.92g、SDS 5g、Tris 0.61g,置于1L烧杯中。
(2)、向烧杯中加入约300ml的去离子水,搅拌溶解,在溶解过程中用1mL移液器加入10mL的TriTon-100。
(3)、溶解后加入20mg/mL的蛋白酶K 3µL.(4)、加去离子水将溶液定容至500mL后,高压灭菌。
(5)、室温保存。
全血基因组DNA的提取实验2 全血基因组DNA的提取原理:由于血液各组成成分颗粒大小及比重的不同,利用明胶的吸附作用,使红细胞沉降在管底,从而与白细胞分离。
通过SDS的破膜(细胞膜和核膜)作用,使白细胞释放出DNA,然后利用酚和氯仿抽提纯化,分离除去蛋白质,最后用乙醇沉淀析出DNA。
材料:方法:1.提取WBC(1)取1ml全血(EDTA抗凝),加入等体积(1ml )3%的明胶,盖紧后颠倒混匀,37℃水浴静置5-10分钟。
明胶是高分子的聚合物,可与红细胞粘合并使其凝聚成串钱状而加速红细胞快速沉降,使之与白细胞分离。
(2)取上清液至另一干净离心管,4000转离心5分钟。
(3)弃上清液,留沉淀。
2.破碎WBC在留有沉淀的离心管中加TES 2ml,溶解沉淀(滴管或加样器抽吸,一定要充分吹散沉淀以利于破膜)后加10% SDS 10滴,抽吸混匀,破膜。
以后的操作要小心轻柔,以免机械剪切力破坏核酸的完整性(核酸已释出)3.抽提DNA(1)加入2 ml pH 7.8的饱和酚(在通风橱中操作,吸取下层。
苯酚有毒,注意安全),颠倒混匀(一定要充分混匀)。
4000转离心5-10分钟。
(2)取上层水相至另一离心管,加入等体积的氯仿:异戊醇(24:1)(在通风橱中操作,有毒,注意安全),颠倒混匀,4000转离心5分钟。
4.沉淀DNA将上层水相移至一小玻璃试管中,小心沿试管壁加入2.5倍体积的无水乙醇,用滴管吸上层乙醇沿管壁缓慢冲洗下层溶液(小心,不要把DNA吹散),看到DNA絮状沉淀完全析出为止。
5.溶解DNA沉淀用吸管吸出絮状沉淀至另一1.5ml小离心管,稍离心后加入70%乙醇洗涤1次(去除共沉淀的盐),离心后将乙醇去除干净,挥干5-10分钟。
将上述挥干的DNA加入200-300μl TE(或者双蒸水),轻轻震荡,使之溶解,冰箱保存备用。
结果:获得基因组DNA 讨论:小组10人,个人分别为一组,有的同学的DNA成形状不明显,到实验步骤的最后没有肉眼看见DNA絮状沉淀析出,难以判断基因组DNA是否提取成功。
实验七全血DNA的提取和凝胶电泳检测(氯化钠饱和溶液提取法)实验目的掌握真核细胞基因组染色体DNA的一种提取方法学习使用紫外分光光度法鉴定DNA的纯度,估计相对含量。
实验原理利用高渗溶液裂解红细胞,利用高渗溶液、蛋白酶K溶解白细胞细胞壁,释放核内基因组DNA。
利用DNA不溶于三氯甲烷和乙醇,但其他杂质多溶于此2种溶液,纯化DNA实验仪器及用品•高速冷冻离心机;制冰机;紫外可见分光计;冰箱;水浴锅;离心管;烧杯;•电子天平等实验试剂红细胞裂解液、STE、10%SDS、蛋白酶K、饱和Nacl溶液、三氯甲烷、异丙醇、70%乙醇、双蒸水实验步骤1.裂红细胞:1ml红细胞裂解液+400 l全血加入2mlEP管,反复颠倒混匀,之后静置2min,然后12000rpm离心5min。
弃上清。
【注意不要把下面的白细胞也倒掉】2.裂解过夜:①STE 500μl + ②10% SDS(pH=8.14) 150μl + ③蛋白酶K 10μl 【SDS用之前水浴】①②③加至上面步骤1的管子中,裂解过夜,65度水浴(加裂解液后颠倒混匀)(约每隔一小时操作一次,以使白细胞沉淀充分与裂解混合液接触,裂解更加充分,沉淀要弹起来)3.向上步EP管中加入饱和Nacl溶液300ul,颠倒混匀轻摇3分钟。
【NaCl饱和溶液配制时下面要有一定的未溶解的固体】4.再加400ul三氯甲烷轻轻混匀轻摇5分钟,之后离心(12000rpm,20min,4度或4度预冷)5.取上清(用枪吸至1.5ml新EP管),加异丙醇沉淀DNA(异丙醇最好-20度或4度预冷,用前取出),离心(12000rpm,20min,4度或4度预冷)。
上清:异丙醇=1:0.6. 【取上清时要注意不要把下面的也吸上来,可稍微留下一些】6.70%乙醇洗两次(1ml),颠倒混匀。
12000rpm,离心5min7.烘干8. 加双蒸水或TE溶解。
9.紫外分光光度仪检测实验结果1。
全血DNA提取步骤提取全血DNA是常见的分子生物学实验步骤之一,可以用于基因测序、PCR等一系列实验。
下面将详细介绍全血DNA提取的步骤,供参考:1.样本准备首先,需要准备采集血液的材料,如采血管、细胞裂解缓冲液、蛋白溶解缓冲液、蛋白酶K等。
此外,还需要一些实验所需的试剂和器材,如离心管、离心机、恒温器等。
确保仪器和试剂的清洁和消毒。
2.血液采集使用专业的血液采集器具,从被试者的静脉中采集血液样本。
建议使用EDTA抗凝管收集血液,以防止血液凝固。
3.预处理将采集的全血样本通过轻轻倾斜管子,使其混合均匀。
根据实验需要,可选择不同的预处理方式。
如果需要分离血浆或血细胞,可将全血离心,离心速度通常为1000-2000g,离心时间为15-20分钟。
4.细胞裂解将离心后的血细胞沉淀取出,加入适量的细胞裂解缓冲液。
裂解缓冲液的成分通常包括盐溶液、蛋白酶K、非离子型洗涤剂等。
裂解缓冲液的选择可根据实验的目的和所需的DNA纯度来确定。
将裂解缓冲液和血细胞沉淀充分混合,可使用移液器轻轻上下翻动。
5.DNA沉淀将混合好的血细胞裂解液加入离心管中。
在室温下离心10-15分钟,以除去细胞残渣和细胞膜的碎片。
离心完成后,将上清液转移到新的离心管中。
6.蛋白溶解将血细胞裂解液中的蛋白质通过加入蛋白溶解缓冲液沉淀下来。
蛋白溶解缓冲液通常包含盐溶液和蛋白酶K。
将蛋白溶解缓冲液加入上一步的上清液中,轻轻混合,并在室温下静置一段时间。
然后再次进行离心,使蛋白质沉淀到离心管的底部。
7.除去上清液将离心管取出,将上清液倒出,只保留蛋白质沉淀在离心管底部的沉淀。
8.水洗将离心管中的蛋白质沉淀用去离子水洗涤一次,以去除余留的盐溶液和杂质。
将去离子水加入离心管中,轻轻混合后离心,然后将上清液倒出。
9.DNA溶解将沉淀的蛋白质用适量的DNA溶解缓冲液重新溶解。
DNA溶解缓冲液通常包含盐溶液和螯合剂,以便稳定DNA的结构。
将DNA溶解缓冲液加入离心管中,轻轻混合使蛋白质沉淀溶解。
全血dna提取实验报告
全血DNA提取是DNA分子生物学中用来分析遗传多态性与染色体研究或突变检测等方
面研究的重要手段之一。
本研究采用厌氧通过脱水-水解提取法进行全血中DNA提取实验,以获取质量更高的DNA分子,并分析每个样本的提取效果。
本实验利用贴片加压技术收集被试全血样本,分别收集200 µl,800 µl和1200 µl。
200µl的血液按比例加入800µl PBS做血浆样本做先行DNA提取实验。
在实验中,利用固相萃取(SPE)技术对全血样品进行基因组DNA提取。
提取进程主
要分为三部分:提取液,洗脱液和上液等步骤,经历细胞消化、碱解、洗脱和上液后可以
完成基因组DNA的提取。
实验结果显示,200µl血液在添加PBS之后,对提取的DNA进行了质量检查,通过两
次PCR检测其纯度,结果表明提取的DNA纯度达到2.2,合格率在99.8%以上,按靶点克
隆法或者qwtPCR法测序可以有效验证实验结果。
800µl和1200µl血液提取的DNA,通过PCR测序,得到了较高质量的DNA,结果表明
提取的DNA纯度经进行质检测无污染物,合格率超过99.9%。
经上述实验,我们可以验证厌氧脱水-水解法可以从血液中高效提取DNA,提取的DNA
纯度高,DNA的片段可以用PCR技术进行扩增,继而用于基因组学分析等研究。