2021届全国新高考化学备考复习 化学键
- 格式:pptx
- 大小:1.87 MB
- 文档页数:42

考点25 化学键1.化学键(1)定义:相邻原子间强烈的相互作用。
(2)分类2.离子键(1)概念:阴、阳离子之间的相互作用。
(2)成键粒子:离子。
(3)成键实质:静电作用。
(4)形成条件:通常是活泼金属元素与活泼非金属元素的原子相结合。
(5)表示方法:①用电子式表示物质②用电子式表示离子化合物的形成过程3.共价键(1)概念:原子间通过共用电子对形成的相互作用。
(2)成键粒子:原子。
(3)成键实质:共用电子对。
(4)形成条件:通常是非金属元素的原子相结合。
(5)分类:形成原子种类电子对偏向情况非极性共价键同种元素的原子不偏向成键原子的任何一方极性共价键不同种元素的原子偏向吸引电子能力强的一方(6)表示方法:①用电子式表示物质②用结构式表示物质③用电子式表示共价化合物的形成过程4.离子键和共价键的比较共价键键型离子键非极性键极性键共用电子对偏向吸引电子特点阴、阳离子间的相互作用共用电子对不发生偏移能力强的原子一方成键阴、阳离子原子粒子成键活泼金属元素和活泼非金属元素同种元素的原子不同种元素的原子条件共价化合物、某些离子化存在离子化合物非金属单质、某些化合物合物5.化学键与物质的类别除稀有气体内部无化学键外,其他物质内部都存在化学键。
化学键与物质的类别之间的关系可概括为:(1)只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4等。
(2)只含有非极性共价键的物质是同种非金属元素形成的单质,如Cl2、P4、金刚石等。
(3)既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等。
(4)只含离子键的物质主要是由活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CaCl2、NaCl等。
(5)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
(6)仅由非金属元素形成的离子化合物,如NH4Cl、NH4NO3等。


2021新高考化学知识点近年来,中国教育改革已经进入全面深化的阶段,高考制度也在不断进行革新和调整。
作为高考科目之一的化学,其知识点也发生了一些变化。
本文将介绍一些2021新高考化学知识点,帮助广大考生更好地备考。
一、化学元素周期表化学元素周期表是学习化学不可或缺的基础。
尽管元素周期表在高考考纲中没有明确列出,但是它在化学学科中具有重要的地位,因此考生需要熟悉元素周期表的基本结构和元素的周期性规律。
同时,了解元素的性质、周期表的分类等内容也是必要的。
二、化学键和分子构型化学键和分子构型是化学反应和化学键的形成过程中的重要概念。
在考试中,常常会涉及到分子中原子之间的键合情况、键的类型等问题。
因此,考生需要掌握化学键的分类,如离子键、共价键、金属键等,以及不同类型键的特点和形成条件。
三、溶液的浓度计算溶液浓度的计算在高考试题中经常出现。
考生需要了解浓度的概念和计算方法,包括摩尔浓度、质量分数、体积分数等。
在实际应用中,还需要掌握浓度计算的应用,如通过浓度计算物质的溶解度、反应物质的配比等。
四、酸碱反应酸碱反应是化学课程中的重要内容。
考生需要了解酸碱的定义、性质以及酸碱中常用的概念,如酸的酸度、碱的碱度等。
在实际应用中,还需要了解酸碱反应的判别方法和测定方法,如酸碱指示剂的使用、pH值的计算等。
五、氧化还原反应氧化还原反应是化学中的重要反应类型之一。
考生需要掌握氧化还原反应的特点、氧化还原数的计算方法,以及氧化还原反应中常见的概念,如氧化剂、还原剂等。
在应用中,需要了解氧化还原反应的实际应用,如电池、电解等。
六、有机化学基础有机化学是化学中的重要分支,也是高考考纲中的一部分。
考生需要熟悉有机化学中的基本概念和基础知识,如碳原子的化合价、官能团的命名等。
此外,还需要了解有机反应的特点和常见反应类型,如取代反应、加成反应等。
七、化学实验原理和操作高考中,化学实验已成为必考的部分。
考生需要了解化学实验的基本原理和实验操作技能。


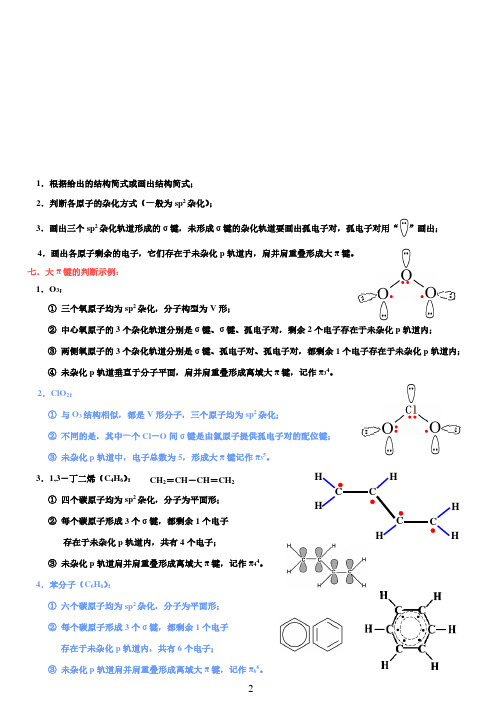
2021届高三化学三轮复习全国II卷—化学键1.下列化学用语正确的是( )A.Cl 的离子结构示意图:B.甲烷的球棍模型:C.H2O2的电子式:D.碳酸氢钠的电离方程式:+-NaHCO=Na+HCO332.下列对化学键的认识正确的是( )A.任何物质均存在化学键B.化学键可以使原子相结合,也可以使离子相结合C.断裂化学键要放出能量,形成化学键要吸收能量D.使原子间或离子间相互吸引的作用力为化学键3.下列物质在变化过程中,只需克服分子间作用力的是( )A.食盐溶解B.冰融化C.氯化铵受热分解D.氧化铝电解4.下图形象地表示了氯化钠的形成过程。
下列相关叙述中不正确的是( )A.钠原子易失去一个电子,氯原子易得到一个电子B.钠离子与钠原子有相似的化学性质C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强D.氯化钠是离子化合物5.下列性质中,可以证明某化合物内一定存在离子键的是( )A.水溶液能导电B.由金属和非金属元素的原子组成C.熔融状态能导电D.可以溶于水6.下列物质性质的递变性与分子间作用力的强弱有关的是( )A.F2、Cl2、Br2、I2的熔点越来越高B.HF、HCl、HBr、HI的热稳定性依次减小C.Li、Na、K、Rb单质的熔点越来越低D.NaF、NaCl、NaBr、NaI的熔点依次降低7.下列说法正确的是( )A.因为水分子内存在氢键,所以水分子非常稳定B.氢键属于化学键C.水分子间存在氢键使水分子间作用力增强,导致水的沸点较高D.水分子之间无分子间作用力,只有氢键8.下列叙述错误的是( )A.带相反电荷离子之间的相互吸引称为离子键B.金属元素与非金属元素化合时,不一定形成离子键C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键D.非金属元素原子间也可能形成离子键9.下列每组物质中含有的化学键类型相同的是( )A.NaCl、HCl、H2O、NaOHB.Cl2、Na2S、HCl、SO2C.HBr、CO2、H2O、CS2D.Na2O2、H2O2、H2O、O310.过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。
课题18化学键与物质构成分子结构与性质学习任务1化学键与物质构成一、化学键1.化学键的定义及分类2.化学反应的本质:反应物中旧化学键的断裂与生成物中新化学键的形成。
二、离子键与共价键1.离子键与共价键的比较离子键共价键非极性键极性键概念带相反电荷离子之间的相互作用原子间通过共用电子对(电子云重叠)所形成的相互作用成键粒子阴、阳离子原子成键实质阴、阳离子的静电作用共用电子对不偏向任何一方共用电子对偏向一方原子形成条件活泼金属元素与活泼非金属元素经电子得失,形成离子键同种元素原子之间成键不同种元素原子之间成键形成的物质离子化合物非金属单质;某些共价化合物或离子化合物共价化合物或某些离子化合物(1)极性键:共用电子对发生偏移的共价键。
其中它偏向非金属性较强的元素。
(2)非极性键:共用电子对不发生偏移的共价键。
它存在于同种元素的原子之间。
非金属单质、过氧化物、大多数有机物中均含有此类共价键。
三、化学键与物质类别1.化学键的存在2.化学键与物质类别的关系(1)只含有共价键的物质①同种非金属元素原子构成的单质,如I2、N2、P4、金刚石、晶体硅等。
②不同非金属元素原子构成的共价化合物,如HCl、NH3、SiO2、CS2等。
(2)只含有离子键的物质活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CsCl、K2O、NaH等;但AlCl3内部含共价键。
(3)既含有离子键又含有共价键的物质如Na2O2、NH4Cl、NaOH、Na2SO4等。
(4)无化学键的物质稀有气体分子(单原子分子),如氩气、氦气等。
四、物质的溶解或熔化与化学键变化的关系1.离子化合物的溶解或熔化过程离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏。
2.共价化合物的溶解过程(1)有些共价化合物溶于水后,能与水反应,其分子内的共价键被破坏,如CO2和SO2等。
(2)有些共价化合物溶于水后,发生电离,其分子内的共价键被破坏,如HCl、H2SO4等。
考纲定位要点网络1.了解元素、核素和同位素的含义。
2.了解原子的构成,了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布规律,掌握原子结构示意图、电子式、结构式的表示方法。
4.了解化学键的定义,了解离子键、共价键的形成。
(3)核外电子排布与元素性质的关系①金属元素原子的最外层电子数一般小于4,较易失去电子,形成阳离子,表现出金属性,在化合物中显正化合价。
②非金属元素原子的最外层电子数一般大于或等于4,较易得到电子,活泼非金属原子易形成阴离子,在化合物中主要显负化合价。
③稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
[基础判断](1)任何原子的原子核均有质子和中子,任何离子均有电子。
( )(2)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
( )(3)核聚变如21H+31H―→42He+10n,因为有新粒子生成,所以该变化是化学变化。
( )(4)H2、D2、HD均为氢元素的不同单质,三者属于同素异形体。
( )(5)硫离子的结构示意图:。
( )(6)核外电子排布相同的粒子化学性质也相同。
( )[答案](1)×(2)√(3)×(4)×(5)×(6)×[知识应用]1.H、D、T形成的氢气分子有____________;H、D、T与16O、17O可形成的水分子有________种;其中相对分子质量相同的有______________________洞百出______________;这些水分子的物理性质________;化学性质________。
[答案]H2、D2、T2、HD、HT、DT 12 HT16O与D162O、HT17O与D172 O、HD16O与H172O、HT17O与D162O 不同几乎相同2.现有下列9种粒子:1H、21H、13 6C、14 6C、14 7N、5626Fe2+、8O2、16 8O3。