《高等有机化学》复习共82页
- 格式:ppt
- 大小:6.74 MB
- 文档页数:82






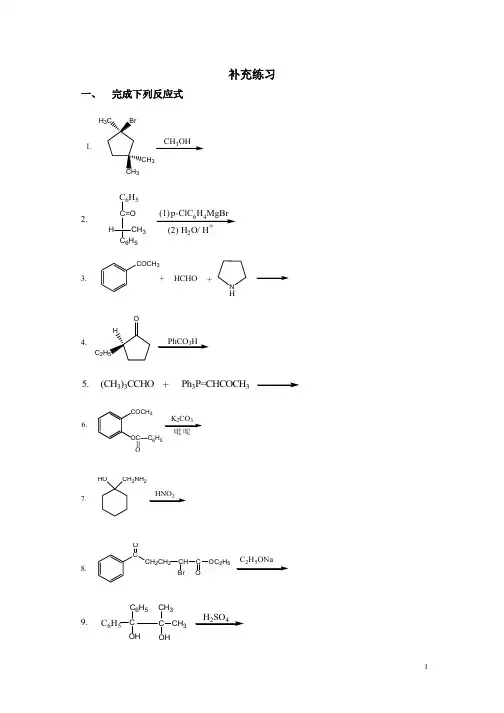
CH 3CH 3BrH 3C1.CH 3OH2.C 6H 5C=O C 6H 5H CH 3p-ClC 6H 4MgBr (1)(2) H 2O/ H +3.COCH 3+HCHO +NH4.H C 2H 5OPhCO 3H(CH 3)3CCHO +5.Ph 3P=CHCOCH 3COCH 3OCC 6H 5K 2CO 36.吡啶=O7.HOCH 2NH 2HNO 28.CCH 2CH 2O CHC OC 2H 5OBrC 2H 5ONa9.C 6H 5CC CH 3OHCH 3C 6H 5OHH 2SO 410.CH 3O+CH 2=CH CH 3C OC 2H 5ONa1.CCHO OC 2H 5ONa ,C 2H 5OHCHOHCOOC 2H 52.O ClC 2H 5ONaCOOC 2H 53.CH 2CH 2OTsH 2OHO4.NH 2OBr 2 ,NaOCH 3CH 3OHH NOCH 3OC 2H 5ONa5.OOOCOCH 31. (S)-3-溴-3-甲基己烷在H 2O-丙酮中得外消旋的3-甲基-3-己醇。
2 . 试解释化合物A 的乙酸解反应的结果为构型保持产物B 。
O-C-CH 3OTsOCH 3COONa CH 3COOHO-C-CH 3O-C-CH 3OOA B3. 试说明为什么内消旋(赤式)-1,2-二溴-1,2-二苯乙烷和碱作用主要生成 顺式-1-溴-1,2-二苯乙烯?而(苏式)-1,2-二溴-1,2-二苯乙烷却主要得到反式产物?4. 请预测下列反应的主要产物为(A )还是(B )?并分析其原因。
CH 3CO 3HOO+(A)(B)5. 当具有立体化学结构的3-溴-2-丁醇(A )与浓HBr 反应时生成内消旋的2,3-二溴丁烷,而3-溴-2-丁醇(B )的类似反应则生成外消旋2,3-二溴丁烷,请从反应历程的角度说明这一反应的立体化学。
Br H H 3CCH 3H OHBrH H 3CHCH 3OH(A)(B)4CH 3CH 3BrH 3CCH 3OH1.CH 3CH 3CH 3H 3CO+CH 3CH 3H 3COCH 3C=O C 6H 5C 6H 5H CH 3HOC 6H 5HCH 3C 6H 5Cl-pC 6H 52.p-ClC 6H 4MgBr (1)(2) H 2O/ H +COCH 3HCHO NHCOCH 2CH 2N3.++H C 2H 5OPhCO 3HHC 2H 5OO4.C=C(H 3C)3CHH COCH 35.(CH 3)3CCHO + Ph 3=CHCOCH 3COCH 3OCK 2CO 3C 6H 5OCOCH 2COC 6H 5OH6.吡啶=HOCH 2NH 2HNO 27.OCCH 2CH 2O CHBrC OOC 2H 5C 2H 5ONaOC 6H 5C 2H 5OCOOC 2H 58.C 6H 5CC CH 3OHCH 3C 6H 5OHH 2SO 49.C 6H 5CC CH 3C 6H 5CH 3O5CH 3OCH 2=CH C OCH 3C 2H 5ONaCH 3O 10.+CCHOOCCHOOOC 2H 5OH C 2H 5OCHOHCOOC 2H 5C O OC 2H 5HCHOHCOOC 2H 5coCHO OC 2H 51.C 2H 5ONa ,C 2H 5OH____C 2H 5O -解答:C 2H 5ONaCOOC 2H 52.解答:COOC 2H 5O Cl O ClHC 2H 5O __C 2H 5OH O Cl _O_Cl_C 2H 5O_OC 2H 5O_COOC 2H 5_C 2H 5OH_C 2H 5O6HOCH 2CH 2OTsH 2O3.解答:OTs_OTs_+H 2O.._H +HOHONH 2OCH 3OHH NOCH 3O4.Br 2 ,NaOCH 3解答:NOH H +Br _Br.._HBrNOH BrOC 2H 5__CH 3OHN O.._Br_..Br_重排N=C=OCH 3OH..N=COCH 3O H +_H+转移N=COCH 3O H异构化H NOCH 3O7C 2H 5ONaOO OCOCH 35.OOC 2H 5O_OOC 2H 5O_CH 2COOC 2H 5O_C 2H 5OH_C 2H 5O_C 2H 5OHC 2H 5O__CH 3COOC 2H 5OCH 3C OC 2H 5O__OOOC 2H 5C __OCH 3_C 2H 5O_OCOCH 3解答:1. (S)-3-溴-3-甲基己烷在H 2O-丙酮中得外消旋的3-甲基-3-己醇。


高等有机化学复习资料第二章:电子效应、空间效应2.1电子效应(I效应)(+ - 交替)(键的极性或极化。
)2.11诱导效应(逐级递减传递)—N+(CH3)3>—NO2> —CN > —F > —Cl > —Br > —I > —OH > —OCH3> —C6H5> —CH=CH2 > —H > —CH3 > — CH2CH3 > —C(CH3)3(吸电子能力大小)中间体稳定性:连的烷基越多的碳正离子和碳自由基的稳定性越大,而碳负离子的稳定性正相反羧酸酸性:带吸电基时将增加羧酸的酸性,带供电基时减小其酸性。
注:+N(CH3)3具有强烈的-I效应,很强的间位定位基,亲电取代比苯难于进行。
反应速率:羰基的亲核加成反应,羰基碳原子的电子云密度越低,就越容易和亲核试剂发生加成反应Cl3C—CHO > Cl2CHCHO > ClCH2CHO > CH3CHO2.12共轭效应(电子的离域)共轭键传递而不会明显削弱π-π共轭> p-π共轭>σ- π超共轭>σ-p 超共轭Y为吸电子基团时-吸电子共轭效应 (-C),X为供电子基团时-供电子共轭效应 (+C).2.13空间效应构象(位阻大时:a > e 键处于e键稳定)SN2反应,空间位阻愈大,反应速率慢。
CH3X>1°RX>2°RX>3°RXSN1反应:3°RX >2°RX >1°RX > CH3X消除反应:3º>2 º>1 ºRX(E1或E2)总结:重点酸性:吸电子,酸性增强;供电子酸性减弱苯环上: 吸电子共轭效应--邻>对>间给电子共轭效应--邻>间>对邻位(诱导、共轭、场、氢键效应、空间效应均要考虑。
)对位(诱导很小、共轭为主。
)间位(诱导为主、共轭很小。
西南⼤学⾼等有机化学复习资料当前位置:第⼀章电⼦效应和空间效应1、下列羰基化合物分别与亚硫酸氢钠溶液加成,哪⼀个反应速度快?哪⼀个最慢?为什么?(1)CH3COCH2CH3(2)HCHO(3)CH3CH2CHOHCHO反应速度最快,CH3COCH2CH3反应速度最慢。
羰基化合物的亲核加成反应,其速度主要由空间效应决定。
同时,与羰基相连的取代基的性质也将影响其加成速度。
烷基是供电⼦基,将减少碳原⼦上的正电荷,不利于亲核加成反应。
甲醛中与羰基相连的是两个氢原⼦,空间位阻最⼩,因此加成反应速度最快。
丁酮中供电的甲基和⼄基与羰基相连,空间位阻⼤,因此加成反应速度最慢。
2、⽐较下列各组化合物的酸性强弱,并予以解释。
(1)HOCH2CH2COOH和CH3CH(OH)COOH(2)对硝基苯甲酸和对羟基苯甲酸(3)a.ClCH2COOH b.CH3COOH c.FCH2COOH d.CH2ClCH2COOH e.CH3CHClCOOH(4)CH3COCH2COCH3和CH3COCH2CO2C2H5(1)-羟基丙酸的酸性⽐-羟基丙酸的强;羟基有-I效应,-I效应常随距离的增长⽽作⽤迅速减弱。
(2)对羟基苯甲酸的酸性⽐对硝基苯甲酸弱;NO2是强吸电⼦基,其诱导效应和共轭效应⽅向⼀致,OH有-I和+C效应,⼀般取代基诱导效应和共轭效应⽅向不⼀致时,往往以共轭效应为主,OH基总的来看是供电基。
(3)c>a>e>d>b。
(4)后者酸性较弱。
3、试解释亲核加成反应中,ArCH2COR的反应活性为何⽐ArCOR⾼。
Ar直接与>C=O相连时,羰基和芳环共轭使羰基碳的正电荷离域分散,使羰基碳正电性减少,活性降低。
在ArCH2COR中,Ar 与羰基⽆共轭效应,只有吸电⼦诱导作⽤,增加羰基碳正电性。
故加速亲核反应进⾏。
当前位置:第⼆章⽴体化学1、具有n个C=C双键的化合物,总共应存在多少个Z-E异构体,并举例说明。
《有机化学》课程期末复习资料《有机化学》课程PPT章节目录如下:重点内容用红色黑体字标出:第一章绪论第一节有机化学的发展第二节化学键第三节酸碱理论第四节有机化合物和有机化学反应的一般特点第五节有机化合物的分类第六节有机化合物的研究手段第二章烷烃第一节结构及表示式第二节同系列和同分异构现象第三节烷烃的命名第三节烷烃的构象第五节烷烃的物理性质第六节烷烃的化学反应第七节烷烃的制备第三章脂环烃第一节分类和命名第二节脂环烃的化学性质第三节拜尔张力学说第四节影响环状化合物稳定性的因素和环状化合物的构象第五节环己烷的构象第六节取代环己烷的构象第四章烯烃第一节烯烃的结构和异构第二节烯烃的命名第三节烯烃的物理性质第四节烯烃的化学性质第五节烯烃的制备第五章炔烃和二烯烃第一节炔烃的结构及命名第二节炔烃的物理性质第三节炔烃的反应第四节炔烃的制备第五节二烯烃的分类及命名第六节共轭双烯烃的稳定性第七节共振论第八节丁二烯的亲电加成第九节自由基聚合反应第十节 Diels-Alder反应第六章芳烃第一节苯的凯库勒式第二节苯的稳定性、氢化热和苯的结构第三节苯衍生物的命名第四节苯衍生物的物理性质第五节芳烃的还原反应第六节苯的亲电取代反应第七节定位效应与反应活性第八节烷基苯侧链的反应第九节烯基苯第十节联苯第十一节稠环芳烃第十二节芳香性和休克尔规则第七章立体化学第一节异构体的分类第二节偏振光和比旋光度第三节分子的手性和对称因素第四节含有一个手性碳原子的化合物第五节构型和构型标记第六节含两个手性碳原子的化合物第七节含有三个手性碳原子的化合物第八节环状化合物的立体异构第九节不含手性碳原子的旋光异构第十节旋光异构与生理活性第十一节制备手性化合物的方法第十二节旋光异构在研究反应历程上的应用第十三节立体专一性和立体选择性反应第八章卤代烃第一节卤代烃的分类和命名第二节卤代烃的物理性质第三节卤代烃的化学性质第四节亲核取代反应机理第五节消除反应的机理第六节卤代烃的制备第九章醇和酚第一节醇的分类和命名第二节醇的物理性质第三节醇的化学性质第四节醇的制法第五节酚的命名和物理性质第六节酚的化学性质第七节酚的制法第十章醚和环氧化合物第一节醚的命名第二节醚的物理性质第三节醚的制法第四节醚的化学性质第五节冠醚第六节环氧化合物第十一章醛和酮第一节醛、酮的结构与命名第二节醛、酮的物理性质第三节醛、酮的化学性质第四节醛、酮的制法第十二章核磁共振和质谱第一节核磁共振基本原理第二节屏蔽效应和化学位移第三节影响化学位移的因素第四节自旋偶合—裂分第五节氢核磁共振谱分析第六节核磁共振碳谱第七节质谱基本原理第八节分子离子和相对分子质量及分子式的确定第九节碎片离子和分子结构的推断第十二章红外与紫外光谱第一节分子运动与电磁辐射第二节分子的振动与红外光谱第三节键的性质与红外吸收第四节红外光谱仪和红外光谱第五节不同官能团在红外频区的特征吸收第六节典型红外光谱图第七节红外谱图详解实例第八节紫外光谱的一般概念第九节分子结构与紫外吸收的关系第十节芳香化合物的紫外吸收光谱第十一节紫外光谱的应用第十四章羧酸第一节羧酸的命名、物理性质和波谱性质第二节羧酸的酸性第三节羧酸的化学反应第四节羧酸的制备方法第五节羟基酸第十五章羧酸衍生物第一节羧酸衍生物的结构和命名第二节物理性质和波谱性质第三节羧酸衍生物的取代反应及相互转化第四节亲核取代反应机理和反应活性第五节与金属试剂的反应第六节还原反应第七节酯的热消去反应第十六章胺第一节分类、结构及命名第二节物理性质和波谱性质第三节胺的制备第四节胺的化学反应第五节重氮化反应和重氮盐第十七章杂环化合物第一节芳香杂环化合物的分类和命名第二节五元单杂环化合物第三节唑第四节吡啶第五节喹啉和异喹啉第六节嘧啶和嘌呤第七节杂环化合物的合成第八节生物碱其他内容,如“羧酸衍生物设计碳负离子的反应及在合成中的应用”、“协同反应”、“碳水化合物”、“氨基酸、蛋白质和核酸”、“油脂、萜、甾族化合物”以及“杂原子及金属有机化合物”等内容,可根据前面所学的内容通过自习的方式完成学习。