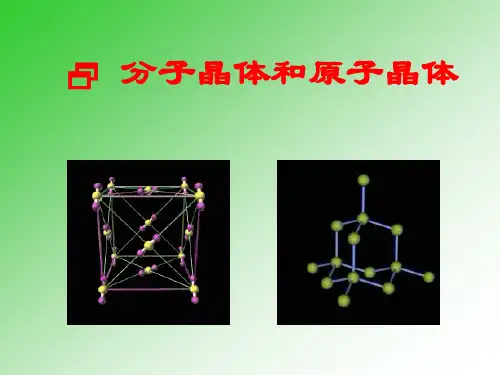
109º28´ 共价键
Si
o
104º30´
109º28´ 共价键
SiO2晶体
Si
O
①每个Si原
子与 4个O原
子以共价键
相结合
每个O原子与2 个Si原子以共
价键相结合
SiO2晶体
ห้องสมุดไป่ตู้
Si O
②晶体中Si原 子与O原子个 数比为1:。2
晶体中Si原子与Si-O键数目 之比为 1:。4
SiO2晶体 Si
思考1 原子晶体的化学式是否可以代表其分子式?
不能。因为原子晶体是一个三维的网状结构,无小
分子存在。 思考2 以金刚石为例,说明原子晶体的微观结构与分
子晶体有哪些不同?
(1)组成微粒不同,原子晶体中只存在原子,没有
分子。
(2)相互作用不同,原子晶体中存在的是共价键。
交流与研讨
1、怎样从原子结构角度理解金刚石、 硅和锗的熔点和硬度依次下降?
以下是金刚石和晶体硅的
熔、沸点的比较
熔点 沸点
金刚石 3550℃ 4827℃
晶体硅 1410℃ 2355℃
同为结构相同的原子晶体,为什么金刚 石比晶体硅的熔、沸点高?
5、原子晶体熔、沸点的影响因素
原子晶体熔、沸点的高低与共价键的强弱 (即键能的大小)有关。一般说,原子半 径越短,键长越短,共价键的键能越大, 熔、沸点越高。
2、构成粒子: 原子
(大多数为非金属) 3、粒子间作用力: 共价键
4、物理性质
熔、沸点高,硬度大,难压缩,一 般不导电,难溶于水.
问题:为什么原子晶体的熔沸点很高, 硬度很大?
其本质是因为原子晶体中原子通过很强 的共价键连接,由于共价键比较牢固,要拆 开它需要消耗很大的能量,所以原子晶体 一般具有较高的熔沸点和较大的硬度.