广东省2020年中考化学复习第二部分专题提升专题五实验探究四有关物质成分的探究试题
- 格式:doc
- 大小:47.00 KB
- 文档页数:5



中考化学专题复习专题一物质构成的奥秘第1课时:构成物质的微粒第2课时物质的宏观组成元素第3课时对物质的多样性进行分类第4课时元素、化合价、化学式专题二物质的化学变化第5 课时物质的变化和性质第6课时认识几种化学反应第7课时质量守恒定律专题三身边的化学物质第8课时自然界中的水和空气第9课时溶液与金属专题四化学与社会发展第11课时能源、资源利用与环境保护第12课时常见的合成材料与人体健康专题五科学探究第13课时常见化学仪器和化学实验基本操作第14课时常见气体的制备和简单实验方案设计第 15课时物质的检验、分离和提纯专题六化学计算第16课时关于化学式的计算第 17课时关于化学方程式的计算第 18课时关于溶液的计算专题七物质的推断专题一物质构成的奥秘第1课时构成物质的微粒【知识网络】一、分子和原子的比较说明:在原子中有两组等量关系:①核电荷数= = ;②相对原子质量= + 。
二、原子结构示意图1.在原子结构示意图中,圆圈代表,圆圈中的数字代表。
弧线代表,弧线上的数字代表。
决定元素种类的是;决定元素化学性质的是;决定原子质量的是。
答案:一、分子和原子的比较:①质子数核外电子数②质子中子二、原子结构示意图:1.原子核质子数电子层电子数 2.质子数最外层电子数原子核【考向聚焦】分子、原子、离子的比较;分子、原子的性质的应用及设计实验证明分子、原子的性质;原子结构;核外电子的排布。
【典题剖析】【典例1】(2008盐城)下列对分子、原子、离子的认识,正确的是()A.分子是保持物质性质的最小粒子B.原子是最小的粒子,不可再分C.原子得到或失去电子后形成离子D.CO2和CO性质的差异主要是由于分子间的间隔不同【剖析】性质分为物理性质和化学性质,分子只能保持物质的化学性质,而物质的物理性质中颜色、气味、密度等都是有分子的集合体表现出来;原子不能再分的前提条件是在化学变化中,CO2和CO性质的差异主要是由于分子的构成不同。
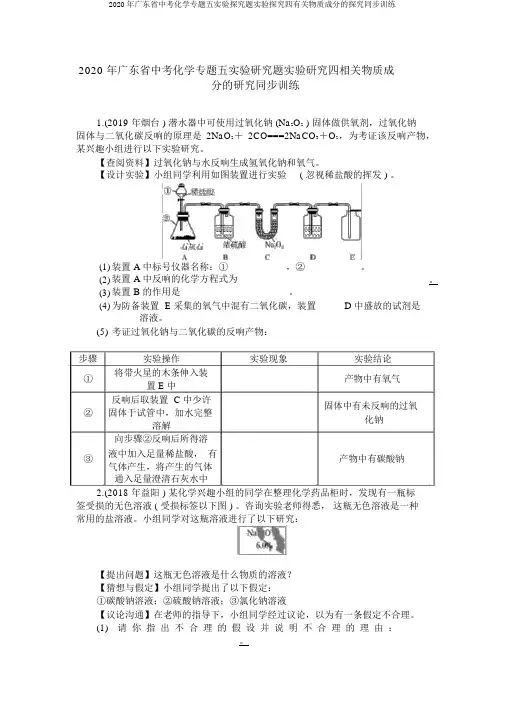
2020 年广东省中考化学专题五实验研究题实验研究四相关物质成分的研究同步训练1.(2019 年烟台 ) 潜水器中可使用过氧化钠 (Na2O2 ) 固体做供氧剂,过氧化钠固体与二氧化碳反响的原理是2NaO2+2CO===2NaCO3+O2,为考证该反响产物,某兴趣小组进行以下实验研究。
【查阅资料】过氧化钠与水反响生成氢氧化钠和氧气。
【设计实验】小组同学利用如图装置进行实验( 忽视稀盐酸的挥发 ) 。
(1)装置 A 中标号仪器名称:① __________,② __________。
(2)装置 A 中反响的化学方程式为。
(3)装置 B 的作用是 ____________________。
(4)为防备装置 E 采集的氧气中混有二氧化碳,装置 D 中盛放的试剂是____________溶液。
(5)考证过氧化钠与二氧化碳的反响产物:步骤实验操作实验现象实验结论①将带火星的木条伸入装_________________产物中有氧气置 E 中_反响后取装置 C中少许固体中有未反响的过氧②固体于试管中,加水完整____________化钠溶解向步骤②反响后所得溶③液中加入足量稀盐酸,有_________________产物中有碳酸钠气体产生,将产生的气体_通入足量澄清石灰水中2.(2018 年益阳 ) 某化学兴趣小组的同学在整理化学药品柜时,发现有一瓶标签受损的无色溶液 ( 受损标签以下图 ) 。
咨询实验老师得悉,这瓶无色溶液是一种常用的盐溶液。
小组同学对这瓶溶液进行了以下研究:【提出问题】这瓶无色溶液是什么物质的溶液?【猜想与假定】小组同学提出了以下假定:①碳酸钠溶液;②硫酸钠溶液;③氯化钠溶液【议论沟通】在老师的指导下,小组同学经过议论,以为有一条假定不合理。
(1)请你指出不合理的假设并说明不合理的理由:。
【查阅资料】硫酸钡既不溶解于水又不溶解于酸:碳酸钠溶液呈碱性:Ba(OH)2的化学性质与 Ca(OH)2相像。



2020年广东省初中学业水平考试化学(满分为100分,考试用时为60分钟)可能用到的相对原子质量:H—1 C—12 O—16 Cu—64一、选择题(本大题包括15小题,每小题3分,共45分。
在每小题列出的四个选项中,只有一个是正确的)1.下列过程发生了化学变化的是()A.冰雪融化B.汽油挥发C.大米酿酒D.玻璃破碎2.下列广东美食中富含淀粉的是()A.客家豆腐B.广式腊肠C.深井烧鹅D.陈村米粉3.酒精运输车合适位置应张贴的标志是()A.B.C.D.4.下列物质属于空气污染物的是()A.氧气B.氮气C.水蒸气D.二氧化硫5.Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。
Na2CO3属于()A.氧化物B.盐C.有机物D.混合物6.公园里能闻到花香,合理的解释是()A.分子体积变大B.分子在不断运动C.分子数目变多D.分子发生了分解7.合成材料的应用与发展,大大方便了人类的生活。
下列物品是用有机合成材料制作的是()A.塑料桶B.纯羊毛衫C.铅笔芯D.青铜铸像8.稀土有“工业的维生素”的美誉。
钇是一种重要的稀土元素,下列说法中错误的是()A.钇属于金属元素B.钇的原子序数是39C.钇的相对原子质量是88.91克D.钇原子的核外电子数为399.下列除杂方法正确的是()选项物质(括号内为杂质)方法A K2CO3溶液(K2SO4)加BaCl2溶液,过滤B N2(O2)将气体通过灼热的铜网C NaOH溶液(Na2CO3)加入稀硫酸D ZnSO4溶液(CuSO4)加入过量的铁粉,过滤10.化学与生产、生活密切相关,下列说法错误的是()A.人体缺碘会引起贫血B.碳酸氢铵(NH4HCO3)是一种氮肥C.炒菜时油锅着火,用锅盖盖灭D.铁制品表面刷漆可防止生锈11.将20g KOH加入100g水中,配制成溶液。
下列说法错误的是()A.KOH在水中解离出K+和OH-B.一个K+带一个单位正电荷C.该溶液的溶质质量分数为20% D.向该溶液中滴入酚酞指示剂,溶液变红12.如图是KNO3的溶解度曲线,下列说法正确的是()A.溶液从b点降温到a点,有晶体析出B.60℃时,b、c点对应的都是饱和溶液C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液D.60℃时,向50g水中加入60g KNO3,形成不饱和溶液13.实验室用氯酸钾固体(二氧化锰作催化剂)制取氧气,下列装置组合正确的是()A.①③B.①⑤C.②③D.②④14.2020年我国在抗击新冠肺炎战役中取得了阶段性重大成果,为防控疫情,通常在公共场所使用84消毒液(主要成分是NaClO)进行消毒。


2024-2024学年年人教版五四学制化学实验探究专题复习物质成分的探究教案一、教学目标1.知识与技能:1.1理解物质的组成和性质。
1.2掌握实验探究的基本方法和技巧。
1.3能够运用实验手段分析物质的成分。
2.过程与方法:2.1培养学生的实验操作能力和观察能力。
2.2培养学生的合作精神和创新意识。
2.3培养学生解决问题的能力。
二、教学内容1.物质成分的探究实验原理。
2.实验探究的基本方法和步骤。
3.实验数据的处理和分析。
三、教学重点与难点1.教学重点:1.1物质成分的实验探究方法。
1.2实验数据的处理和分析。
2.教学难点:2.1实验操作技巧的掌握。
2.2实验结果的解释。
四、教学过程第一课时:物质成分的探究实验原理1.导入1.1回顾已学过的化学知识,引导学生思考如何分析物质的成分。
1.2提问:同学们,你们知道如何通过实验手段分析物质的成分吗?2.讲解实验原理2.1介绍物质成分的实验探究方法,如滴定法、光谱法、质谱法等。
2.2分析每种方法的原理和适用范围。
3.实验演示3.1演示滴定法的实验操作,让学生了解实验步骤和注意事项。
3.2演示光谱法的实验操作,让学生了解实验步骤和注意事项。
4.小组讨论4.2每组派代表分享讨论成果。
第二课时:实验探究的基本方法和步骤1.导入1.1回顾上节课学习的实验原理。
1.2提问:同学们,你们知道实验探究的基本方法和步骤吗?2.讲解实验方法2.1介绍实验探究的基本方法,如观察法、比较法、归纳法等。
2.2分析每种方法的优缺点和适用范围。
3.实验步骤3.1讲解实验步骤,包括实验前准备、实验操作、实验结果记录等。
3.2分析每个步骤的注意事项。
4.小组活动4.1分组进行实验操作,让学生亲身体验实验过程。
4.2指导学生记录实验数据,分析实验结果。
第三课时:实验数据的处理和分析1.导入1.1回顾上节课学习的实验步骤。
1.2提问:同学们,你们知道如何处理和分析实验数据吗?2.数据处理2.1讲解实验数据的处理方法,如平均值法、误差分析等。

初三化学中考专题训练-探究性实验1. 发酵粉是一种制作风味糕点的常见蓬松剂。
某兴趣小组拟对其化学成分进行如下探究。
【查阅资料】①发酵粉一般含有NH 4HCO 3、NaHCO 3、明矾[KAl(SO 4)2∙12H 2O]中的2种。
②已知反应:2NaHCO 3Na 2CO 3+H 2O+CO 2↑【提出假设】假设1:有NH 4HCO 3和NaHCO 3;假设2:有NaHCO 3和明矾;假设3:有 和明矾。
【方案与流程】 【问题与讨论】(1)步骤①的操作是在研钵中把发酵粉和熟石灰混合、研磨。
(2)气体A 为 。
若生成A ,证明假设 或假设 可能成立;若不生成A ,证明假设 成立。
(3)如果生成A ,经过步骤②和步骤③后,生成气体B ,则B 是(填化学式) ,证明假设 成立,写出步骤②的化学方程式 。
假设】 假设3:NH 4HCO 3(1分) 【问题与讨论】(2)(5分)氨气(或NH 3或刺激性气味的气体)(2分) 1(1分)(本答案与下一空格答案顺序调换同样给分) 3(1分) 2(1分)(3)(5分)CO 2(2分) 1(1分) NH 4HCO 3NH 3↑+H 2O+CO 2↑(2分)2.已知碳酸易分解,草酸与碳酸有相似的化学性质,在受热的条件下草酸也会分解,仅生成了三种氧化物。
化学学习小组对此展开探究:[提出问题]生成的三种氧化物是什么?[查阅资料]无水硫酸铜是一种白色粉末物质,遇水变成淡蓝色硫酸铜晶体。
化学方程式为:CuSO 4(白色粉末)+5H 2O=CuSO 4•5H 2O (蓝色晶体)[提出猜想]生成的氧化物中有H 2O 、CO 2和CO 。
[实验探究]小亮将生成的气体,依次通过如图所示装置,验证猜想。
(1) 观察到A 中现象为________ ____ ________ ,证明生成物中有水。
(2)B 中澄清石灰水变浑浊,证明生成物中有____ _____。
(3) D 中红色粉末是_______(写化学式),D 装置中反应的化学方程式为: _____________ ______________,实验现象是____________ ____________。
实验探究四有关物质成分的探究1.(2015年揭阳)操作和保存药品不当,标签常常易损毁。
现有四瓶溶液①②③④的试剂标签已破损(如图),但是已经知道这四瓶试剂是NaOH 、Ca(OH)2、Na 2CO 3、KCl 溶液中的一种,某兴趣小组同学决定对四瓶破损标签溶液成分进行实验探究(实验另外药品只提供盐酸和酚酞溶液):① ② ③ ④【提出问题】标签已经破损的①②③④四瓶溶液分别是什么溶液?【实验探究1】第④瓶试剂肯定是:____________(写化学式)。
2.(2016年广安)蚊虫叮咬时能在人体皮肤内分泌出蚁酸,让人痛痒不止。
某课外兴趣小组在老师的带领下决定对蚁酸进行探究。
【提出问题】蚁酸的成分是什么?它有什么性质?【查阅资料】蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH ;蚁酸在一定条件下会分解成两种氧化物。
【实验与探究一】向盛有蚁酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明蚁酸溶液显________性。
【实验与探究二】(1)小明同学根据蚁酸中含有氢元素,推测出生成物中含有水。
(2)另一种生成物是气体,小刚提出两种猜想:猜想①:该气体是__________;猜想②:该气体是一氧化碳。
为了证明自己的猜想,他们将蚁酸分解产生的气体通过下图所示的装置(铁架台已略去),观察现象。
Ⅰ.实验时装置A 中无明显变化,则猜想①________(填“成立”或“不成立”)。
Ⅱ.实验时装置C 中的实验现象__________________,由上述实验现象,得出猜想②成立。
【评价与反思】E 处酒精灯的作用是________________________________。
3.(2016年广东)小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜[Cu(OH)2=====△CuO +X],于是用CuSO 4溶液与KOH 溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X 的化学式为____________。
(2)制取氢氧化铜的化学方程式为____________________________。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。
为弄清这种红色固体的成分,进行了如下的探究:【查阅资料】Cu和Cu2O均为红色固体,且Cu2O+H2SO4===Cu+CuSO4+H2O。
【提出猜想】红色固体是:Ⅰ.Cu Ⅱ.Cu2O Ⅲ.______________________。
【资料在线】(1)加热条件下,气体X能与氧化铜反应生成铜、水和氮气。
(2)碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应。
无水氯化钙可吸收气体X。
(3)本实验条件下,氮气密度为1.15 g·L-1,装置内空气对相关数据测定的影响可忽略不计。
【实验步骤】(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为2.40 g。
(3)按下图所示装入药品,测量并记录相关数据Ⅰ(见下表)。
(4)连接A、B、C装置,将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热。
当A装置中氧化铜反应完全,停止加热,继续通入气体X至玻璃管冷却,再次测量并记录相关数据Ⅱ(见下表)。
【实验装置】A B C D【相关数据】【回答问题】(1)B装置中氧化钙吸水的原理为:________________________________(用化学方程式表示)。
(2)实验过程中,当观察到__________________________,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是______________________________。
(3)分析实验测量的数据,生成水的质量为________g,氧化铜中氧元素的质量为________g。
由此推知,气体X中一定________(填“有”或“没有”)氧元素。
(4)通过计算推导出气体X的化学式。
5.(2013年广东) 仓库中有一包氮肥的包装标签模糊不清,有同学进行了以下探究:(1)操作③用玻璃棒搅拌的目的是______________。
为无气味,现象Ⅲ、Ⅳ无现象,则该氮肥可能是____________________(只写一种)。
6.(2014年佛山)地球上的金属资源广泛地存在于地壳和海洋中,工业上主要是从含有金属元素并有开采价值的矿石中提炼金属。
(1)赤铁矿在自然界中储藏丰富,其主要成分的化学式是____________。
(2)磁铁矿的主要成分是Fe 3O 4。
在Fe 3O 4中存在两种不同价态的铁离子,其中13是Fe 2+,23是Fe 3+。
请写出Fe 3O 4与盐酸反应的化学方程式:___________________________________。
(3)工业上主要采用高炉炼铁,常用到的原料有铁矿石、焦炭、石灰石和空气。
其中,焦炭的作用是________________________________________________(仅答一点)。
(4)由于铁的氧化物中Fe 3O 4和FeO 均为黑色,实验室用CO 还原Fe 2O 3得到的铁中是否会含有Fe 3O 4和FeO ,某同学设计了下列探究实验。
资料:FeCl 3溶液与铁发生的反应是2FeCl 3+Fe===3FeCl 2,但FeCl 3溶液不与Fe 3O 4、FeO反应;含有Fe 3+的盐溶液遇到KSCN 溶液时变成红色,利用该反应可检验Fe 3+的存在。
【提出问题】CO 还原Fe 2O 3得到黑色产物的成分是什么?【猜 想】猜想1:Fe ; 猜想2:Fe 和Fe 3O 4;猜想3:Fe 和FeO ; 猜想4:____________。
的化学性质进行探究。
【探究实验一】碳酸氢钠溶液的酸碱性:用pH 试纸测得碳酸氢钠溶液的pH 约为10,由此得出结论是碳酸氢钠溶液呈____________。
【探究实验二】碳酸氢钠能否与酸反应:取少量固体放入试管中,滴加足量的稀盐酸,现象为______________。
结论:碳酸氢钠能与酸反应。
【探究实验三】碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在铜片上加热,如下图所示:(1)加热一段时间后,观察到烧杯内壁有水珠。
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到石灰水变浑浊。
(3)通过进一步实验来确定充分加热后的固体产物的成分。
限选试剂及仪器:稀盐酸、_____________________________________________________________________。
8.某实验小组对实验室制取氢气的反应原理进行探究。
【知识回顾】能产生氢气的化学反应:①水电解;②活泼金属与酸反应。
【讨论交流】反应①的化学方程式:____________________________;同学们讨论后认为该反应不适用于实验室制取氢气。
【实验探究】为了探究哪种物质更适合用于实验室制取氢气,大家设计了如下实验:A B C_________________________。
【知识拓展】(1)确定实验室制取气体的反应原理时,要考虑诸多因素,如反应的快慢、收集的难易、____________等。
(2)用稀盐酸制取氢气时,制得的气体中可能会增加的杂质为__________。
实验探究四有关物质成分的探究【演练·专项提升】1.[实验探究1]KCl[实验探究2]三瓶溶液都使无色酚酞变红色 稀盐酸 产生大量气泡 碳酸钠 无明显现象 产生白色沉淀 NaOH[反思与交流]标签应向手心2.[实验与探究一]酸[实验与探究二](2)二氧化碳 Ⅰ.不成立 Ⅱ.黑色粉末变成红色[评价与反思]燃烧除去一氧化碳,避免空气污染3.(1)H 2O(2)CuSO 4+2KOH===Cu(OH)2↓+K 2SO 4(3)Cu 和Cu 2O Cu 2O解析:[进行实验]①铜与硫酸不反应,由化学方程式Cu 2O +H 2SO 4===Cu +CuSO 4+H 2O 知,溶液由无色变蓝色,固体减少。
②过滤、洗涤、干燥,得红色固体,说明1.44 g 红色固体一定有Cu 2O 。
4.(1)CaO +H 2O===Ca(OH)2(2)量气管内液面不再下降 防止灼热的铜被氧化(3) 0.54 0.48 没有(4)解:设气体X 的化学式为N m H n 。
氮元素质量氢元素质量=14 m n =1.15 g·L -1×0.2435 L 0.54 g -0.48 gm n ≈13答:气体X 的化学式为NH 3。
5.(1)加速溶解 (2)碳酸氢铵 铵根 硫酸铵(NH 4)2SO 4+Ba(NO 3)2===BaSO 4↓+2NH 4NO 3 NH 4Cl NH 4Cl +AgNO 3===AgCl↓+NH 4NO 3(3)NH 4NO 3 尿素(或硝酸钾、硝酸钠等)6.(1)Fe 2O 3(2)Fe 3O 4+8HCl===2FeCl 3+FeCl 2+4H 2O(3)生成用于还原铁矿石的还原性物质CO(合理即可)(4)[猜 想]Fe 、Fe 3O 4和FeO[实验探究]Ⅱ.取第Ⅰ步过滤所得固体装入试管中,加入足量的盐酸,随后滴入几滴(或少量)KSCN 溶液Ⅲ.澄清石灰水 澄清石灰水变浑浊7.[探究实验一]碱性[探究实验二]产生大量气泡[探究实验三](3)氯化钙 酚酞溶液 溶液不变色 (4)2NaHCO 3=====△Na 2CO 3+CO 2↑+H 2O8.[讨论交流]2H 2O=====通电2H 2↑+O 2↑[分析与结论]发烫 反应速率适中Zn +H 2SO 4 === ZnSO 4+H 2↑[知识拓展](1)反应条件(或成本、气体纯度等)(2)氯化氢(或HCl)。