甲型H1N1流感核酸检测方法090510
- 格式:doc
- 大小:274.00 KB
- 文档页数:13

甲型流感病毒感染病毒检测的方法有哪些?甲型流感是一种由甲型流感病毒引起的呼吸道传染病。
与其他呼吸道感染相比,甲型流感的病毒传播能力较强,而且症状也比较严重。
在预防、治疗和后期恢复中,正确的检测方法是非常重要的。
本文将介绍甲型流感病毒感染的检测方法以及预防、治疗和后期恢复的注意事项。
甲型流感病毒感染的检测方法1.核酸检测(RT-PCR):核酸检测是目前甲型流感病毒感染的主要检测方法。
这种方法通过采集患者的呼吸道标本,如咽拭子、鼻咽拭子或痰液,提取其中的病毒核酸,然后利用反转录聚合酶链反应(RT-PCR)技术进行检测。
核酸检测的优点是准确度高,能够检测出病毒的存在,但需要在实验室条件下进行,耗时较长。
2.快速抗原检测(Rapid Antigen Test):快速抗原检测是一种简便、迅速的甲型流感病毒感染检测方法。
该方法通过检测标本中的特定病毒抗原,可以在数分钟内快速筛查出感染情况。
然而,与核酸检测相比,快速抗原检测的准确性略低,有时会出现假阴性结果。
因此,如果快速抗原检测结果为阴性,但临床症状明显,仍然需要进行核酸检测以排除感染。
3.血清学检测(Serologic Test):血清学检测通过检测患者血液中的特定抗体来判断是否感染甲型流感病毒。
这种检测方法主要用于疫情调查和流行病学研究,对于早期感染的诊断准确性较低。
以上三种检测方法各有优劣,医生会根据病情和实际需要选择合适的方法进行检测。
预防甲型流感病毒感染的注意事项预防甲型流感病毒感染是非常重要的,可以采取以下措施:1.接种疫苗:甲型流感病毒感染的最有效预防方法是接种相关的流感疫苗。
每年秋季接种疫苗可以有效提高免疫力,减少感染的风险。
接种疫苗还可以降低患者的病情严重程度,减少并发症的发生。
2.保持良好的个人卫生:勤洗手、使用洗手液消毒、避免接触口鼻眼等黏膜部位,是预防病毒传播的简单有效措施。
此外,尽量避免与感染者密切接触,特别是在流感高发季节。
3.注意健康状况:保持良好的生活习惯,均衡饮食,增强体质,提高免疫力,可以降低感染甲型流感病毒的风险。

甲型H1N1流感病毒采用不同核酸提取方法的比较研究王赤华;曾勇【期刊名称】《临床和实验医学杂志》【年(卷),期】2017(016)003【摘要】Objective To study the accurate and effective method for the extraction of influenza a H1N1 influenza virus.Methods A total of 40 pharyngeal swab points from patients with influenza A (H1N1) from December 2014 to December 2015 in our hospital were selected as the research object.The obtained specimens were 10-1 ~ 10-4 series dilution,obtained with different concentrations of influenza virus samples preparation of inspection.This research mainly uses three kinds of reagent box to carry on the experiment.A was Maxwell16 Promega automatic nucleic acid extraction apparatus and the extractor kit,as group A;B was the Qiagen RNeasy Mini Kit;C was domestic H company RNA extraction kit.The nucleic acid extraction of the three methods was compared.Results The total RNA concentration of A group was the highest,followed by B group,in C group was the lowest.The concentration of extraction rate in Group A at each dilution were highest and the difference was statistically significant (P < 0.05).With increase of concentration,the influenza virus extraction rate decreased gradually in Group B and group C,especially in group C,when diluted to 10-4,influenza virus couldnt beextracted.Conclusion The effect of Automatic nucleic acid extractionapparatus for nucleic acid extraction is better,even under high dilution conditions,it can also achieve high nucleic acid extraction rate.It is a rapid and effective detection method to avoid the error of the manual extraction,which is worthy of promotion and application in clinical.%目的研究甲型H1N1流感病毒核酸提取的比较准确和有效的方法.方法选用2014年12月至2015年12月就诊的甲型H1N1流感患者的咽拭子共40份作为研究对象.对所获得的标本进行10-1~10-4的系列稀释,获得不同浓度的流感病毒标本备检.主要采用三种试剂盒进行实验:一种是Promega公司的Maxwell16全自动核酸提取仪以及该提取仪的配套试剂盒,为A组,一种是QIAGEN公司的Rneasy Mini Kit,为B组,第三种则是国产的H生物公司的RNA提取试剂盒,为C组.对三种方法的核酸提取情况进行比较.结果对同一份咽拭子的核酸进行提取,A组所提取的总RNA浓度最高,B组的总RNA浓度次之,C组的总RNA浓度最低.A组在各个稀释浓度的流感病毒提取率均较高,差异均具有统计学意义(P<0.05);C组和B组随着稀释浓度的增大,流感病毒的提取率逐渐降低,尤其是C组当稀释浓度为10-4时,提取不到流感病毒.结论全自动核酸提取仪对核酸的提取效果较好,即使在高倍稀释的情况下也能够达到较高的核酸提取率,避免了手工提取的误差,是一种快捷有效的检测方法,值得在临床上推广使用.【总页数】3页(P230-232)【作者】王赤华;曾勇【作者单位】湖北省黄冈市疾病预防控制中心检验科湖北黄冈438000;湖北省黄冈市中医医院肿瘤科湖北黄冈 438000【正文语种】中文【相关文献】1.实时荧光RT-PCR检测不同标本中甲型H1N1流感病毒核酸的临床意义 [J], 陈双峰;陈海英;张颖新;郑丽丽2.16S核糖体DNA宏基因组测序中细菌核酸提取方法的比较研究 [J], 王伟;童贻刚;王玉琢;舒鹏;米志强;安小平;裴广倩;刘文丽;袁文俊;史套兴3.转基因水稻种子核酸提取方法的比较研究 [J], 隋志伟;余笑波;王晶;李亮;臧超;叶子弘4.不同核酸提取方法和新型冠状病毒核酸检测试剂室间质评结果分析 [J], 余汉忠;牛璐璐;孔倩倩;李小川;蔡佩君;王丽5.不同核酸提取方法SARS-CoV-2核酸检测性能比较 [J], 张云丽;王鑫;邵玲;曲波;赵鸿梅因版权原因,仅展示原文概要,查看原文内容请购买。

甲型H1N1流感的诊断
诊断主要结合流行病学史、临床表现和病原学检查,早发现、早诊断是防控与有效治疗的关键。
(一)疑似病例。
符合下列情况之一即可诊断为疑似病例:
1.发病前7天内与传染期甲型H1N1流感确诊病例有密切接触,并出现流感样临床表现。
密切接触是指在未采取有效防护的情况下,诊治、照看传染期甲型H1N1流感患者;与患者共同生活;接触过患者的呼吸道分泌物、体液等。
2.出现流感样临床表现,甲型流感病毒检测阳性,尚未进一步检测病毒亚型。
对上述2种情况,在条件允许的情况下,可安排甲型H1N1流感病原学检查。
(二)临床诊断病例。
仅限于以下情况作出临床诊断:同一起甲型H1N1流感暴发疫情中,未经实验室确诊的流感样症状病例,在排除其他致流感样症状疾病时,可诊断为临床诊断病例。
甲型H1N1流感暴发是指一个地区或单位短时间出现异常增多的流感样病例,经实验室检测确认为甲型H1N1流感疫情。
在条件允许的情况下,临床诊断病例可安排病原学检查。
(三)确诊病例。
出现流感样临床表现,同时有以下一种或几种实验室检测结果:
1.甲型H1N1流感病毒核酸检测阳性(可采用real-time RT-PCR和RT-PCR方法);
2.分离到甲型H1N1流感病毒;
3.双份血清甲型H1N1流感病毒的特异性抗体水平呈4
倍或4倍以上升高。

甲型(H1N1)流感病毒实验室检测技术方案(试行)广州健仑生物科技有限公司整理本方案旨在为全国流感监测网络实验室提供甲型H1N1流感病毒实验室检测技术方案,不用作商业活动或赢利目的。
一、标本的采集种类和要求1、推荐采集的呼吸道标本种类疾病发病后应尽快采集如下标本:鼻拭子、咽拭子、鼻腔吸取物、鼻腔冲洗液。
气管插管的病人也应收集气管吸取物。
标本应置于无菌病毒采样液,并立即用冰块或冰排保存或置于4 ℃(冰箱),并马上送至实验室。
(临床样品采集人员及实验室检测人员的感染控制指导请见相关文件。
)采样同时填写疑似人感染甲型H1N1感染病例标本采样单。
(附表1)2、拭子的选择标本应使用头部为合成纤维的拭子(例如,聚酯纤维),用铝或塑料做柄。
不推荐棉拭子和木柄。
标本采集管应包含3毫升病毒采样液(含有蛋白质稳定剂,阻止细菌和真菌生长的抗生素,缓冲液)3、临床标本储存要求保存在4℃(不能超过4天)或者-70℃或-70℃以下。
有条件的实验室均应保存在-70℃或-70℃以下。
不应保存在-20℃。
4、标本的分装处理标本送至实验室后,立即进行处理,避免反复冻融。
将原始标本分为三份,一份用于核酸检测,一份用于病毒分离,一份保存待复核。
5、标本的运输疑似人感染甲型H1N1感染病例列为 A类,用UN2814包装运输。
填写疑似人感染甲型H1N1感染病例标本送检单(附表2)。
二、核酸检测基于PCR原理的核酸检测方法是一种快速有效的诊断方法,在突发传染病应急工作中发挥了巨大作用。
1、基于real-time RT-PCR的方法检测新的甲型H1N1流感病毒(引物和探针序列为美国CDC设计):4月29日WHO网站上公布了美国CDC设计的针对此次甲型H1N1流感病毒的real-time RT-PCR引物和探针,此实验用于检测疑似甲型H1N1流感病例的呼吸道样本, 因此,用此real-time RT-PCR的方法,建议首先筛选甲型流感病毒并排除季节性流感病毒和H5N1禽流感病毒。
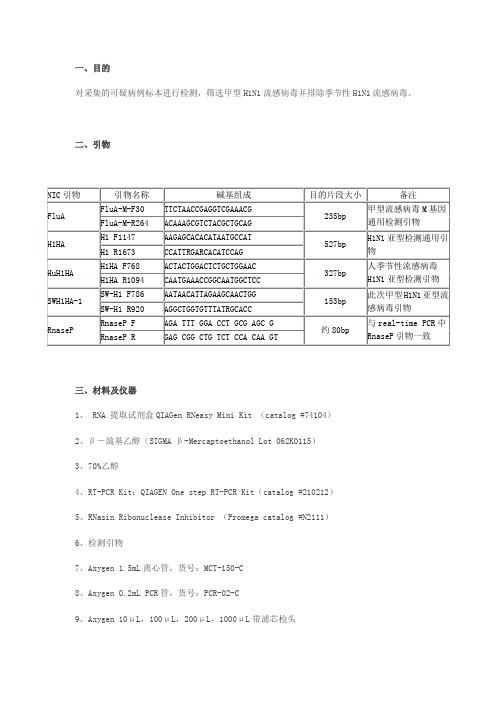
一、目的对采集的可疑病例标本进行检测,筛选甲型H1N1流感病毒并排除季节性H1N1流感病毒。
二、引物三、材料及仪器1、 RNA 提取试剂盒QIAGen RNeasy Mini Kit (catalog #74104)2、β-巯基乙醇(SIGMA β-Mercaptoethanol Lot 062K0115)3、70%乙醇4、RT-PCR Kit:QIAGEN One step RT-PCR Kit(catalog #210212)5、RNasin Ribonuclease Inhibitor (Promega catalog #N2111)6、检测引物7、Axygen 1.5mL离心管,货号:MCT-150-C8、Axygen 0.2mL PCR管,货号:PCR-02-C9、Axygen 10μL,100μL,200μL,1000μL带滤芯枪头10、10μL,100μL,200μL,1000μL加样器11、可调转速14K离心机:12、旋涡混合器:13、生物安全柜:二级生物安全柜14、PCR仪:15、琼脂糖:Biowest Agarose Distributed by Gene Tech(Shanghai)Company Limited Lot No. 10168516、核酸染料:17、电泳液:5×TBE电泳缓冲液 cat No. 9009032718.电泳槽、电泳仪四、实验步骤(一)RNA提取1、根据标本数量分装RLT液:从Kit中取出RLT液,用1.5mL离心管分装,每管500μL(在体系配制区操作)。
2、在生物安全柜内将采样液(鼻拭子、咽拭子、胸水等)或病毒培养物(鸡胚尿囊液或细胞培养液)取100μL加入RLT液管中,充分混匀。
3、每管分别加入5μL β-巯基乙醇,混匀后依次加入600μL 70%的乙醇,充分混匀。
4、从Kit中取出带滤柱的2mL收集管,打开包装将其做好标记。
取步骤(3)中的混合液600μL加入滤柱中,12000rpm,离心15s,弃收集管中的离心液。

核酸检测也能测出甲流病毒在全球范围内,传染病是人类面临的一个重大挑战。
甲流(H1N1流感)是一种高度传染性的流感病毒,可导致严重的呼吸道感染。
为了监测和控制甲流的传播,核酸检测被广泛应用于检测感染者。
本文将讨论核酸检测如何检测甲流病毒,并介绍其在甲流疫情中的作用。
甲流病毒是一种RNA病毒,核酸检测是检测该病毒最常用的方法之一。
核酸检测利用聚合酶链反应(PCR)技术,通过放大病毒RNA的特定序列来检测感染者。
PCR技术是一种高度敏感和特异性的方法,可以检测到甲流病毒的极低浓度。
此外,核酸检测还可以确定感染者是否具有活性病毒,从而帮助医生判断感染者是否具有传染性。
核酸检测甲流病毒的过程通常包括以下几个步骤。
首先,医生会采集患者的咽拭子或鼻拭子样本。
这些样本含有患者的呼吸道分泌物,可能携带甲流病毒。
然后,样本中的核酸会被提取出来,并经过一系列处理步骤来净化和纯化。
接下来,提取出的核酸将进行PCR反应,利用适当的引物和酶来放大甲流病毒RNA的特定序列。
最后,PCR产物将通过电泳或其他检测方法进行分析。
如果甲流病毒的特定序列存在于PCR产物中,那么说明患者可能感染了甲流病毒。
核酸检测甲流病毒的优点之一是其高度敏感性。
传统的病毒培养方法可能需要较长时间来获得结果,并且可能无法检测到甲流病毒的低浓度。
然而,核酸检测使用PCR技术可以在很短的时间内获得结果,并且可以检测到非常低浓度的甲流病毒。
这使得核酸检测成为监测和诊断甲流病毒感染的首选方法。
此外,核酸检测还可以提供关于甲流病毒的更多信息。
通过确定PCR产物的序列,可以确定感染者所携带的甲流病毒株系。
这对于疫苗开发和病毒流行病学研究至关重要。
另外,核酸检测还可以检测到病毒的变异。
甲流病毒会不断发生变异,这可能对疫苗的有效性和治疗方法产生影响。
通过监测甲流病毒的变异,可以及时调整疫苗和治疗策略,提高对该病毒的控制和防范能力。
然而,核酸检测也存在一些限制。
首先,该方法需要专业设备和培训有素的技术人员来操作。
三种核酸提取方法在甲型流感病毒临床样本检测中的效果对比刘建礼;刘翌;焦艳丽;张绍福;李岩【摘要】目的比较三种核酸提取方法在甲型流感临床样本检测中的效果,为优化甲流病毒临床样本检测效果提供依据.方法在三例口岸送检的甲流临床样本的检测中,分别以硅胶膜法、磁珠法和快速法三种方法提取病毒核酸,以商品化荧光RT-PCR 试剂盒或实验室自建荧光RT-PCR体系进行甲型流感病毒和流感病毒H3亚型检测.结果商品化试剂盒检测中,用硅胶膜法提取的三份样本均能检出阳性,而快速法提取的核酸仅能在03号样本中检出,在另外两份样本中未能检出.在自建体系检测中,三种方法提取的核酸均能检出甲流病毒阳性,但快速法检测的Ct值明显高于硅胶膜法和磁珠法.结论对于低病毒浓度样本,硅胶膜法和磁珠法提取核酸的效率更高,快速法有漏筛的风险.%Objective To compare the efficiency of three RNA extraction methods in detection of clinical specimensinfluenza virus A in order to provide a basis for optimizingthe detection effect of clinicalspecimensof genetic testing of influenza virus.Method In the detection of influenza virus clinical specimens sent to the port,the viral nucleic acid was extracted by silica gel membrane method,magnetic bead method and rapid method,respectively.RT-PCR were conducted to detect influenza virus A or influenza virus H3 subtype using commercial kits or in-house reaction?system.Results In the detection ofcommercial kits,those three specimens extracted by the silica membrane method were all positive,while the nucleic acid extracted by the rapid method can only be detected in-sample No.03,but not in the other two specimens..In the detection of the self-built system,all three specimens extracted by threemethods were positive for influenza virus A,but the Ct value detected by the rapid extraction was more higher than that by the silica membrane and magnetic bead method.Conclusion In RT-PCR detection of influenza virus for clinical specimens with low virus concentration,silica membrane method and magnetic bead method are more efficient in extracting nucleic acid,whilethe rapid extraction existsthe risk of missing detection.【期刊名称】《口岸卫生控制》【年(卷),期】2019(024)002【总页数】4页(P13-16)【关键词】甲型流感病毒;临床样本;核酸提取;荧光RT-PCR【作者】刘建礼;刘翌;焦艳丽;张绍福;李岩【作者单位】北京国际旅行卫生保健中心北京,100088;北京国际旅行卫生保健中心北京,100088;北京国际旅行卫生保健中心北京,100088;北京国际旅行卫生保健中心北京,100088;北京国际旅行卫生保健中心北京,100088【正文语种】中文【中图分类】R446.6流行性感冒是一种由流感病毒引起的急性呼吸道传染病,流感病毒大致分甲、乙、丙三种型,其中甲型流感病毒最容易引发流感爆发,甲型流感病毒根据H和N抗原不同,又分为许多亚型。
甲流检测步骤
甲流的检测步骤主要包括以下三个步骤:
症状观察:医生会询问患者的症状,如发热、咳嗽、喉咙痛、疲劳等,并观察患者的体温变化。
如果医生怀疑患者可能患有甲流,他们可能会进行更深入的测试。
血液检测:通过检测血液中的病毒抗体,确定是否感染了甲流病毒。
这种检测通常在感染后1-2周内能够检测到抗体。
样本检测:医生可能会从患者的鼻子或喉咙采集样本,然后在实验室进行检测,以确定是否感染了甲流病毒。
样本可能会被送到专门的实验室进行更深入的分析,以确定病毒的类型和可能的变种。
需要注意的是,这些检测步骤并不是绝对的,因为甲流病毒会影响人体的免疫系统,导致身体虚弱,容易感染其他疾病。
对于老年人、儿童、孕妇、身体虚弱的人来说,如果他们出现了类似流感的症状,应该尽快就医,并进行适当的检测和治疗。
同时,预防甲流的最有效方法是接种疫苗。
疫苗可以增强人体的免疫力,减少感染和传播的风险。
每年接种流感疫苗是预防流感的有效方法。
除了接种疫苗,还应该注意个人卫生,如勤洗手、避免接触病患、避免去人群密集的地方等。
总之,甲流的检测步骤包括症状观察、血液检测和样本检测。
预防甲流的最有效方法是接种疫苗和个人卫生。
如果出现类似流感的症状,应该尽快就医并进行适当的检测和治疗。
甲流测定方法
甲流这坏家伙,时不时就来捣乱,那咋知道自己是不是被它缠上了呢?嘿,这就得说说甲流测定方法啦!
先来讲讲步骤。
你就像个侦探,拿着试剂盒,按照说明书一步一步来。
先采集样本,比如鼻腔分泌物或者咽喉拭子。
哇塞,这就像在找小怪兽留下的线索一样。
然后把样本加到试剂盒里,等着结果出来。
这过程是不是有点小刺激呢?
注意事项也不少呢!采集样本的时候可别太用力,弄伤自己。
而且要保证样本的质量,不然结果可就不准啦!这就好比做饭,材料不好,做出来的菜能好吃吗?
那这测定过程安全不?放心吧!这就跟玩个小游戏似的,没啥危险。
稳定性也杠杠的,只要你操作正确,结果一般都很靠谱。
甲流测定的应用场景可多啦!学校、医院、家庭都能用上。
你想想,要是在学校,能及时发现甲流,那不就能避免大规模传染了吗?这多重要啊!优势也很明显,快速、方便、准确。
不用跑大老远等半天结果。
我给你说个实际案例哈。
有个小朋友突然发烧咳嗽,老师赶紧用甲流
试剂盒测了一下,结果真的是甲流。
马上通知家长,采取措施,避免了其他小朋友被传染。
这效果,简直太棒了!
所以啊,甲流测定方法真的很有用。
它就像个小卫士,能帮我们及时发现甲流这个小恶魔,保护我们的健康。
咱可得好好利用起来。
7种甲型H1N1流感病毒核酸检测方法的比较和验证蔡颖;周广彪;陈文婉;许如苏【期刊名称】《检验检疫学刊》【年(卷),期】2011(021)001【摘要】[目的]比较和验证7种甲型H1N1流感病毒核酸检测方法,筛选出可用于实验室日常检测的方法,并证实实验室具有正确操作这些方法的能力.[方法]应用7种方法检测甲型H1N1流感病毒核酸,包括5种SYBR Green Ⅰ荧光RT-PCR法和2种Taqman探针荧光RT-PCR法的商业试剂盒,用于方法比较和验证的参考样品包括猪流感H1N1病毒核酸、2009年新甲型H1N1流感病毒核酸、能力验证样品等不同来源的核酸.[结果]2种预期用于猪流感H1N1病毒核酸检测的SYBR Green Ⅰ荧光RT-PCR法均能达到预期目的;3种预期用于2009年新甲型H1N1流感病毒核酸检测的SYBR Green Ⅰ荧光RT-PCR法均无法区分2009年新甲型H1N1流感病毒核酸和猪流感H1N1病毒核酸;2种Taqman探针荧光RT-PCR试剂盒均能正确检出2009年新甲型H1N1流感病毒核酸,但只有1种可检出能力验证阳性样品.[结论]5种SYBRGreen Ⅰ荧光RT-PCR法中有2种能用于猪流感H1N1病毒核酸的检测,另外3种不能用于新甲型H1N1流感病毒核酸的检测;2种Taqman探针荧光RT-PCR法的商业试剂盒能用于2009年新甲型H1N1流感病毒核酸的检测.【总页数】5页(P16-20)【作者】蔡颖;周广彪;陈文婉;许如苏【作者单位】汕头出入境检验检疫局,广东汕头,515031;汕头出入境检验检疫局,广东汕头,515031;汕头出入境检验检疫局,广东汕头,515031;汕头出入境检验检疫局,广东汕头,515031【正文语种】中文【中图分类】Q939.47;R373.1【相关文献】1.几种甲型H1N1流感病毒SYBR Green Ⅰ荧光RT-PCR检测方法的验证 [J], 蔡翁义;蔡颖;魏锐;黄琦容;朱俊贤;周广彪2.甲型H1N1流感病毒采用不同核酸提取方法的比较研究 [J], 王赤华;曾勇3.7种甲型H1N1流感病毒核酸检测方法的比较和验证 [J], 蔡颖;周广彪;陈文婉;许如苏4.甲型H1N1流感病毒快速核酸检测方法探究 [J], 高洁;严敏;付婷;邵中军5.甲型H1N1流感病毒核酸检测能力验证样品制备及其应用效果评价 [J], 乔彩霞;高志强;张利峰;蒲静;谷强;张伟;刘来福;刘金华;张鹤晓因版权原因,仅展示原文概要,查看原文内容请购买。
5月9日更新:real-time RT-PCR方法检测甲型H1N1流感操作规程中文翻译版(请同时参考英文原版)请注意:体系建立请参照所使用试剂盒供应商所提供的使用说明。
本规程中的体系仅供参考。
美国CDC实时RTPCR(rRTPCR)检测猪流感操作规程(2009版) 本规程所有权归属疾病控制中心,紧急状态时授权各公共卫生实验室使用。
本规程不用作商业活动或赢利目的。
一、概述(一)前提本规程基于对rRT-PCR方法的基本掌握。
(二)实验原理实时荧光定量RTPCR(rRTPCR)法检测猪流感的方案是用一组寡核苷酸引物和双重标记的TaqMan®探针,对呼吸道样本或体外培养的猪流感病毒进行定性检测鉴定。
InfA引物和探针为检测出甲型流感病毒而设计,swInfA引物和探针可特异性地检测出所有的猪甲型流感病毒,swH1引物和探针可特异性检测猪流感病毒H1亚型。
本实验用于检测甲型流感阳性的疑似猪甲型流感感染病例的呼吸道样本。
(三)使用条件一步法定量R T-P C R96孔板热循环系统。
(四)生物安全要求样本处理应在相应的生物安全实验室完成。
(五)样本要求1、呼吸道样本支气管肺泡灌洗液,气管抽吸物,痰,鼻咽或口咽洗液或拭子。
拭子样本所用的拭子顶端应为人造材质(如聚脂或涤纶)、柄为铝制或塑料。
不推荐使用棉头木柄的拭子。
藻酸钙拭子采样不可取。
2、排除标准1)未在2-4°C (≤4 天)或-70°C及以下保存的样本2)以上未列的其它不当样本(六)核酸提取RT-PCR扩增效能依赖于样本模板RNA的质与量。
RNA提取操作需经过检验核酸的纯度合格之后,再用于样本实验。
商业化的操作程序中包括QIAamp®病毒RNA提取试剂盒,RNeasy®小试剂盒(QIAGEN公司),罗氏MagNA Pure Compact RNA分离试剂盒, MagNA Pure LC RNA分离试剂盒II, 和罗氏MagNA总核酸纯化试剂盒,在推荐的操作程序下,可提取高纯度的RNA。
(七)免责声明:提到的厂家名仅用作举例,并不表示疾控中心认可。
二、实验材料(一)试剂1、一步法荧光定量RT-PCR探针试剂盒;2、分子级无菌蒸馏水(无RNA酶和DNA酶);3、正反向引物(40μM);4、双重标记探针(10μM);5、阳性对照。
(二)供给1、实验室标记笔;2、微量离心管格栅,96孔0.2ml PCR反应管;3、20μl 和200μl 可调节移液器及滤芯枪头;4、0.2ml PCR 反应管盘;5、光学反应盖板;6、无菌,无核酸酶的1.5 ml微量离心管;7、一次性无粉手套。
(三)仪器设备1. 微量离心机;2. 漩涡振荡器;3. 实时荧光定量PCR检测系统,含96孔的热循环反应板。
三、操作程序(一)准备工作1. 避免样品污染由于fluorogenic 5’核酸酶测定的敏感性,应特别注意假阳性产生。
推荐以下预防污染的方法:1)实验准备与核酸提取使用独立区域;2)实验准备与核酸提取使用专用设备(如移液器,微量离心机)和耗材(如微量离心管,吸头);3)实验开始后穿清洁工作服,并使用新的一次性无粉手套;4)不同样本操作之间,以及怀疑可能污染的情况下均更换手套;5)试剂和反应管的盖子应尽量关闭。
2、仪器准备工作台、移液管、离心机必须清洁,用去污剂净化,例如5%的漂白剂、“DNAzap TM”或者“RNase AWAY®”来减小核酸交叉污染的风险。
3、试剂准备注意:在试验过程中,保持所有的试剂在冰架上保持低温。
1)引物和探针(1)分装好的冰冻的引物和探针进行融化(已融的探针避光2-8℃可保存多达3个月,不要对探针反复冻融);(2)涡旋振荡引物和探针;(3)瞬时离心引物和探针,之后置于冰架上。
2)Real time RT-PCR的试剂(1)将Master Mix和酶置于冰架上;(2)融化2×的Reaction Mix;(3)颠倒混合2×的Reaction Mix;(4)瞬时离心2×的Reaction Mix和酶,置于冰架上。
4、对RT-PCR的每一步过程均进行检测1)每个样品的RNA提取物通过分别的引物和探针进行检测:InfA, swFluA, Swine H1 (swH1) 和RNaseP (RP)。
RNaseP引物和探针是以人的RNaseP基因为靶基因的,因此对于人的核酸可以作为内部阳性对照。
2)对于每一个过程中包括的所有引物和探针,均设立无模板对照(NTC)和阳性模板对照(PTC)。
3)人类样本对照(HSC)提供了次级阴性对照,以便确认核酸提取过程和试剂的完整性。
5、建立反应反应检测混合物充分混合后加入到96孔板中。
然后在适当的实验反应和对照中,加入水和提取的核酸或者阳性模板对照(PTC)。
1)为每一个引物和探针标记一个1.5ml的微量离心管;2)对每一个建立的反应确定反应数(N)。
考虑到NTC、PTC、HSC反应和吸量误差,制备过量的反应混合物是必要的。
具体如下:(1)如果包括对照,样品的数量(n)为1到14,那么N=n+1;(2)如果包括对照,样品的数量(n)大于15,那么N=n+2。
3)Master Mix:计算加到每个引物/探针反应混合物中的各个试剂的量。
计算如下:* 体系建立请参照所使用试剂盒供应商所提供的使用说明。
4)加入水之后,通过上下吹打混匀反应混合物,不要涡旋振荡。
5)离心5s使混合物聚集管底,然后将管子置于冰架上;6)准备板状的反应管子或者96孔板,置于冰架上;7)每一个master mix吸取20μl到每一孔中,每排按顺序进行,如下图:实验建立举例:实验样本举例:注意:在任何样本被加入之前,应该首先加入阴性模板对照(NTC)(第1列),用来检验master mix中的污染。
HSC应该在待测样本之后加入(第11列),用来检验在样本准备或者加入过程中的交叉污染。
阳性模板对照(PTC)应该在所有样品和阴性模板对照(NTC)之后被加入。
8)在将培养板移到核酸处理区域之前,在试验设定区域,在反应板的第一列将NTC反应进行。
如上所述。
9)吸取5μl的nuclease free water到NTC孔,将NTC孔盖上。
10)将反应板盖上,移到核酸处理区域。
11)将含有样品的管子涡旋振荡5s,瞬时离心5s;12)将提取的核酸样本置于冰架上;13)如上所述,样品应该按列加入,吸取5μl的第一种样本到所有标记这种样品的孔中(例如,样本“S1”如上表格所示)。
不同样本之间需更换枪头操作。
14)加完样本的孔要盖住,这将会帮助防止样品的交叉污染,并且能够使操作人员记录其加样的具体进程;15)为了避免交叉污染,必要时更换手套;16)对剩下的样本,重复步骤13-15;17)加入5μl的HSC样品加到HSC孔中(第11列)。
将HSC孔盖盖。
18)最后,加5μl阳性模板对照RNA到所有PTC孔中,将PTC孔盖上。
19)如果使用8个管子的条状板子,每一条都要做标签标记,来指明每一个样品的位置(不要在反应管子的顶部标记!)。
瞬时离心条状管子10-15s,然后置于冰架上。
如果使用培养板,4℃,500g离心30s,置于冰架上。
6、RT-PCR扩增条件反应体系为25ul,反应条件如下:注:在55度这一步骤中要收集荧光信号(FAM)。
* 具体扩增条件请参照所使用试剂盒供应商所提供的使用说明。
7、解释说明/检验1)探针/引物的阴性对照反应中得到的荧光增长曲线不应该超过阈值线。
如果一个或者多个引物和探针的阴性反应出现了假阳性,则样品可能已经被污染。
那么整个实验过程是无效的,严格的按照步骤规则重新实验。
2)在37个循环处或者37个循环之前,所有的临床样本的RP反应曲线都应该超过阈值线,这表明从人类RNase P基因扩增到足够量的RNA,也表明了样本质量合格。
然而,可能有些样本会由于初始临床样本中的细胞数量较少而无法出现阳性结果。
同时,从动物/禽类体内或者经细胞培养得到的样本,经常会RP反应没有结果或者结果很弱。
如果在所有临床样本中检测RNase P都阴性,则说明:(1)从临床材料中对核酸的不适当的提取导致RNA的损失或者来自临床标本的RT-PCR抑制剂的残留污染;(2)没有足够的人类细胞以备检测;(3)方法建立和实施不当;(4)试剂和仪器原因。
3)在40个循环之内,HSC组中InfA,swFluA,swH1探针的荧光增长曲线不应该超过阈值线。
如果任何其中任何一个流感特异性探针的增长曲线超过了阈值线,那么有以下解释:(1)可能由于RNA提取试剂污染。
在实验前确保RNA提取试剂无误。
(2)RNA提取过程或建立反应加样过程发生交叉污染。
严格遵照操作程序的要求进行重复实验。
(3)在40个循环之前,PTC反应的InfA, swInfA, swH1和RP反应应出现阳性结果。
如果没产生预期的阳性结果则视为无效,应严格遵照操作程序进行重复实验。
确定PTC反应失败原因,订正并记录错误原因及更改方案。
不再使用没产生预期结果的PTC试剂。
(4)当所有对照都满足要求后,如果InfA反应增长曲线与阀值线在40个循环内有交叉时,则样本被视为A型流感病毒阳性。
如果A型流感病毒反应呈阳性,那么Univ SW 和/或SW H1也可能呈阳性。
如果样本InfA和特异亚型反应(swInfA和swH1)的反正增长曲线与阈值线在40个循环内有交叉,则视该样本为猪流感病毒A/H1阳性。
如果样本只有InfA和一个亚型的反应阳性或只有InfA 阳性,请联系CDC做进一步指导。
(5)在所有对照都满足要求的前提下,如果在40个循环内,待测样本的所有InfA反应阴性则视该样本为阴性。
8、限制规定1)实验员在实际操作之前应进行操作程序和试验结果分析的培训,熟练掌握后方可进行试验。
2)当样本量不足可能会产生假阴性结果,造成的原因可能是不当的收集,运输或处理。
3)如果反应中存在过量的DNA / RNA模板时也可能出现假阴性。
如果某样本的RP反应被抑制,则可以将提取的RNA进行2倍或更大倍数的稀释(例如1:10或1:100)来重复试验。
9、备注引物和探针参见英文版P7。
附件4real-time RT-PCR方法检测鉴定甲型H1N1流感操作规程(英文版)下载网址:http://www.who.int/csr/resources/publications/swineflu/realtimeptpcr/en/in dex.html附件5基于RT-PCR的方法检测新的甲型H1N1流感病毒一、目的对采集的可疑病例标本进行检测,筛选甲型H1N1流感病毒并排除季节性H1N1流感病毒。
二、引物三、材料及仪器1、RNA 提取试剂盒QIAGen RNeasy Mini Kit (catalog #74104)2、β-巯基乙醇(SIGMA β-Mercaptoethanol Lot 062K0115)3、70%乙醇4、RT-PCR Kit:QIAGEN One step RT-PCR Kit(catalog #210212)5、RNasin Ribonuclease Inhibitor (Promega catalog #N2111)6、检测引物7、Axygen 1.5mL离心管,货号:MCT-150-C8、Axygen 0.2mL PCR管,货号:PCR-02-C9、Axygen 10μL,100μL,200μL,1000μL带滤芯枪头10、10μL,100μL,200μL,1000μL加样器11、可调转速14K离心机:12、旋涡混合器:13、生物安全柜:二级生物安全柜14、PCR仪:15、琼脂糖:Biowest Agarose Distributed by Gene Tech(Shanghai)Company Limited Lot No. 10168516、核酸染料:17、电泳液:5×TBE电泳缓冲液cat No. 9009032718.电泳槽、电泳仪。