土壤交换性酸的测定
- 格式:doc
- 大小:47.50 KB
- 文档页数:3

实验五土壤酸碱度及缓冲性能的测定一、土壤酸碱度的测定(一)目的和意义:土壤溶液中氢离子和氢氧根离子的浓度比例不同,所表现出来的酸碱性质称为土壤的酸碱度,通常用pH表示。
在纯水或稀溶液中pH可用下式表示:pH=—log(H+)。
土壤酸碱度是土壤重要的化学性质,它直接影响土壤养分的存在状态、转化和有效性,对作物生长和土壤微生物活动也有影响。
土壤的各种理化性质、生物化学性质也和酸碱度有密切的关系。
测定土壤pH值可以作为改良酸性土和碱性土的参考依据,可以指导合理施肥,确定适宜的肥料种类。
测定土壤pH通常用比色法和电位测定法,电位法精确度比较高,pH的误差在0.02左右;混合指示剂比色法精确度较差,pH的误差在0.5左右,适用于野外速测,pH标准溶液系列的比色法精确度较混合剂比色法高,但不及电位法精确。
(二)混合指示剂比色法1、原理利用某些染料在不同氢离子浓度时改变颜色的特性,配成指示剂,与待测定的土壤溶液产生颜色反应,和标准的pH比色卡进行比较而确定土壤pH值。
为方便起见,常将几种不同pH范围的指示剂混合在一起,配制成混合指示剂。
2、试剂配制(1)pH4—8混合指示剂:用分析天平称取等量(0.25克)的溴甲酚绿、溴甲酚紫及甲酚红三种指示剂,放在玛瑙研钵中加15毫升0.1mol·L-1氢氧化钠及5毫升蒸馏水,共同研匀,用蒸馏水稀释至1升,用稀标准酸或标准碱溶液调整pH至6.4左右,贮存于棕色瓶中备用。
此指示剂的pH变色范围如下:PH 4.0 4.5 5.0 5.5 6.0 6.5 7.0 8.0颜色黄绿黄黄绿草绿灰绿灰蓝蓝紫紫(2)pH7-9混合指示剂:称取等量(0.25克)的甲酚红和百里酚蓝,放在玛瑙研钵中,加0.1 mol·L-1氢氧化钠11.93毫升,共同研匀,待完全溶解后再用蒸馏水稀释至1升,其变化范围如下:PH 7 8 9颜色橙黄橙红红紫3、操作步骤取土约0.5克(不必称重)置于白瓷比色盘的大穴中,用滴管滴入指示剂,至土样全部湿润并刚有液体流出为度,轻轻摇动,使指示剂与土壤混匀,静置1—2分钟,将上部清液引入另一小穴中,与标准比色卡片比较,读出土壤pH值。

基质(土壤)主要理化指标
1、土壤酸碱性及酸缓冲容量
活性酸PH(H﹢)
潜性酸PH(KCL)
缓冲容量-单位质量的土壤PH增加或降低一个单位所需酸或碱的量
影响因素:基础PH,阳离子交换量,有机质,原生矿物和次生矿物含量及风化过程,耕作方式,海拔高度,粘粒含量等影响。
样品处理:风干,磨细,过孔径1mm筛网
有机质测定方法:KCrO7-H2SO4外加热法
阳离子交换量(CEC):1mol/L乙酸铵交换法
交换性盐基总量:1mol/L乙酸铵交换法
盐基饱和度=盐离子交量-水解性总酸度/阳离子交换量*100%
PH(H﹢)测定:分别用H2O和KCL采用2.5:1水土比浸提,震荡1h后平衡1h,用pHs-3C型酸度计测定
交换性酸测定:采用1mol/L KCL交换-中和滴定法(交换性氢+交换性铝)
水解性总酸度:采用NH4OAc水解-中和滴定法(活性酸+交换性酸+可水解酸)
土壤酸缓冲曲线制作及酸缓冲容量的测定:
称取过1mm筛风干土样10g各16份,分别加入无CO2蒸馏水25mL,水土比为1:2.5,分别加入H﹢浓度为0.01mol/L的酸性溶液0,4,8,12…64mL,使土壤添加量分别为0,4,8,12…64mmol/kg,震荡1h后将溶液转入小烧杯中平衡1h,用pHs-3C酸度计测量个样品的PH,以酸加入量(mmol/kg)和土壤PH为坐标绘制土壤酸缓冲曲线,通过计算单位土壤PH降低一个单位所需的酸量最终得到土壤酸缓冲容量
2。


HJ 649-2013土壤可交换酸度。
方法验证本方法采用滴定法,依据HJ 649-2013土壤可交换酸度的测定标准进行测量。
实验所需仪器设备包括酸度计和电子分析天平。
具体分析步骤请参考HJ 649-2013标准中的8个分析步骤。
实验结果报告中,检出限按照HJ 168-2010规定检出限公式及HJ 649-2013中计算公式进行计算,得出可交换酸度及可交换氢的MDL为0.10mmol/kg,其中k=1;滴定管最小刻度为V=0.02ml;c=0.01mol/L;V=250mL;Vs=100mL;m1=5.g。
精密度测试数据中,取3个样品,按照步骤3分别做6次平行实验,计算结果、平均值、标准偏差并求出相对标准偏差和最大相对偏差。
其中可交换酸度数据见表1,可交换氢数据见表2.人员比对测试数据中,对同一样品6,两名实验员分别做3次可交换酸度平行实验,计算平均值,相对误差,检测结果见表3.信度高。
但是,由于实验员的操作技巧和实验条件的差异,可能会导致数据的误差。
因此,我们需要进行统计分析,以确定数据的可靠性。
为了提高数据的可信度,我们对同一样品进行了6次可交换氢平行实验,并由两名实验员分别进行了3次实验。
通过计算平均值,我们可以得到更加准确的结果。
然而,由于实验员的操作技巧和实验条件的差异,数据误差可能会出现。
因此,我们需要进行统计分析,以确定数据的可靠性。
我们采用了统计学方法来分析数据。
通过计算标准偏差和置信区间,我们可以确定数据的可靠性。
此外,我们还进行了t检验,以确定样品之间是否存在显著差异。
为了确定数据的可靠性,我们使用了统计学方法。
通过计算标准偏差和置信区间,我们可以确定数据的可靠性。
此外,我们还进行了t检验,以确定样品之间是否存在显著差异。
我们的实验结果表明,样品之间存在显著差异。
这表明,不同样品的化学成分可能存在差异,需要进一步研究。
此外,我们还发现,同一样品的实验结果存在一定的差异,这可能是由于实验条件或操作技巧的不同导致的。


酸性土壤交换性钙、镁测定方法的探讨
冯建军;陈丽芝;张玉珠
【期刊名称】《内蒙古农业科技》
【年(卷),期】2008(000)005
【摘要】通过对酸性土壤交换性钙、镁、钾、钠、速效钾和阳离子交换量不同提取方法和不同振荡时间的测定结果的比较分析,得出同一处理液(即2g土样加
50ml1N 乙酸铵振荡10min)可同时测定交换性钙、镁、钾、钠、速效钾和阳离子变换量,此方法与GB7865-87、GB7866-87、GB7856-87、GB7863-87测定结果无显著差异,且方法更加简单、快速,分析成本大大降低,极大地提高了工作效率,是在批量测试时值得推广的方法.
【总页数】2页(P76-77)
【作者】冯建军;陈丽芝;张玉珠
【作者单位】兴安盟科尔沁右翼中旗农业技术推广站,内蒙古,科右中旗,029400;兴安盟科尔沁右翼中旗农业技术推广站,内蒙古,科右中旗,029400;兴安盟科尔沁右翼中旗农业技术推广站,内蒙古,科右中旗,029400
【正文语种】中文
【中图分类】S151.93
【相关文献】
1.酸性、中性土壤交换性钙镁测定方法的探讨 [J], 刘雪鸿;王京平;陈万明;张桂明;谭衡
2.改良营养液对大棚酸性土壤交换性钙镁和有效态铜锰锌铁的影响 [J], 邓爱妮;周聪;赵敏;范琼
3.南方酸性土壤交换性钙、镁和钾测定方法的探讨 [J], 杨乐苏;于彬;王志香
4.土壤交换性钙和镁测定方法的改进研究 [J], 张思文;陈晓辉;童灵;张雪;王正;吴良泉;李学贤
5.不同类型农田土壤交换性钙镁测定方法的研究 [J], 赵玉婷;于鹏;祝贺鹏;贾成楠;赵云霞;邓万丽
因版权原因,仅展示原文概要,查看原文内容请购买。


土壤PH的测定电位法1、方法提要采用电位法测定土壤PH是将PH玻璃电极和甘汞电极(或复合电板)插入土壤悬液或浸出液中构成一原电池,测定其电动势值,再换算成PH值。
在酸度计上测定,经过标准溶液定值后则可直接读数取PH。
水土比例对PH值影响较大,尤其对于石灰性土壤稀释效应的影响更为显著。
以采取较小水土比为宜,本方法规定水土比为2.5:1。
同时酸性土壤除测定水浸土壤PH值外,还应测定盐浸PH值,即以1mol²L-1KCl溶液浸取土壤H+后用电位法测定。
2、适用范围本方法适用于各类土壤PH值的测定。
3、主要仪器设备3.1酸度计(精确到0.01PH单位):有温度补偿功能;3.2PH玻璃电级;3.3饱和甘汞电极(或复合电极),当PH大于10,须用专用电极;3.4搅拌器。
4、试剂4.1去除CO2的水:煮沸10min后加盖冷却,立即使用;4.2氯化钾溶液[c(KCL)=1mol²L-1]:称取74.6g KCl溶于800mL 水中,用稀氢氧化钾和稀盐酸调节溶液PH为5.5~6.0,稀释至1L;4.3PH4.01(25℃)标准缓冲溶液:称取经110~120℃烘干2~3h的邻苯二甲酸氢钾10.21 g溶于水,移入1L容量瓶中,用水定容,贮于聚乙烯瓶;4.4PH6.87(25℃)标准缓冲溶液:称取经110~130℃烘干2~3h的磷酸氢二钠3.533 g和磷酸二氢钾3.388 g溶于水,移入1L容量瓶中,用水定容,贮于聚乙烯瓶;4.5PH9.18 (25℃)标准缓冲溶液:称取经平衡处理的硼砂(Na2B4O7²10H2O)3.800g溶于无CO2的水中,移入1L容量瓶中,用水定容,贮于聚乙烯瓶;硼砂的平衡处理:将硼砂放在盛有蔗糖和食盐饱和水溶液的干燥器内平衡两昼夜。
5、分析步骤5.1仪器校准各种PH计和电位计的使用方法不尽一致,电极的处理和仪器的使用按仪器说明书进行。
将待测液与标准缓冲溶液调到同一温度,并将温度补偿器调到该温度值。

土 壤 (Soils), 2017, 49(6): 1210–1215①基金项目:重庆市博后资助项目(Xm2016076)和中央高校基本业务专项资金 (XDJK2016C191)资助。
作者简介:李忠意(1987—),男,四川宜宾人,博士,讲师,主要从事土壤化学研究。
E-mail :zhongyili@DOI: 10.13758/ki.tr.2017.06.021几种土壤交换性酸测定方法的效果比较①李忠意,白颖艳,程永毅,李 艳,杨剑虹(西南大学资源环境学院,重庆 400716)摘 要:为真实地反映酸性土壤交换性酸含量水平,探讨了KCl 淋溶法、BaCl 2淋溶法、NaAc 淋溶法、KCl-三乙醇胺(Triethanolamine ,TEA)提取法和BaCl 2-TEA 提取法对紫色土、黄壤、红壤和砖红壤4种土壤的交换性酸测定效果。
结果表明:5种方法测得的土壤交换性酸大小关系为:BaCl 2-TEA 提取法>KCl-TEA 提取法>NaAc 淋溶法>BaCl 2淋溶法>KCl 淋溶法。
BaCl 2淋溶法能较为真实地反映出土壤交换性酸水平,其次为KCl 淋溶法。
受土壤有机酸和铝氧化物的影响,NaAc 淋溶法、KCl-TEA 提取法和BaCl 2-TEA 提取法测得的土壤交换性酸含量偏高。
但由于尚无标准方法对测定结果进行验证,因此,还需进一步对土壤交换性酸测定方法及其影响因素开展研究。
关键词:交换性酸;BaCl 2淋溶法;有效阳离子交换量 中图分类号:S153.4 文献标识码:A土壤的发育过程即是土壤的自然酸化过程。
近年来,人类活动大大加速了土壤的酸化过程[1-3]。
如化石燃料产生的SO 2,汽车尾气产生的NO X 以及农业化肥施用对N 、S 循环的影响均会加速土壤的酸化过程[4-6]。
土壤酸化加速了土壤中养分离子尤其是盐基离子的淋失,土壤日益贫瘠,导致土壤结构退化,释放出有害的铝离子和其他重金属离子,降低土壤酶活性,使农作物减产、森林退化、污染地表和地下水[7-8]。

土壤pH的测定方法方法一:1.放一汤匙土壤于容器中馏水,搅拌至呈乳状;2.将其放置l~2个小时,再酌情加水,保持合适的粘稠度3.放张pH试纸于混合液中,1分钟后拿出,用蒸馏水冲去表面残渣;4.对照pH 比色卡,即可确定所测土壤pH 值;方法二:土壤pH的测定方法包括比色法和电位法。
电位法的精确度较高。
pH误差约为0.02单位,现已成为室内测定的常规方法。
野外速测常用混合指示剂比色法,其精确度较差,pH误差在0.5左右。
(一)混合指示剂比色法1、方法原理:指示剂在不同pH的溶液中显示不同的颜色,故根据其颜色变化即可确定溶液的pH。
混合指示剂是几种指示剂的混合液,能在—个较广的pH范围内,显示出与一系列不同pH相对应的颜色,据此测定该范围内的各种土壤pH。
2、操作步骤:在比色瓷盘孔内(室内要保持清洁干燥,野外可用待测土壤擦拭),滴入混合指示剂8滴,放入黄豆大小的待测土壤,轻轻摇动使土粒与指示剂充分接触,约1分钟后将比色盘稍加倾斜用盘孔边缘显示的颜色与pH比色卡比较,以估读土壤的pH。
3、混合指示剂的配制:取麝草兰(T.B)0.025克,千里香兰(B.T.B)0.4克,甲基红(M.R)0.066克,酚酞0.25克,溶于500ml 95%的酒精中,加同体积蒸馏水,再以0.1molL-1 Na0H调至草绿色即可。
pH比色卡用此混合指示剂制作。
(二)电位测定法1、方法原理:以电位法测定土壤悬液pH,通用pH玻璃电极为指示电极,甘汞电极为参比电极。
此二电极插入待测液时构成一电池反应,其间产生一电位差,因参比电极的电位是固定的,故此电位差之大小取决于待测液的H+离子活度或其负对数pH。
因此可用电位计测定电动势。
再换算成pH,一般用酸度计可直接测读pH。
2、操作步骤:称取通过1mm筛孔的风干土10克两份,各放在50ml的烧杯中,一份加无C02蒸馏水,另一份加1molL-1 KCl溶液各25ml(此时土水比为1:2.5,含有机质的土壤改为1:5),间歇搅拌或摇动30分钟,放置30分钟后用酸度计测定。
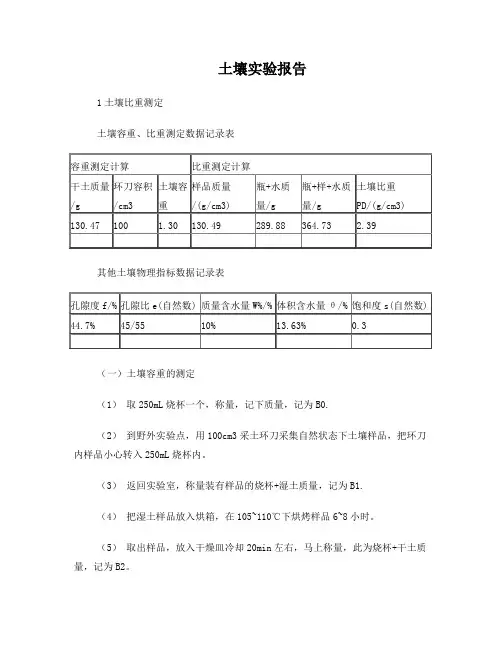
土壤实验报告1土壤比重测定土壤容重、比重测定数据记录表其他土壤物理指标数据记录表(一)土壤容重的测定(1)取250mL烧杯一个,称量,记下质量,记为B0.(2)到野外实验点,用100cm3采土环刀采集自然状态下土壤样品,把环刀内样品小心转入250mL烧杯内。
(3)返回实验室,称量装有样品的烧杯+湿土质量,记为B1.(4)把湿土样品放入烘箱,在105~110℃下烘烤样品6~8小时。
(5)取出样品,放入干燥皿冷却20min左右,马上称量,此为烧杯+干土质量,记为B2。
(6)计算土壤容重土壤容重(BD,g/cm3)==式中,M为干土重量(g),V为采土环刀容积(cm3).(7)将数据记录到表中。
(二)土壤比重的测定(1)记下容重测定时的获得的干土质量,记为M0.(2)取180mL塑料瓶瓶一个,小心注满自来水,拧紧瓶盖,用吸水毛巾吸干瓶外水滴,称量,记为M1.(3)把水倒掉约2/3,保留1/3,把容重测定完成后的干土样品倒入陶瓷研钵中,捣碎土块,研磨样品至细颗粒或粉状,把样品装入180mL塑料瓶中,再注入自来水至刚没过样品面,拧紧瓶盖,用力摇动塑料瓶,使全部被水饱和,最后加满水,拧紧瓶盖,吸干瓶外水滴,称量,记为M2。
(4)计算土壤比重土壤比重(PD,g/cm3)=M/[(M+M-M)/ρ水]式中,M为干土重量(g);M1,M2为操作步骤介绍;ρ水为水的密度,1g/cm3(mL).(三)其他土壤物理指标计算(1)土壤孔隙度f=×100%=(1-)×100%(2)土壤孔隙比e==(3)质量含水量(即土壤水分含水量)W=×100(4)容积含水量θ==W×BD(%)(5)饱和度s==2土壤机械组成测定比重计读数温度校正粒级组成/%样品编号b1 b2 悬液温度温度校正值砂砾粉粒黏粒①22 14 25 1.8 27 8 15(一)土壤机械组成测定(1)制备悬液柱。
将50g样品全部洗入1000mL,为土壤悬液柱,用于测定悬液比重。
土壤交换性酸的测定氯化钾交换——中与滴定法1 方法提要:用1 mol·L-1氯化钾溶液淋洗土壤时,土壤永久负电荷引起的酸度(无机胶体吸附的H+与Al3+)被K+交换进入溶液,用氢氧化钠标准溶液直接滴定浸出液所得结果为交换性酸总量。
另取一份浸出液,加入足量的氟化钠溶液,使Al3+形成络离子,防止其水解,再用氢氧化钠标准溶液滴定,所得结果为交换性H+,两者之差为交换性Al3+。
2 适用范围:本方法适用于酸性土壤交换性酸的测定。
3 主要仪器设备:半微量碱式滴定管:10mL。
4 试剂:4、1 氯化钾溶液[c(KCl)=1 mol·L-1]:称取74、6g氯化钾溶于800mL水中,用稀氢氧化钾与稀盐酸调节溶液pH为5、5~6、0,稀释至1L;4、2 氟化钠溶液[ρ(NaF)=35g·L-1]:称取氟化钠3、5g溶于80mL无C02水中,以酚酞为指示剂,用稀氢氧化钠溶液或稀盐酸溶液调节到微红色(pH8、3),再稀释至100mL,存于聚乙烯瓶;4、3 氢氧化钠标准溶液[c(NaOH)=0、02 mol·L-1]:称取NaOH约0、8g,溶于1000mL无CO2水中,用邻苯二甲酸氢钾标定浓度;4、4 酚酞指示剂(5g·L-1):称取0、5g酚酞溶于95%乙醇并以其稀释至100mL;4、5盐酸溶液(1:3):1份盐酸与3份水混合;4、6 硫氰化钾水溶液[ρ(KSCN)=10g·L-1]:称取1g硫氰化钾溶于100mL水中。
5 分析步骤称取过2mm孔径筛的风干试样5、00g放在已铺好滤纸的漏斗内,用1 mol·L-1氯化钾溶液少量多次地淋洗,滤液承接在250mL容量瓶中,至近刻度,用1 mol·L-1氯化钾溶液定容。
吸取滤液100mL于250mL三角瓶中,煮沸5min,赶走CO2,加入酚酞批示剂5滴,趁热用0、02 mol·L-1氢氧化钠标准溶液滴定至微红色。
南京农业大学专业:农业机械化及其自动化姓名:XXX学号:XXXXXXXX班级:农机XX班教师:XX酸性土壤的研究与改良XXX(南京农业大学工学院,浦口区点将台路40号,农机系,农业机械化及其自动化专业,10级XX班,学号XXXXXXXXX,邮编210031)摘要:随着经济的飞速发展,人们生活水平不断提高,农业再次进入当今世界各国的视野。
中国作为一个农业大国,人们对土壤农业的关注度也越来越高。
我国热带、亚热带地区,广泛分布着各种红色或黄色土壤的酸性土壤。
土壤过酸会不同程度地降低土壤养分的有效性,不利于土壤的良性发育,甚至破坏土壤结构,危害土壤微生物的活动,并易产生各种有毒害的物质。
因此,解决酸性土壤的不利影响是现今农业科技的一个重大课题,使人们不得不重新重视关于酸性土壤的研究,并寻找多种改良方法。
而且酸性土壤在世界范围内分布广泛,在农业生产中占有重要地位。
关键词:酸性土壤;pH;土壤改良;酸化;水解性酸Microsoft jas black acidic soil research and improvementXXX(nanjing agricultural university institute of technology, the 9th about road no. 40, NongJiXi, agricultural mechanization and its automation major, 10 grade XX classes, student id, XXXXXXX zip code 210031).Abstract: with the rapid development of economy, people living standard unceasing enhancement, agriculture again come into view in all countries in the world today. As an agricultural country, China people's attention to agricultural soil is becoming more and more high. Tropical and subtropical areas in China . Which are widely distributed in acidic soil of various kinds of red or yellow soil. Too much acid soil will reduce the effectiveness of soil nutrient in different degrees, is not conducive to the benign development of soil and even destroys the soil structure, soil microbial activity, and is easy to produce various poison material. Therefore, to solve the negative impact of the acidic soil is an important subject in the agricultural science and technology today, forcing people to refocus on research on acid soil, and looking for a variety of improved methods. And acidic soil are widely distributed throughout the world, occupies an important position in agricultural production.Key words: acid soil; PH; Soil improvement; Acidification; Acid hydrolysis of sex.0 引言酸性土壤是pH值小于7的土壤总称。
土壤酸性土交换性酸的测定和阳离子交换性能的测定简述实验目的与意义土壤交换性盐基成分是指交换性Ca2+、Mg2+、K+、Na+等,NH4+、Zn2+、Cu2+等也常以交换态存在,但因其数量极少,通常〈0。
03cmol(+)/kg,因而没有计入交换性盐基.测定交换性盐基成分的意义和必要性是因土而异的。
酸性土壤中,交换性Ca2+的含量是影响植物根际营养的重要元素,同时这些交换性盐基成分实际上也是作物所必需的营养元素,因而,在培养土壤肥力上具有重要意义。
一般测定交换性盐基成分都以1mol/LNH4Ac作为交换剂;中性和酸性土用pH7NH4Ac:石灰性土或碱性土用pH9的NH4Ac-NH4OH;盐土则用乙醇洗去游离盐分后再用pH9的NH4Ac—NH4OH醋酸铵交换。
本次实验测定酸性土交换性阳离子盐基成分,以pH7,1mol/LNH4Ac作为交换剂进行测定。
土壤交换性酸是指土壤酸性表现的强弱程度。
土壤交换性酸又称为“土壤潜在(性)酸”,它由胶体所吸附的H+和Al3+构成。
Al3+因水解作用产生H+,因此,又称为“水解(性)酸”。
Al3++3H2O→Al(OH)3+3H+土壤交换性H+、Al3+含量多少,在一定程度上体现了土壤矿物胶体化学风化程度的深浅和土壤淋溶作用的强弱。
而交换性H+和Al3+在土壤中的转化关系经实验证明土壤pH值≤5.5时,才会有水解性酸存在,也就是说,只有相当量的交换性H+存在时,才有交换性Al3+的出现。
但对于强酸性土壤来说,交换性Al3+是占主导地位的。
一、酸性土交换性阳离子盐基成分的测定1.实验原理(1)土壤样品的交换处理用pH7、1mol/LNH4Ac作为交换剂处理土壤,土壤的交换性阳离子与交换剂中指示性阳离子(NH4+)实现交换平衡,交换反应式如下:土粒[Ca2+、Mg2+、K+、Na+]+nNH4Ac→土粒[6 NH4+]+(n-6)NH4Ac+(Ca2+、Mg2+、K+、Na+)若不断将交换出来的溶液分离开来,并加入新的交换剂。
第四节土壤的酸碱反应土壤酸碱性是指土壤溶液的反应(soil reaction),它反映土壤溶液中H+浓度和OH-浓度比例,同时也决定土壤胶体上致酸离子(H+或Al3+)或碱性离子(Na+)的数量及土壤中酸性盐和碱性盐类的存在数量。
一、土壤的酸性土壤酸性,一方面与溶液中H+、Al3+浓度相关,另一方面更多的是与土壤胶体上吸附的致酸离子(H+或Al3+)有密切关系。
两者在一定条件下可互相转化,一般依其存在的方式将土壤酸度分为两种类型。
(一)土壤的活性酸度是由土壤溶液中的氢离子所引起的酸度。
活性酸度土壤中酸性的主要来源是:胶体上吸附的H+或Al3+、CO2溶于水所形成的碳酸、有机质分解产生的有机酸、氧化作用产生少量无机酸、以及施肥加入的酸性物质等。
常用pH值表示,即溶液中氢离子浓度的负对数。
土壤酸碱性主要根据活性酸划分——酸度分级:〈5 5.0-6.5 6.6-7.5 7.6-8.5 >8.5我国土壤pH一般在4~9之间。
在地理分布上由南向北pH逐渐增加,大致以长江为界。
长江以南的土壤为酸性和强酸性,长江以北的土壤多为中性或碱性,少数为强碱性。
(二)土壤的潜性酸度指土壤胶体上吸附的H+或Al3+、Al(OH)2+、Al(OH)2+、Al(OH)2.50.5+所造成的酸性。
因为它们进入溶液后才会显示出酸性,所以称之为潜性酸,常用1000克烘干土中氢离子的厘摩尔数表示。
潜性酸与活性酸的动态平衡:潜性酸可分为两类:1.交换性酸用过量中性盐(氯化钾、氯化钠等)溶液,与土壤胶体发生交换作用,土壤胶体表面的氢离子或铝离子被侵提剂的阳离子所交换,使溶液的酸性增加。
测定溶液中氢离子的浓度即得交换性酸的数量。
用中性盐溶液浸提而测得的酸量只是土壤潜性酸量的大部分,而不是它的全部。
2.水解性酸用过量强碱弱酸盐(CH3COONa)浸提土壤,胶体上的氢离子或铝离子释放到溶液中所表现出来的酸性。
CH3COONa水解产生NaOH,pH值可达8.5,Na+可以把绝大部分的代换性的氢离子和铝离子代换下来,从而形成醋酸,滴定溶液中醋酸的总量即得水解性酸度。
酸性土壤交换性钙,镁测定方法的探讨
植物微量元素测定技术在农业生产中有着重要的意义,其中,探讨酸性土壤交换性钙、镁测定方法特别重要。
首先,我们需要对酸性
土壤中的交换性钙、镁测定过程进行深入研究。
交换性钙和镁的检测方法可以采用重量法及动力学滴定法。
重量
法是一种简单、低成本的检测方法,定量测定的范围均比较宽,能够
检测10μg/g以上浓度的指标。
但是,它可能会影响水解反应,从而影响结果的准确性。
另一种方法是动力学滴定法,它能够检测低于10μg/g的指标,
结果也更加准确可靠。
但是,这种法需要耗费更多的时间,同时成本
要比重量法更高。
准确准确地测定出酸性土壤中的交换性钙、镁,有助于农业生产
的提高,也有助于改善土壤的质量。
因此,应加强对酸性土壤的研究,寻求出一种可以快速准确地测定出交换性钙和镁的方法。
土壤交换性酸度方法验证报告酸雨污染是当前全球性的环境问题之一。
在酸雨对生态环境的影响中,土壤酸化是中心环节。
因为土壤的酸缓冲性能反映了土壤的酸敏感性,而土壤的酸敏感性决定了土壤的酸化趋势,所以研究土壤酸化,预测土壤酸化趋势,应当同时研究土壤的酸缓冲性能和酸敏感性。
湖南省由于特定的地形、气象条件以及以煤炭为主的能源结构而成为全国严重酸雨区之一;同时湖南省土壤类型中,大多数属于酸性较强的富铁土,酸敏感性较高,易于遭受酸害。
因此,研究湖南土壤酸缓冲性能和酸敏感性,预测湖南土壤酸化趋势,进行湖南土壤生态系统酸相对敏感性研究,既是土壤科学和环境科学研究的重要课题,又可以为湖南酸雨控制区的合理规划和酸雨污染的针对性治理,为湖南农业的可持续发展和生态环境保护提供科学依据。
本文主体分为三个部分,第一部分是衡山土壤酸化研究。
首先选取衡山不同垂直带谱上5个代表性地点不同年代的土壤样品,通过实验分析得出,衡山土壤酸度时空变化明显。
从1983年到2001年,衡山土壤酸度变化主要表现在:土壤pH值降低,交换性酸度和活性酸度增加,交换性盐基离子减少,盐基饱和度降低,其中交换性酸增加量同其它各变化量之间存在着一定的相关性。
衡山土壤酸度变化表明衡山土壤有明显的酸化趋势。
其次,为客观地预测衡山土壤酸化趋势,本文在分析国内应用较多的土壤酸化趋势预测方法的基础上,提出利用酸缓冲曲线定性地分析土壤的酸化趋势,利用土壤酸害容量和土壤酸害容量年降低率定量地预测土壤的酸化年限,第一次提出了土壤酸害容量年降低率这一概念。
运用这一方法,通过实验测定,分析衡山土壤酸缓冲能力的时空变化,得出衡山土壤酸化年限和土壤酸化特点:lI①衡山不同土壤以及同一土壤不同层次酸化进程有快有慢;②衡山土壤酸化是一个由表及里的过程。
最后,在衡山土壤酸化研究基础上提出土壤酸害容量是一个理想的土壤酸敏感性评价指标,并通过相关分析,得出土壤酸害强度也是一个相对理想的酸敏感性指标,而土壤阳离子交换量、盐基饱和度、酸害偏差等作为我国南方土壤酸敏感性指标并不恰当。
土壤交换性酸的测定(1mol·L- 1KCl交换—中和滴定法)
测定目的:土壤中的酸包括活性酸和潜性酸,活性酸通常通过电极法就可以测出,潜性酸的测定则需要经过阳离子的置换作用来测定。
常用的方法有通过中性溶液(1mol·L- 1KCl)平衡交换和中性NH4OAc 法。
本实验采用中性的KCl溶液测定,经过测定可以得出土壤中交换性铝(1/3Al3+)、交换性H+的含量以及交换性酸总量,了解土壤的酸度以及耐酸碱的缓冲能力。
在农业生产中指导施肥和调节土壤pH具有重要的意义。
1、方法原理
在酸性土壤中,土壤胶体上可交换的H+及铝在用KCl淋洗时,为H+交换而进入溶液。
同时可溶解的有机胶体及有机胶体上可交换的氢亦随淋洗而进入溶液。
当用标准NaOH溶液滴定浸出液时, H++ OH-→H2O RCOOH +OH-→ RCOO- + H2O Al(OH)n+3-n + nOH-→ Al(OH)3
从标准NaOH消耗量可以得到交换酸的含量。
若浸出液中另取一份溶液加入足够量的NaF时,氟离子与铝络合成[AlF6]3-,它对酚酞是中性的。
制止了AlCl3水解之后,再用标准NaOH溶液滴定,所消耗碱的量即为交换性氢,两者之差即为交换性铝。
2、溶液配制
(1)1 mol·L-1氯化钾溶液:称取KCl 74.6g,用蒸馏水溶解并稀释至1000mL。
(本次试验土样为20个,大概需要溶液的量为:20*2*250=10L,鉴于空白和可能产生一些浪费,配制12L溶液装于容器中,并贴好标签)
(2)0.02 mol·L-1标准碱(NaOH):称取NaOH约0.8g,溶于1000mL无CO2蒸馏水中。
用邻苯二甲酸氢钾标定浓度。
(配制前要准备好去CO2蒸馏水,冷却后再定容滴定,滴定好后记录下浓度,贴上标签)
(3)10g·L-1酚酞:称取酚酞1g,溶于100mL乙醇中。
(4)35g·L-1NaF溶液:称取NaF(化学纯)3.5g溶于80mL无CO2水中,以酚酞为指示剂,用稀NaOH或HCl 调节到微红色(pH8.3)稀释至100mL贮于塑料瓶中。
(在调节pH过程中药注意调节颜色的变化,可先用NaOH调到红色刚刚褪去,再用HCl反调)
3、操作步骤
(1)滤液的制备:称取风干土样(10目)5.00g放在已铺好滤纸的漏斗内,漏斗下放置已经编号的250mL 容量瓶→将1mol·L-1KCl溶液倒入小烧杯,再沿边缓缓倒入漏斗,少量多次地淋洗土样(第一次尽量滤
干)→滤液在容量瓶中至近刻度时用1 mol·L-1KCl溶液定容→盖好塞子摇匀待用。
(空白除不称土样在漏斗中,其余处理一样)
(2)滴定:吸取摇匀后的滤液100mL于250mL三角瓶中→在高温电炉上煮沸5分钟赶出CO2→加入酚酞指示剂5滴→趁热用0.02 mol·L-1NaOH标准溶液滴定至微红色,记下NaOH用量(V1)。
另一份100mL滤液于250mL三角瓶中→煮沸5分钟,赶去CO2→趁热加入约lmL 35g·L-1NaF溶液→稍冷却后加入酚酞5滴→用0.02 mol·L-1 NaOH标准溶液滴定至微红色,记下NaOH用量(V2)。
测定空白,分别记录NaOH用量(V 0和V 0′)。
4、计算
计算公式
土壤交换性铝(1/3Al3+,cmol·kg-1) =Q+,A–Q +,H+
土壤交换性酸总量(Q+,A ,cmol·kg-1)= (V1-V 0)c×分取倍数/m ×100
土壤交换性H+(Q+,H+,cmol·kg-1) = (V 2-V 0′)c×分取倍数/m ×100
式中:c —— NaOH标准溶液的浓度, mol·L-1;
分取倍数——250/100=2.5;
m——烘干土样质量,g。
本次试验配制的NaOH标准溶液的浓度为0.0196 mol·L-1,空白用量V 0=0
所以土壤交换性酸总量=V1×0.0196×2.5/5.00×100 cmol/Kg
土壤交换性H+ =V 2×0.0196×2.5/5.00×100 cmol/Kg
土样编
号
交换性酸
用碱量ml
含量
(cmol/kg)土样编号
交换性H
用碱量
含量
(cmol/kg)
HNPKM-1 1 1.05 1.03 HNPKM-1 1 0.50 0.49 HNPKM-3 2 1.05 1.03 HNPKM-3 2 0.50 0.49 HNPKM-5 3 1.10 1.08 HNPKM-5 3 0.50 0.49 HNPK-1 4 1.45 1.42 HNPK-1 4 0.55 0.54 HNPK-2 5 1.50 1.47 HNPK-2 5 0.60 0.59 HNPK-3 6 1.50 1.47 HNPK-3 6 0.60 0.59 HNPKR2-1 7 0.00 0.00 HNPKR2-1 7 0.00 0.00 HNPKR2-2 8 0.00 0.00 HNPKR2-2 8 0.00 0.00 HNPKR2-3 9 0.00 0.00 HNPKR2-3 9 0.00 0.00
5、注意事项
(1)称量前要用称量勺将土样混匀再舀出。
(2)淋洗250mL已可把交换性氢、铝基本洗出来,若淋洗体积过大或时间过长,有可能把部分非交换酸洗出。
(3)在滴定前的加热除CO2时,要注意不要把手烫伤。
(4)滴定过程中要注意颜色控制,
(2)NaF溶液用量应根据计算取用:35g·L-1 NaF加入量(mL)= V×c×6/(0.85×3 )本次试验约1mL即可。