蛋白质折叠优秀课件
- 格式:ppt
- 大小:1.31 MB
- 文档页数:144



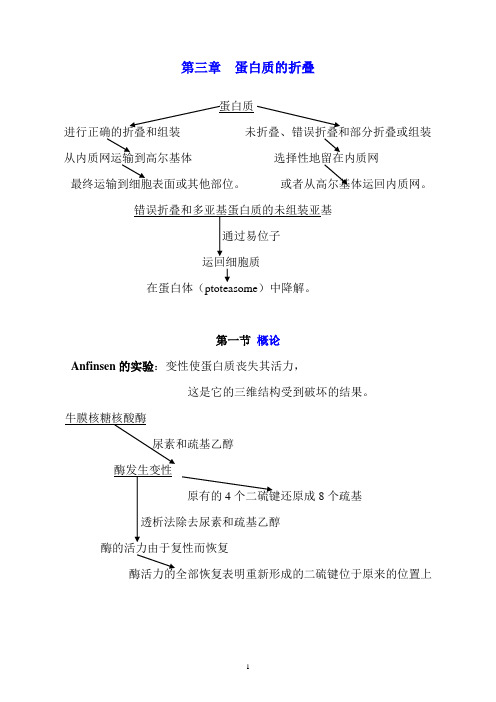
第三章蛋白质的折叠进行正确的折叠和组装未折叠、错误折叠和部分折叠或组装从内质网运输到高尔基体选择性地留在内质网最终运输到细胞表面或其他部位。
或者从高尔基体运回内质网。
运回细胞质在蛋白体(ptoteasome)中降解。
第一节概论Anfinsen的实验:变性使蛋白质丧失其活力,这是它的三维结构受到破坏的结果。
原有的4个二硫键还原成8个疏基酶的活力由于复性而恢复结论:aa排列顺序决定特定的空间结构;天然三维结构得到重新建立,它是多肽链自发折叠的结果。
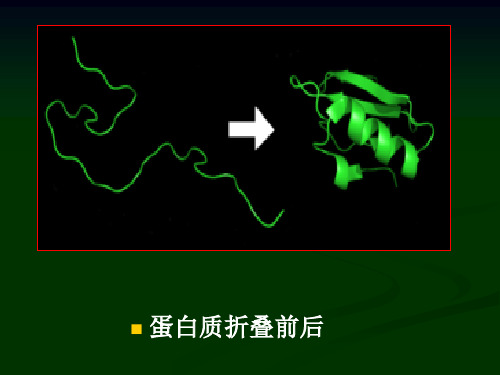
折叠形成正确的三维空间结构才可能具有正常的生物学功能。
如果折叠在体内发生故障, 形成错误的空间结构;不但将丧失其生物学功能, 甚至会引起疾病。
异常的三维空间结构引发折叠病:疯牛病、老年性痴呆症、囊性纤维病变、家族性高胆固醇症、家族性淀粉样蛋白症、某些肿瘤、白内障等等。
那么,【问题】aa顺序能否代表着功能 ? ? ?多肽链的aa顺序并不能直接表现出功能,功能只是多肽链折叠成特定的三维结构后才出现的,但多肽链的aa包含了它折叠全部信息。
蛋白质折叠的研究(图)的应用价值未折叠状态 U中间状态I天然构象N狭义的定义研究蛋白质特定三维空间结构形成的规律、稳定性和与其生物活性的关系。
“aa顺序决定蛋白空间结构”原则核糖体上释放的多肽链,按照一级结构中aa侧链的性质,自主卷曲,形成一定的空间结构。
过去观点蛋白质空间结构的形成靠其一级结构决定,不需要另外的信息。
近来发现细胞内蛋白质正确装配都需“分了伴娘”蛋白帮助才能完成。
贡献:对新生肽段能够自发进行折叠的新发现从根本上修正了传统的概念。
归功于X射线、晶体衍射和各种波谱技术以及电子显微镜技术等。
尤其是NMR(核磁共振)用于研究蛋白质,能极为详细的研究蛋白质分子的动力学,即动态的结构或结构的运动与蛋白质分子功能的关系。
NMR技术已经能够在秒到皮秒的时间域上观察蛋白质结构的运动过程:包括:主链和侧链的运动;在各种不同的温度和压力下蛋白质的折叠和去折叠过程。
