急性、慢性和亚慢性毒性实验
- 格式:docx
- 大小:9.96 KB
- 文档页数:3

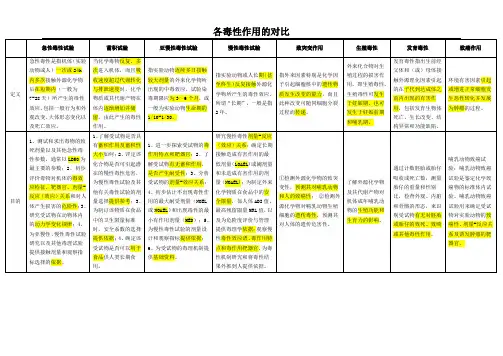
急性毒性试验一经典的急性致死性毒性试验通过试验得到化合物引起动物死亡的剂量—反应关系并求得LD50LC501、实验动物常用的实验动物是小鼠或大鼠;一般受试动物应是雌、雄各半;若雌、雄动物对待测化学物毒性的敏感程度有明差异,则应分别求出各自的LD50;如果试验是为畸形试验做剂量准备,也可仅做雌性动物的LD50试验;小动物每组10只,狗等大动物可每组6只;2、染毒剂量设计首先要了解化学毒物的结构式、分子量、常温常压下的状态、纯度、杂质成分与含量、溶解度、挥发度、PH等理化性质;对于新的受试化学物,找出与受试化学毒物结构与理化性质近似的化学物的毒性资料,并以文献资料中相同的动物种系和相同接触途径所测得的LD50LC50值作为受试化学物的预期毒性中值,先用少量动物,以较大的剂量间隔一般按几何级数染毒,找出找出10%~90%或0%~100%的致死剂量范围,然后在这个剂量范围内设几个剂量组;改良寇氏法最好设5个剂量组,每组10只动物,雌雄各半,剂量组要求以等比级数设置;根据以下公式计算出剂量分组:i=lgLD90-lgLD10/n-1 或:i=lgLD100-lgLD0/n-1式中i为组距相邻的两个剂量组对数剂量之差;n为设计的剂量组数;有的毒性较小,此时可不再求其LD50,而应进行限量试验;在用大鼠或小鼠进行试验时,一般用20只动物,雌雄各半;单次染毒剂量一般限定为5g/kg体重,对于食品毒理学试验,限量要求为15g/kg体重;如果实验动物无死亡或仅有个别动物死亡死亡率低于50%,则可得出LD50大于限量的结论;3、观察染毒后一般要求观察14天,依据14天内动物的总死亡情况计算LD50;在实际工作中,依据受试物有关测试规程要求确定观察期的长短;观察内容包括:(1)动物死亡情况:包括动物死亡数及各自的死亡时间;(2)动物体重:于染毒前、染毒后每周和死亡时测定体重;(3)中毒反应症状:临床观察每天至少一次,观察皮肤、被毛、眼睛和粘膜改变,呼吸、循环、自主和中枢神经系统以及四肢活动和行为方式的变化等,特别要注意有无震颤、惊厥、腹泻、嗜睡等现象;神经毒性:惊厥、共济失调和死亡;植物神经兴奋:腹泻或竖毛;(4)病理学检查:解剖进行尸检,观察各器官有无改变,对肉眼观察有变化的脏器需进行组织病理学检查;4、LD50计算(1)霍恩氏法(2)简化寇氏法M = X – iΣp –式中: m— log LD50,X—最高剂量组剂量对数值,p—死亡率用小数表示,Σp—死亡率总和,i—相邻两组剂量对数之差;3直接回归法:死亡频率呈正态分布,则变化曲线为典型的“钟罩”型;死亡频率化为累积死亡频率,反应曲线呈S形;累积死亡频率化为概率单位时,反应曲线呈直线;二急性毒性试验的其他方法1.固定计量法2.急性毒性分级法3.上、下移动法亚慢性毒性和慢性毒性的评价方法1、实验动物要求选拔两种实验动物,一种为啮齿类,首选是大鼠,另一种为非啮齿类,首选是狗;亚慢性毒性试验一般每个剂量组20只大鼠,或每组4~6只狗;慢性毒性试验每组40只大鼠,狗每组8只或以上;2、染毒途径常用的染毒途径是经胃肠道、经呼吸道和经皮肤染毒;3、染毒期限工业毒理学—— 3-6个月食品毒理学—— 6个月-1年环境毒理学—— 6个月-1年致癌试验——接近或等于动物的预期寿命4、剂量分组1亚慢性毒性的剂量选择:阴性对照组,低剂量组,中剂量组,高剂量组急性毒性的阈剂量:1/20~1/5 LD50组距:3~10倍,最低不小于2倍2慢性毒性的剂量选择阴性对照组,低剂量组,中剂量组,高剂量组亚慢性阈剂量:1/50~1/5LD50组距:2~5倍,最低不小于2倍5、观察指标(1)中毒症状行为和外观(2)体重:每周称量一次(3)食物利用率试验动物每食入100g饲料所增长的体重克数4实验室检查1血液学检查2尿液检查3血液生化学检查5病理及病理组织学检查对濒死动物进行解剖;试验结束及恢复期结束时,活杀实验动物;1系统解剖:消化道、肺、肝、肾、淋巴腺、眼、皮肤等,记录有无肉眼可见的异常变化;2脏器系数:是指某个脏器质量与体重的比值,又称脏体比值;常以100 g体重或1g体重计;需称量脏器湿重并计算其脏器系数;3组织病理学检查6特异性指标6、结果分析:选择适当的统计学方法进行各剂量组与阴性对照组的比较;。


保健食品安全性毒理学评价试验的四个阶段和内容发布日期:2021-04-03浏览次数:1605字号:[大中小]毒理试验的四个阶段和内容1第一阶段:急性毒性试验口服急性毒性:LD50,联合急性毒性,一次性最大耐受性受量试验。
二阶段II:遗传毒性试验,30天喂养试验,传统畸试验遗传毒性试验的组合应考虑原核和真核细胞的结合原理,体内试验和体外试验。
来自Ames试验或V79/HGPRT基因突变试验、骨髓细胞微核试验或哺乳动物骨髓细胞染色体畸变试验、4.1.2.3或4.1.2.4试验别各选一项。
2.1基因突变试验:首选鼠伤寒沙门氏菌/哺乳动物微粒体酶试验(Ames试验),其次是V79/HGPRT基因突变试验,必要时可另选其它试验。
2.2骨髓细胞微核试验或哺乳动物骨髓细胞染色体畸变试验。
2.3tk基因突变试验。
2.4小鼠精子畸形分析或睾丸染色体畸变分析。
2.5其它备选遗传毒性试验:显性致死试验、果蝇伴性别隐性致死试验,非程序DNA合成试验。
2.630天喂养试验。
2.7传统致畸试验。
三第三阶段:亚慢性毒性试验-90天喂养试验和繁殖试验殖试验、代谢试验四第四阶段:慢性毒性试验(包括致癌试验)1、药物的毒性试验分为两类,其一特殊毒性试验,包含致癌、致残、致突变,号称三致试验;作此试验的单位必须是国家指定并认可的;一般单位即使做了也不被国家认可!通常一类创新药必须做的。
无论一个药物的药效如何好,只要含有三致试验的特殊毒性(动物若干代繁殖后,查看),该药物将不会允许上市的。
2、其二,一般毒性试验,通常用老鼠或兔子去做,主要是测定半数致死量;若某个药物的半数致死量是有效使用剂量的2倍以上,通常认为是临床使用安全的,若半数致死量比有效剂量略大一点,那就谁也不敢使用了,万一略微超一点量就会导致患者死亡!。

药理毒理学实验
药理毒理学实验是指研究药物对机体生理和病理过程的影响以及药物的毒性和安全性的实验研究。
这些实验常用于药物的开发、评价和监管。
药理学实验常包括以下方面的研究:
1. 药物在体内的吸收、分布、代谢和排泄过程;
2. 药物对生理系统和器官的作用机制和效应;
3. 药物对生理参数(如血压、心率、血糖等)的影响;
4. 药物的药效学研究,如测定最小有效剂量、最大耐受剂量等。
毒理学实验主要研究药物对机体引起的毒性反应,包括急性毒性、慢性毒性和亚慢性毒性等。
常用的毒理学实验包括:
1. 急性毒性实验:用于确定药物对动物的一次性剂量引起的毒性反应;
2. 慢性毒性实验:用于评估长期接触药物对动物的毒性效应;
3. 亚慢性毒性实验:用于评估中长期接触药物对动物的毒性效应;
4. 各种毒性指标的测定,如致死剂量、半数致死剂量、致畸性、致癌性等。
药理毒理学实验通常在动物模型中进行,常用的动物包括小鼠、大鼠、猴等。
实验设计需要符合伦理规范,并进行必要的安全措施,以确保实验过程安全且可靠。
值得注意的是,药理毒理学实验虽然可以提供药物效果和毒性的初步评估信息,但实验结果在转化到人类临床应用方面仍需要进行更进一步的研究和验证。


第1篇一、实验目的本研究旨在通过动物安全药理实验,对某新型药物进行安全性评价,包括急性毒性、亚慢性毒性、慢性毒性以及遗传毒性等方面,为该药物的临床应用提供科学依据。
二、实验材料1. 实验动物:健康昆明小鼠,体重18-22g,雌雄各半。
2. 药物:某新型药物,纯度≥98%,由某制药企业提供。
3. 试剂与仪器:生理盐水、苦味酸、戊巴比妥钠、注射器、灌胃针、电子天平、手术剪、止血钳、平皿、托盘、烧杯等。
三、实验方法1. 急性毒性实验(1)实验分组:将实验动物随机分为5组,每组10只,分别为对照组、低剂量组、中剂量组、高剂量组和最大耐受量组。
(2)给药方式:除对照组外,其他各组分别灌胃给药,剂量分别为0.5、1.0、2.0、4.0g/kg体重。
(3)观察指标:观察实验动物在给药后24小时内出现的死亡、中毒症状及体征。
2. 亚慢性毒性实验(1)实验分组:将实验动物随机分为5组,每组10只,分别为对照组、低剂量组、中剂量组、高剂量组和最大耐受量组。
(2)给药方式:除对照组外,其他各组分别灌胃给药,剂量分别为0.5、1.0、2.0、4.0g/kg体重,连续给药90天。
(3)观察指标:观察实验动物在给药期间及停药后30天内出现的死亡、中毒症状及体征,并进行血液学、血液生化、脏器系数等指标检测。
3. 慢性毒性实验(1)实验分组:将实验动物随机分为5组,每组10只,分别为对照组、低剂量组、中剂量组、高剂量组和最大耐受量组。
(2)给药方式:除对照组外,其他各组分别灌胃给药,剂量分别为0.5、1.0、2.0、4.0g/kg体重,连续给药6个月。
(3)观察指标:观察实验动物在给药期间及停药后30天内出现的死亡、中毒症状及体征,并进行血液学、血液生化、脏器系数、病理学等指标检测。
4. 遗传毒性实验(1)实验分组:将实验动物随机分为2组,每组10只,分别为实验组(给药组)和对照组。
(2)给药方式:实验组灌胃给药,剂量为2.0g/kg体重,连续给药90天。



毒理学实验毒理学实验是一项重要的科学研究方法,用于评估化学物质对生物体的毒性。
通过实验可以了解化学物质对人体的潜在危害以及其对环境的影响,从而制定相应的防护措施和规定。
本文将介绍毒理学实验的基本原理、常见的实验设计和评估方法,并探讨其在毒理学研究中的应用。
毒理学实验的基本原理:毒理学实验是通过将动物或细胞系统暴露于不同剂量的化学物质中,观察其对生物体造成的伤害和影响来评估其毒性。
实验中通常包括急性毒性、亚慢性毒性和慢性毒性等不同类型的实验。
常见的实验设计:1.急性毒性实验:该实验通过口服、注射或吸入等途径将化学物质暴露给动物,观察其可能导致的突发反应和致死效应。
实验通常在短时间内完成,并根据动物的反应判断化学物质的急性毒性。
2.亚慢性毒性实验:该实验通过连续或间歇地将化学物质暴露给动物一段较长时间,观察其对生物体各个器官和系统的影响。
实验通常持续几周或几个月,并通过检测血液生化指标、器官病变和行为变化等来评估化学物质的亚慢性毒性。
3.慢性毒性实验:该实验通过长期暴露动物或细胞系统于化学物质,观察其对生物体的长期影响。
实验通常持续数月至数年,并通过观察癌症发生率、器官功能变化等来评估化学物质的慢性毒性。
评估方法:1. LD50(半致死量):通过给动物不同剂量的化学物质,观察其在一定时间内造成50%动物死亡的剂量,从而评估其急性毒性。
2.组织病理学:通过组织切片和显微镜观察,评估化学物质对动物器官和组织结构的病变情况。
3.血液生化指标:通过检测动物体内的生物标志物,如肝功能指标、肾功能指标等,评估化学物质对生物体各个系统的影响。
4.外部观察和行为测定:通过观察动物的外貌和行为变化,评估化学物质对其行为、神经系统的影响。
毒理学实验在毒理学研究中的应用:1.安全评估:毒理学实验可用于确定化学物质的安全剂量和无效剂量范围,从而为制定相关安全规定和生产标准提供科学依据。
2.毒性机制研究:通过毒理学实验可以了解化学物质对生物体的具体作用机制,从而推测其毒性途径和潜在的毒性效应。

毒性作用名词解释毒理学
毒性作用的定义
毒性作用是指化学物质、生物制品或其他外部因素对生物体产生的危害效应。
这些危害效应可能会损害生物体的组织、器官或生命体征,从而引起多种生理和病理变化。
毒性作用是毒理学研究的重要内容之一。
毒性作用的分类
根据毒性作用的表现形式和机理,可将其分为急性毒性和慢性毒性两种:
急性毒性
急性毒性是指一次或短期内暴露于高浓度的毒物后,引起的急剧中毒反应。
症
状多发生在暴露后的24小时内,可导致中毒死亡或严重的急性疾病。
慢性毒性
慢性毒性是指长时间接触低浓度的毒物后,累积引起的长期或持续的毒物作用。
慢性毒性作用常常比急性毒性作用更隐匿,症状可能在较长时间内逐渐显现,影响生命质量和健康。
毒性作用的评估
对毒性作用的评估是毒理学研究的核心环节,通常包括以下几个方面:
毒性试验
毒性试验是通过实验方法,评估毒物对生物体的毒性效应和危险性。
常见的毒
性试验包括急性毒性试验、慢性毒性试验、亚急性毒性试验等。
毒性动力学
毒性动力学研。
毒理学实验技术总结毒理学作为一门研究外源性化学物质对生物体产生有害作用的学科,其实验技术的发展对于评估化学物质的安全性和风险至关重要。
以下是对常见毒理学实验技术的总结。
一、急性毒性实验急性毒性实验是评估化学物质在短时间内(通常 24 小时至 2 周)对生物体造成的毒性效应。
实验动物通常选用小鼠或大鼠,通过不同的给药途径(如经口、经皮、吸入等)给予一定剂量的受试物。
观察指标包括动物的死亡情况、临床症状(如行为异常、呼吸困难等)、体重变化等。
根据实验结果,可以计算出半数致死剂量(LD50)或半数致死浓度(LC50),这是衡量化学物质急性毒性的重要指标。
二、亚急性和亚慢性毒性实验亚急性毒性实验的时间通常为 28 天至 90 天,亚慢性毒性实验则为90 天至 180 天。
这些实验旨在观察化学物质在较长时间内低剂量暴露下对生物体的潜在毒性。
除了观察一般症状和体重变化外,还会检测血液生化指标(如肝功能、肾功能指标)、组织病理学变化(如肝脏、肾脏、心脏等器官的组织形态改变)等。
三、慢性毒性实验慢性毒性实验的周期较长,一般为 1 年以上,甚至可能持续动物的整个生命周期。
这种实验更能反映化学物质长期暴露对生物体的影响,包括致癌性、致畸性、致突变性等。
检测指标与亚急性和亚慢性毒性实验类似,但更加注重对肿瘤发生、生殖系统影响以及遗传物质损伤的评估。
四、遗传毒性实验遗传毒性实验用于检测化学物质对生物体遗传物质(DNA)的损伤作用。
常见的方法包括:1、细菌回复突变试验(Ames 试验):通过观察受试物是否能引起细菌基因突变来评估其遗传毒性。
2、染色体畸变试验:观察细胞染色体结构和数量的变化。
3、微核试验:检测细胞中微核的形成,反映染色体的损伤。
五、生殖毒性实验生殖毒性实验主要研究化学物质对生殖系统的影响,包括对生殖器官、生殖细胞、胚胎发育等方面的作用。
实验分为三段:1、Ⅰ段:生育力与早期胚胎发育毒性实验,评估对雌雄动物生殖能力和早期胚胎发育的影响。
波棱瓜子总木脂素的急性和亚慢性毒性试验目录一、内容简述 (2)1.1 研究背景与意义 (2)1.2 国内外研究现状 (3)1.3 研究目的与内容 (4)二、材料与方法 (5)2.1 实验材料 (6)2.2 实验仪器与试剂 (7)2.3 实验设计 (7)2.4 样本制备与剂量设置 (8)2.5 数据采集与分析方法 (9)三、急性毒性试验结果与分析 (10)3.1 实验动物与剂量选择 (11)3.2 急性毒性症状观察 (12)3.3 生物毒性评价指标 (13)3.4 急性毒性试验结论 (13)四、亚慢性毒性试验结果与分析 (14)4.1 实验动物与剂量选择 (15)4.2 亚慢性毒性症状观察 (16)4.3 亚慢性毒性生理指标变化 (17)4.4 亚慢性毒性组织器官损伤评估 (17)4.5 亚慢性毒性试验结论 (18)五、波棱瓜子总木脂素的安全性评价 (18)5.1 急性和亚慢性毒性综合分析 (19)5.2 安全性评价标准与方法 (20)5.3 波棱瓜子总木脂素的安全性评级 (21)5.4 安全性应用建议 (21)六、结论与展望 (22)6.1 研究成果总结 (23)6.2 存在问题与不足 (24)6.3 未来研究方向与应用前景 (25)一、内容简述本试验旨在研究波棱瓜子总木脂素(total oleanolic acid,TOA)的急性和亚慢性毒性。
通过观察不同剂量下波棱瓜子提取物对实验小鼠的生长、行为、器官功能以及血液生化指标的影响,评价TOA的毒性水平。
本试验采用3种不同剂量和200 mgkg)的波棱瓜子提取物,分别进行急性和亚慢性毒性试验。
在试验过程中,对各组小鼠进行定期观察,记录生长情况、活动能力、食欲、体重变化等指标,并对主要器官如肝脏、肾脏、心脏、肺等进行病理学检查。
测定血液生化指标如血清谷丙转氨酶(ALT)、血清谷草转氨酶(AST)、肌酐(Cr)、尿素氮(BUN)等,以评估TOA对小鼠的肝肾功能的影响。
食品添加剂使用的安全性评估方法食品添加剂是一种用于改善食品质量和保持食品新鲜度的物质。
在现代食品加工中,添加剂被广泛使用,以提高食品的口感、外观和营养价值。
然而,由于添加剂的广泛应用,人们对其是否安全的担忧也日益增加。
因此,食品添加剂的安全性评估方法成为了一个重要的研究领域。
食品添加剂的安全性评估是通过一系列的实验和研究来确定添加剂对人体健康的潜在风险。
这些评估方法通常包括以下几个方面:1. 急性毒性评估:急性毒性评估是通过给动物大剂量投放添加剂来评估其对动物的毒性。
这种评估方法可以快速确定添加剂是否具有明显的毒性效应。
实验中通常使用小鼠或大鼠作为实验动物,观察其在给予添加剂后的行为、生理和生化指标的变化。
2. 亚慢性和慢性毒性评估:亚慢性和慢性毒性评估是通过将添加剂长期投放给动物来评估其对动物的慢性毒性效应。
这种评估方法可以更准确地评估添加剂在长期暴露下对动物的潜在危害。
实验中通常使用大鼠或小鼠作为实验动物,观察其在长期接触添加剂后的生理、生化和病理变化。
3. 基因毒性评估:基因毒性评估是通过一系列的实验来评估添加剂对基因的损伤程度。
这种评估方法可以确定添加剂是否具有致突变或致癌的潜力。
实验中通常使用细菌、哺乳动物细胞或实验动物进行基因毒性实验,观察添加剂对DNA的损伤程度。
4. 长期暴露评估:长期暴露评估是通过将添加剂添加到动物的日常饮食中,评估其对动物的长期健康影响。
这种评估方法可以模拟人类长期暴露于添加剂的情况,更准确地评估其对人体的潜在危害。
除了以上实验方法,还有一些其他的评估方法也被广泛应用于食品添加剂的安全性评估中。
例如,流行病学研究可以通过调查人群暴露于添加剂后的健康状况,评估添加剂对人体的潜在影响。
体外试验可以通过使用细胞或组织模型,评估添加剂对人体的毒性效应。
此外,还有一些计算模型和预测方法可以根据添加剂的结构和生物活性,预测其对人体的潜在危害。
需要指出的是,食品添加剂的安全性评估是一个复杂的过程,需要多学科的专家共同参与。
第7章⼀般毒性作⽤及其实验与评鉴⽅法第六章⼀般毒性作⽤及其试验与评价⽅法⼀般毒性作⽤:是指毒物对动物机体产⽣的综合毒性效应,也称基本毒性作⽤根据接触毒物的时间长短可将产⽣的毒性作⽤分为急性毒性、亚慢性毒性和慢性毒性。
第⼀节急性毒性作⽤及其试验与评价⽅法⼀、急性毒性试验的概念急性毒性试验是指动物机体⼀次或24h内多次接触受试物后在短期内所产⽜的毒性效应及反应。
观察内容⼀般包括⾏为变化、外观改变以及致死效应。
观察时间⼀般为7d,观察范围可为7~28d(迟发毒性效应)。
凡经⼝或经注射给毒,“⼀次”的含义是指瞬间将受试物输⼊试验动物体内;若经呼吸或⽪肤给毒,“⼀次”则指在⼀个特定的时间内,使试验动物持续接受受试物的过程。
“24h内多次接触受试物”的概念是指当受试物毒性很低,⼀次接触还不能达到充分了解该受试物的毒性作⽤,或⼀次不能导⼊设计剂量的受试物时,需在24h内分次染毒。
⼆、急性毒性试验的⽬的(1)测定和计算出受试物的致死量及其他急性毒试参数,主要获得受试物对某种实验动物以某种接触途径的LD50值;(2)了解受试物对动物机体的急性毒性特征,靶器官和剂量⼀反应关系;(3)研究受试物在动物体内的动⼒学变化规律;(4)为下⼀步的亚慢性、慢性毒性试验及其他毒理学试验的剂量设计和观察指标选择提供依据。
三、急性毒性试验⽅法1.实验动物的选择和要求(1)品种、品系的选择实验动物选择的原则是以哺乳动物为主,选择两种或两种以上的动物,包括啮齿类(rodentspecies)和⾮啮齿类(nonrodenl species),其中⾄少有⼀种⾮啮齿类动物。
啮齿类多选⽤⼩⿏和⼤⿏,⾮啮齿类常选⽤⽝或猴。
(2)性别和年龄或体重的要求对于实验动物的性别⼀般要求雌雄(早6)各半。
如果试验仅为某些特殊试验研究⽬标,也可选⽤单⼀性别。
如致畸试验可仅选雌性动物,对精⼦毒性试验可仅选雄性动物。
急性毒性试验通常要求刚成年的动物。
⼀般按体重选购,通常要求⼩⿏18~25g、⼤⿏180~240g、豚⿏.200~250g、家兔2~2.5kg、猫1.5~2kg、⽝4~6kg(⽝⼀般为1岁左右)。
急性毒性试验
(一)经典的急性致死性毒性试验
通过试验得到化合物引起动物死亡的剂量一反应关系并求得LD50 ( LC50)
1、实验动物
常用的实验动物是小鼠或大鼠。
一般受试动物应是雌、雄各半;若雌、雄动物对待测化学物
毒性的敏感程度有明差异,则应分别求出各自的LD50;如果试验是为畸形试验做剂量准备,
也可仅做雌性动物的LD50试验。
小动物每组10只,狗等大动物可每组6只。
2、染毒剂量设计
首先要了解化学毒物的结构式、分子量、常温常压下的状态、纯度、杂质成分与含量、溶解
度、挥发度、PH等理化性质。
对于新的受试化学物,找出与受试化学毒物结构与理化性质
近似的化学物的毒性资料,并以文献资料中相同的动物种系和相同接触途径所测得的
LD50(LC50)值作为受试化学物的预期毒性中值,先用少量动物,以较大的剂量间隔(一般按
几何级数)染毒,找出找出10%~90%(或0% ~100%)的致死剂量范围,然后在这个剂量范
围内设几个剂量组。
改良寇氏法最好设5个剂量组,每组10只动物,雌雄各半,剂量组要
求以等比级数设置。
根据以下公式计算出剂量分组:
i=(lgLD90-lgLD10) / (n-1) 或:i=(lgLD100-lgLD0) / (n-1)
式中i为组距(相邻的两个剂量组对数剂量之差);
n 为设计的剂量组数。
有的毒性较小,此时可不再求其LD50,而应进行限量试验。
在用大鼠或小鼠进行试验时,
一般用20只动物,雌雄各半。
单次染毒剂量一般限定为5g/kg (体重),对于食品毒理学试验,限量要求为15g/kg (体重)。
如果实验动物无死亡或仅有个别动物死亡(死亡率低于50%), 则可得出LD50大于限量的结论。
3、观察
染毒后一般要求观察14天,依据14天内动物的总死亡情况计算LD50。
在实际工作中,依据受试物有关测试规程要求确定观察期的长短。
观察内容包括:
(1)动物死亡情况:包括动物死亡数及各自的死亡时间。
(2)动物体重:于染毒前、染毒后每周和死亡时测定体重。
(3)中毒反应症状:临床观察每天至少一次,观察皮肤、被毛、眼睛和粘膜改变,呼吸、循环、
自主和中枢神经系统以及四肢活动和行为方式的变化等,特别要注意有无震颤、惊厥、腹
泻、嗜睡等现象。
神经毒性:惊厥、共济失调和死亡。
植物神经兴奋:腹泻或竖毛。
(4)病理学检查:解剖进行尸检,观察各器官有无改变,对肉眼观察有变化的脏器需进
行组织病理学检查。
4、LD50计算
(1)霍恩氏法
(2)简化寇氏法
M = X - i(工p - 0.5)
式中:m —log LD50,
X —最高剂量组剂量对数值,
p —死亡率(用小数表示),
工p—死亡率总和,
i —相邻两组剂量对数之差。
(3)直接回归法:
死亡频率呈正态分布,则变化曲线为典型的“钟罩”型;死亡频率化为累积死亡频率,反应曲线呈S 形;累积死亡频率化为概率单位时,反应曲线呈直线。
(二)急性毒性试验的其他方法
1. 固定计量法
2. 急性毒性分级法
3. 上、下移动法
亚慢性毒性和慢性毒性的评价方法
1、实验动物
要求选拔两种实验动物,一种为啮齿类,首选是大鼠,另一种为非啮齿类,首选是狗。
亚慢
性毒性试验一般每个剂量组20只大鼠,或每组4~6只狗。
慢性毒性试验每组40只大鼠,狗
每组8只或以上。
2、染毒途径
常用的染毒途径是经胃肠道、经呼吸道和经皮肤染毒。
3、染毒期限
工业毒理学一一3 —6个月
食品毒理学一一6个月一1年
环境毒理学一一6个月一1年
致癌试验——接近或等于动物的预期寿命
4、剂量分组
(1)亚慢性毒性的剂量选择:
阴性对照组,低剂量组,中剂量组,高剂量组
急性毒性的阈剂量:1/20~1/5 LD50
组距:3~10倍,最低不小于2倍
(2)慢性毒性的剂量选择
阴性对照组,低剂量组,中剂量组,高剂量组
亚慢性阈剂量:1/50~1/5LD50
组距:2~5倍,最低不小于2倍
5、观察指标
(1)中毒症状(行为和外观)
(2)体重:每周称量一次
(3)食物利用率(试验动物每食入100g饲料所增长的体重克数)
(4)实验室检查
1) 血液学检查
2) 尿液检查
3) 血液生化学检查
(5 )病理及病理组织学检查
对濒死动物进行解剖。
试验结束及恢复期结束时,活杀实验动物。
1) 系统解剖:消化道、肺、肝、肾、淋巴腺、眼、皮肤等,记录有无肉眼可见的异常变化。
2) 脏器系数:是指
某个脏器质量与体重的比值,又称脏体比值。
常以100 g体重或1g 体重计。
需称量脏器湿重并计算其脏器系数。
3) 组织病理学检查
(6)特异性指标
6、结果分析:选择适当的统计学方法进行各剂量组与阴性对照组的比较。