碳的化学性质(1)
- 格式:ppt
- 大小:259.00 KB
- 文档页数:8



炭的化学知识点总结一、炭的结构炭的结构主要由碳元素构成,其结构可以分为非晶炭和晶体炭两种。
非晶炭是一种没有规则结构的碳材料,其在原子层次上呈现出无序排列的状态,因此非晶炭的力学性质和电学性质较差。
而晶体炭则是由层状结构的石墨晶体组成,其具有规则且有序的结构,因此在力学性能和导电性能方面有着较好的表现。
此外,炭材料中还存在着许多的孔隙和微孔结构,这些孔隙可以用来吸附气体、液体和固体,因此炭具有很强的吸附能力。
二、炭的性质1. 物理性质(1)密度:炭的密度较低,通常在1.5-2.0g/cm³之间,比较轻。
(2)硬度:炭的硬度比较高,常常可用于制作磨料和抛光材料。
(3)导电性:炭具有良好的导电性能,因此可用于制作电极和电磁材料。
(4)热稳定性:炭在高温下表现出很好的热稳定性,因此在高温环境下也能够维持其结构和性质不变。
2. 化学性质(1)耐腐蚀:炭具有很好的化学稳定性,不易被酸、碱腐蚀。
(2)吸附性:炭的吸附性能强,能够吸附气体、液体和固体等不同的物质。
(3)易燃性:经过适当的处理,炭能够燃烧释放热量,可用作燃料。
(4)活性:炭的表面具有丰富的活性基团,可以与其他物质发生化学反应。
三、炭的制备炭的制备方法有很多种,常见的包括燃烧法、碳化法、高温热解法等。
1. 燃烧法燃烧法是一种简单易行的制备炭的方法,其原理是将有机物料在缺氧条件下进行燃烧,使得其除碳元素外的其他元素被完全氧化,最终留下高纯度的碳元素。
这种方法制备出的炭通常密度较低,硬度较小,但成本较低。
2. 碳化法碳化法是将有机物料在高温环境下进行加热处理,使得其中的氢、氧等元素被去除,留下高纯度的碳元素。
这种方法制备出的炭通常密度较高,硬度较大,但成本较高。
3. 高温热解法高温热解法是在高温下将有机物料进行热解,以得到高纯度的碳元素。
这种方法制备出的炭通常自由度较高,结构较为活泼,具有较好的电学和力学性能。
四、炭的应用炭具有丰富的应用价值,在工业生产、环境保护、能源利用等方面都有着重要的应用。


碳的化学特性与官能团碳是化学元素周期表中的第六位元素,拥有丰富的化学性质与特性。
它的独特性质使得碳成为生物有机化合物的重要组成部分。
在有机化学中,官能团是由碳及其周围的原子所组成的一些特定的原子团,具有一定的化学活性和反应性。
1. 碳的化学特性碳具有四个价电子,能形成四个共价键。
这使得碳能够形成庞大的碳链和构建复杂的有机分子。
碳的价电子结构使得它能与其他原子(包括碳自身)形成共价键,从而形成不同类型的化学键,如单键、双键和三键。
另一个重要的碳的化学特性是其稳定性。
碳是一个非金属元素,具有较高的电负性,因此在化学反应中常处于较稳定的状态。
这使得碳能够在各种不同的环境条件下存在,并参与形成多种化合物。
2. 官能团的定义与分类官能团是指具有一定特定化学性质的原子团,由一个或多个原子构成,并影响有机分子的性质和反应性。
它们通常以一个或多个原子上的键合关系来定义。
官能团可根据其化学性质和结构进行分类。
以下是一些常见的官能团分类:2.1 羟基(-OH)羟基是指一个氧原子与氢原子通过共价键连接而成的官能团。
它常见于醇和酚类化合物,如甲醇(CH3OH)和苯酚(C6H5OH)。
羟基的存在赋予了醇类化合物水溶性和氢键形成的能力。
2.2 羰基(C=O)羰基是指一个碳原子与一个氧原子通过双键连接而成的官能团。
它常见于酮和醛类化合物,如丙酮(CH3COCH3)和乙醛(CH3CHO)。
羰基的存在赋予了酮和醛的特定化学性质,如氧化性和亲核性。
2.3 羧基(-COOH)羧基是指一个碳原子与一个羟基和一个羰基通过共价键连接而成的官能团。
它常见于羧酸类化合物,如乙酸(CH3COOH)。
羧基的存在赋予了羧酸的酸性和亲电性。
2.4 胺基(-NH2)胺基是指一个氮原子通过共价键连接至一个或多个氢原子的官能团。
它常见于胺类化合物,如甲胺(CH3NH2)。
胺基的存在赋予了胺类化合物碱性和亲电性。
除了以上所列的官能团外,还有许多其他常见的官能团,如硫醇基(-SH)、卤素基(-X,X为卤素原子,如氯或溴)等。

碳的化学名称碳的化学名称为"碳",是化学元素周期表中的第六个元素,原子序数为6,原子量为12.01。
碳是自然界中广泛存在的元素之一,其在地壳中的含量仅次于氧,居第四位。
碳具有丰富的化学性质,是有机化合物的基础,也是生命的基石。
碳的化学性质主要表现在其能够形成多种稳定的化合价,包括+4、+3、+2和-4。
其中,碳的+4价最为常见,形成的化合物为无机碳酸盐,如碳酸钙(CaCO3)和碳酸铁(FeCO3)。
碳的+3价较少见,形成的化合物包括氰化物(如氢氰酸HCN)、氯化三价碳(CCl3Cl)等。
碳的+2价形成的化合物为碳酸酯(如二甲基碳酸二甲酯,简称DMC),具有较高的化学反应活性。
碳的-4价形成的化合物为碳化物,如碳化钙(CaC2)和碳化硅(SiC)。
除了形成不同化合价的化合物外,碳还能形成多种键型,包括共价键和金属键。
共价键是碳最常见的键型,其形成的共价化合物数量庞大,如甲烷(CH4)、乙烯(C2H4)等。
金属键则是碳与某些金属元素形成的特殊键型,如四氢化钠(NaC2H2)中的碳-钠键。
碳的化学性质还体现在其能够形成多种同素异形体。
其中,最为重要的是钻石和石墨。
钻石是由纯净的碳元素组成,具有硬度高、熔点高的特点,是人们喜爱的宝石之一。
石墨也是由纯净的碳元素组成,具有导电性和润滑性,广泛应用于铅笔芯、润滑剂等领域。
碳的化学性质还表现在其能够形成大分子有机化合物,如聚合物。
聚合物是由许多单体分子通过共价键连接而成的高分子化合物,其中最为重要的是聚乙烯(PE)和聚丙烯(PP)。
这些聚合物具有良好的物理性质和化学稳定性,广泛应用于包装材料、塑料制品等领域。
除了以上常见的化学性质外,碳还具有较为特殊的化学性质,如碳的同位素碳-14具有放射性,被广泛应用于放射性测定和碳年代测定等领域。
总结起来,碳作为化学元素周期表中的重要元素之一,具有丰富的化学性质。
它能够形成多种化合价和键型,能够形成多种同素异形体,还能够形成大分子聚合物。

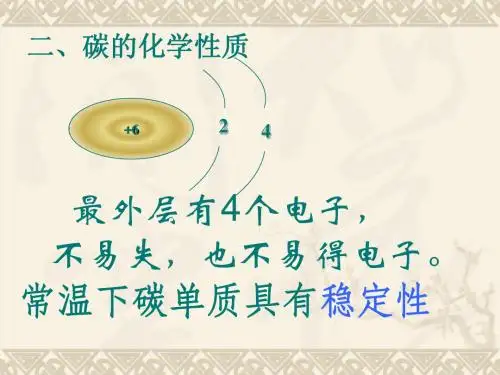
知识点一:碳的化学性质碳的几种常见单质物理性质不同,它们的化学性质是否也不同呢? 金刚石、石墨均由 构成,所以化学性质 。
1、常温下具有 性, 可用于 等。
原因是元素化学性质由 决定,碳的原子结构示意图为 ,最外层电子数为 ,需要 才能达到稳定结构,都不太容易,故碳单质在常温下具有稳定性。
例如古代书画历经千年不变色。
而随着温度的升高,碳在点燃或者高温的条件下,活动性大大增强。
2、 性, 可用做 。
①当氧气充足时,完全燃烧的化学方程式 ;②当氧气不充足时, 不完全燃烧的化学方程式 。
启示:①量变引起质变:反应物及条件相同时,生成物的种类跟 有关;②试管口略向下倾斜的原因是防止 ,使试管炸裂。
③该实验若用酒精灯做热源,需加网罩, 作用是 。
④实验结束后,先 , 目的是防止 ,使试管炸裂。
【讨论】反应结束后,试管内剩余红色固体为 ,待试管冷却后再把试管中的粉末倒到纸上,目的是防止 。
写出碳和其他物质反应的化学方程式:①焦炭还原氧化铁 ②碳与二氧化碳反应 ③水蒸气通过炽热的碳层知识点二:氧化还原反应以木炭还原氧化铜为例在该实验中,氧化铜(“得到”或“失去”)氧变成单质铜,这种含氧化合物里的氧被夺去的反应, 叫做 反应。
氧化铜做 剂,具有 性; 碳 在该实验中 (“得到”或“失去”)氧变成二氧化碳,发生 反应,碳做 剂,具有 性。
【小结】推质量守恒定律,氧原子不可能凭空产生,也不可能凭空消失,有物质得氧就一定有物质失氧,故得氧和失氧是同一个过程的不同方面。
②木炭燃烧时,应尽量提供充足的空气, 避免 。
3、 性, 可用于 。
①碳粉和氧化铜粉末需混合均匀的原因是 。
课题 2 制取 CO₂一、CO₂的实验室制法( )药品: ( 态)和 ( 色态)【知识拓展】实验室制取CO₂不选择“碳酸钠粉末” “稀硫酸” “浓盐酸”的原因:(1)不选碳酸钠粉末的原因:。
(2)不选稀硫酸: 。
(3)不选浓盐酸:。
(二)制取装置的选择1、发生装置的选择( 型)填写图中带有标号仪器的名称: a ,b 。



碳原子的化学性质与有机化学碳(C)是元素周期表中的第六个元素,具有特殊的化学性质,特别适合形成许多有机化合物。
碳原子的化学性质和有机化学是息息相关的,下面将详细探讨碳原子的性质以及它们在有机化学中的应用。
一、碳原子的性质碳原子具有以下几个重要的性质。
1. 四价性:碳原子有四个价电子,能够形成四个共价键。
这使得碳原子能够形成多种结构复杂的化合物。
例如,乙烯(C2H4)分子中的碳原子形成了两个共价键,而甲烷(CH4)中的碳原子形成了四个共价键。
2. 可以形成多元化合物:由于碳原子具有四个价电子,能够与其他碳原子形成共价键。
这使得碳原子能够形成链状、环状甚至网状的结构,从而形成复杂多样的有机化合物。
例如,丙烷(C3H8)和环己烷(C6H12)分别由三个和六个碳原子组成,具有不同的化学性质。
3. 同素异构体:由于碳原子的四价性和能形成多元化合物的特性,碳原子与其他原子(如氢、氧、氮等)结合后,可以不同的方式进行连接,从而形成各种同分异构体。
同分异构体具有相同的分子式,但结构不同,因而具有不同的化学性质。
例如,异丁烷和正丁烷都是C4H10的同分异构体,但它们的化学性质有所不同。
二、碳原子在有机化学中的应用碳原子是有机化学的基础,它的性质为有机化学的发展提供了坚实的基础。
碳原子在有机化学中具有以下重要应用。
1. 构建有机骨架:由于碳原子能够形成多个共价键,因此它在有机化学中的一项重要应用是构建有机分子的骨架结构。
碳原子可以与其他碳原子形成单、双、三键,从而构建直链、分支链、环状等复杂结构的有机分子。
2. 形成不饱和键:碳原子与碳原子之间形成双键或三键时,可以增加分子的不饱和度。
不饱和键的存在使得有机分子具有较高的反应活性,能够进行各种化学反应,从而形成新的化合物。
例如,乙烯的双键结构使其能够进行加成反应、氢化反应等。
3. 形成官能团:碳原子可以与其他原子(如氧、氮、卤素等)形成共价键,从而形成各种官能团。
官能团是有机分子中具有特定性质和反应活性的结构单元。
碳的化学性质之一教案〔通用6篇〕碳的化学性质之一教案〔通用6篇〕碳的化学性质之一教案篇1教学目的1.认识金刚石、石墨及无定形碳由于组成元素一样,具有一样的化学性质。
2.从碳原子的构造认识并掌握碳的化学性质。
3.理解热化学概念。
教学用品木炭粉、氧化铜粉末、澄清石灰水、铁架台、试管、导管〔带胶塞〕、酒精灯[引言] 请同学在黑板上写出碳的原子构造示意图。
从碳的原子构造可以看出,最外层只有4个电子,在化学反响中既不容易得电子,也不容易失电子。
所以在通常状况下,碳的化学性质很稳定。
利用这个性质,可以用墨汁或碳素墨水书写或绘制字画,年深日久都不会褪色。
但随着温度的升高,碳的化学活动性大大增强。
[板书] 一、碳的可燃性[讲解] 煤的主要成份是碳,炉火着得旺时,正是碳在氧气里燃烧,产生大量热和二氧化碳的过程。
[讨论] 煤的燃烧过程是怎样的?火焰旺时是什么颜色?添加新煤后,又变成什么颜色?炉温有什么变化?[投影] 煤炉中的化学反响[讲解] 在鼓风处碳和氧气充分反响生成二氧化碳,在中间层里,二氧化碳和炽热的碳反响生成一氧化碳,产生的蓝色火焰是一氧化碳燃烧产生的。
火焰旺时火焰呈红色,碳和氧气反响后直接生成二氧化碳。
加新煤后,炉温降低,火焰呈蓝色,碳和氧气反响生成一氧化碳。
也就是说,碳和氧气反响有两种情况。
[讲解] 煤气中毒实际上是因为碳和氧气反响时碳的不完全燃烧生成一氧化碳所致,故在烧煤时一定要注意通风。
碳在高温时可夺取某些金属氧化物的氧元素,生成金属单质和二氧化碳,即碳具有复原性。
[板书] 二、碳的复原性[演示] 碳和氧化铜的反响。
〔边实验边引导学生考虑实验步骤及装置中的考前须知〕[现象] 加热片刻,看到试管内的黑色粉末逐渐变红,右边试管内澄清石灰水变浑浊。
[结论] 白色浑浊物质是碳酸钙(CaCO3),红色粉末是单质铜。
[小结] 碳能从氧化铜中将氧夺过来,说明碳具有复原性,其中碳是复原剂,氧化铜是氧化剂。
同样,碳还可和别的氧化物反响,生成单质和二氧化碳。
碳的化学性质及对应用途碳是化学元素中的一种非金属元素,具有丰富的化学性质和广泛的应用。
以下是对碳的化学性质及其对应用途的详细说明。
1. 碳的化学性质:1.1 稳定性:碳是一种化学稳定的元素,不会与大多数常见物质发生化学反应,因此在一般的温度和压力下,碳的化学性质相对稳定。
1.2 容易形成共价键:碳原子有4个电子,可以与其他原子形成共价键,通常以碳-碳键形式存在,也可与氧、氮、硫等非金属原子形成共价键,这种特性使得碳具有丰富的化合物形成能力。
1.3 直链和环状结构:碳原子可以形成直链结构和环状结构,通过不同的化学键连接方式可以形成各种不同的有机化合物,这为有机化学的发展提供了基础。
1.4 动态平衡:碳具有与其他元素形成化学键的平衡能力,可以灵活地参与化学反应,形成不同的化合物。
2. 碳的应用途径:2.1 有机化学合成:碳是有机化学的基础,有机化合物中绝大部分都是以碳为骨架结构,包括烷烃、烯烃、酮、醇等。
碳能够与氢和其他元素形成各种化学键,可以用来合成药物、塑料、橡胶、染料、香料、涂料等有机化合物。
2.2 燃料:碳是重要的燃料来源,煤炭、石油、天然气等都是碳的化合物,通过燃烧可以释放出大量的热能,用于发电、加热、运输等方面。
同时,碳的料理也被广泛应用于工业领域的高温炉。
2.3 炭材料:碳有着优良的机械性能和导电性能,可用于制造碳纤维、炭棒、导电材料等。
碳纤维具有很高的强度和刚度,重量轻,被广泛应用于航空航天、汽车、体育器材等领域。
炭棒具有良好的导电性和耐燃性,可用于电极、电池等应用。
2.4 碳的医学应用:碳在医学领域具有重要的应用价值。
活性炭是一种可以吸附毒物的材料,常用于解毒;碳同位素标记技术可以用于医学影像、药物代谢等研究;碳纳米管是一种新型的纳米材料,具有超高比表面积和特殊结构,可以应用于体内药物输送、医学诊断等。
2.5 碳的环境应用:碳用于环境领域,主要体现在吸附和净化方面。
活性炭作为一种吸附剂,广泛应用于水处理、大气污染控制等方面;生物炭通过提高土壤肥力、减少温室气体排放等,可以应用于农业和环境保护中。
碳元素的知识点碳元素是化学元素周期表中的第六个元素,原子序数为6,符号为C。
它是地壳中含量最丰富的元素之一,也是生命的基础。
碳元素具有独特的特性和重要的化学性质,因此在许多领域都具有广泛的应用。
下面将逐步介绍碳元素的特点和知识点。
1.碳元素的原子结构碳元素的原子结构包含6个质子、6个中子和6个电子。
它的原子核由质子和中子组成,而电子则绕着原子核旋转。
碳元素的电子排布为2, 4,意味着它具有4个价电子。
2.碳元素的化学性质碳元素是一种非金属元素,具有许多独特的化学性质。
其中最重要的是碳元素具有四个价电子,可以形成共价键。
这使得碳元素能够与其他元素形成稳定的化合物,如甲烷(CH4)、乙烯(C2H4)和乙炔(C2H2)等。
3.碳元素的同素异形体碳元素具有多种同素异形体,即由相同的原子组成,但结构却不同的化合物。
其中最常见的是钻石和石墨。
钻石是由纯净的碳元素组成,具有非常坚硬的结构,是一种宝石。
而石墨则是由层层堆叠的碳原子形成,具有良好的导电性和润滑性。
4.碳元素在有机化学中的重要性碳元素是有机化合物的基础,因为它能够与其他元素形成很强的化学键。
有机化合物是由碳元素和氢元素以及其他元素组成的化合物。
生命体中的许多重要分子,如葡萄糖、脂肪和蛋白质等,都是由碳元素构成的。
5.碳元素在环境和能源领域的应用碳元素在环境和能源领域有着重要的应用。
例如,碳元素可以作为吸附剂来吸附和去除水和空气中的污染物。
此外,碳元素还可以用于储存和转化能源,如燃料电池和太阳能电池等。
6.碳元素的同位素碳元素有三个天然存在的同位素:碳-12、碳-13和碳-14。
其中,碳-12是最常见的同位素,占地球上碳元素的绝大多数。
碳-14是一种放射性同位素,可用于碳年代测定。
7.碳元素的生命意义碳元素是构成生命体的基础元素之一,它可以形成复杂的有机分子,从而构成生命体的组织和结构。
生命体中的蛋白质、核酸和多糖等分子都是由碳元素构成的。
此外,碳元素还与氧元素结合形成二氧化碳,是植物光合作用的产物,为维持地球上生命的平衡起到重要的作用。