仓库GMP检查记录
- 格式:docx
- 大小:117.60 KB
- 文档页数:2

仓库检查记录引言仓库是货物存储的关键场所,其管理状况直接影响着企业的运营效率和资产安全。
为了确保仓库的正常运作,定期进行仓库检查是必要的。
本文将对仓库检查的各个环节进行详细阐述,以便为企业提供一套全面、专业的检查方法。
一、检查目标保证货物安全:防止货物丢失、损坏或被盗。
保障员工安全:确保工作环境安全,预防工伤事故。
提高运营效率:优化仓库布局,提高货物出入库效率。
监控环境因素:确保仓库内温度、湿度等符合存储要求。
规范操作流程:保证仓库管理符合相关法规和企业标准。
二、货品检查货品完整性:检查货品数量、规格是否与记录相符,有无破损、缺失。
货品质量:检查货品是否符合质量标准,有无过期、受潮、变质等情况。
标识与追溯:核对货品的标识、标签,确保能追溯到生产批次、供应商等信息。
特殊物品处理:对危险品、易燃品等特殊物品进行专项检查,确保安全存储。
定期盘点:根据企业要求定期进行库存盘点,核对实物与账目是否一致。
三、存储环境温度与湿度:检查仓库温度、湿度是否在规定的范围内,是否配备相应的调节设备。
光照与清洁:确保仓库有良好的自然采光或照明设施,定期清扫,保持环境整洁。
安全设施:检查消防器材、防虫防鼠设施是否完好,紧急疏散通道是否畅通。
通风与排气:评估仓库通风状况,确保空气流通,防止有害气体积累。
库区安全:关注库区围栏、门禁等安全设施,防止未经授权人员进入。
四、员工操作规范培训与资质:员工是否经过专业培训并具备相应资质,能否熟练操作仓库管理软件。
作业指导书:员工是否熟悉各类货品的存储、搬运要求及应急处理措施。
作业流程:员工是否按照规定的流程进行货物出入库、移位及盘点等工作。

仓库检查记录引言概述:仓库检查记录是企业管理中非常重要的一环,通过对仓库的定期检查,可以确保仓库的安全、整洁和高效运作。
本文将从五个方面详细阐述仓库检查记录的内容,包括货物存储情况、仓库设备状况、安全措施、库存管理和物品损耗情况。
一、货物存储情况:1.1 货物分类和标识:检查仓库内货物是否按照分类和标识要求进行存放,确保货物易于查找和管理。
1.2 存储条件:检查货物的存储环境,如温度、湿度等是否符合要求,确保货物不受损或者腐败。
1.3 存储密度:检查货物的存储密度是否合理,是否存在过度堆放或者浪费空间的情况,以优化仓库空间利用率。
二、仓库设备状况:2.1 设备完好性:检查仓库设备的完好性,如货架、叉车、搬运工具等是否存在破损或者故障,确保设备能够正常使用。
2.2 设备维护保养:检查设备的维护保养情况,如定期保养和检修是否按时进行,以延长设备使用寿命。
2.3 设备安全性:检查设备的安全性措施,如是否配备安全警示标识、应急照明等,确保员工和设备的安全。
三、安全措施:3.1 防火安全:检查仓库内的防火措施,如灭火器、消防通道等是否齐全有效,确保防范火灾风险。
3.2 安全通道:检查仓库内的安全通道是否畅通无阻,以确保员工的安全疏散。
3.3 安全培训:检查员工的安全培训情况,如是否定期进行安全培训,以提高员工的安全意识和应急能力。
四、库存管理:4.1 入库记录:检查入库记录的准确性和完整性,确保每一笔入库都有详细的记录。
4.2 出库记录:检查出库记录的准确性和完整性,确保每一笔出库都有详细的记录。
4.3 库存盘点:检查库存盘点的频率和准确性,确保库存数量和实际情况相符。
五、物品损耗情况:5.1 损耗记录:检查物品损耗的记录,如过期、损坏等情况是否有详细记录。
5.2 损耗原因分析:对物品损耗的原因进行分析,如是否存在操作失误、质量问题等,以提出改进措施。
5.3 损耗控制措施:根据损耗原因分析,提出相应的损耗控制措施,如加强员工培训、改进存储条件等。


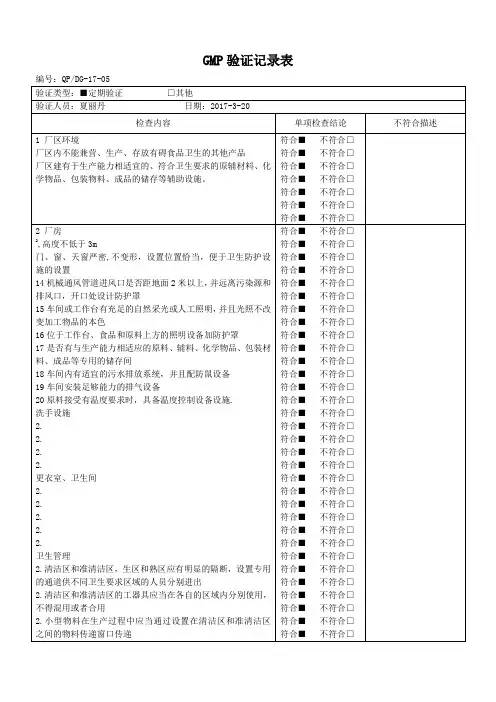
《GMP》实施情况自检记录GMP自检制度一、自检目的:1.审查《GMP》实施情况,确保符合相关法规和标准要求;2.及时发现和解决潜在问题,提高生产质量和效率。
二、自检内容:1.设施设备的管理:包括生产车间、仓库、实验室等各个区域的清洁、温湿度控制、设备维护等情况;2.人员管理:合格的员工培训和资格认证、员工健康状况的检查和记录、员工个人卫生等;3.物料管理:原辅材料、包装材料的采购检验及贮存条件、物料流转和使用记录等;4.质量管理体系:《GMP》质量管理体系的运行情况、质量文件记录和审查等;5.生产过程控制:包括生产计划和记录、生产过程的操作规程符合情况、关键控制点的监控等;6.产品检验和验证:产品质量检验情况、验证记录等;7.不良事件处理:对生产过程中发生的异常和不良事件的记录和处理情况;8.风险评估和控制:对生产过程中存在的风险进行评估并采取相应的控制措施。
三、自检周期:1.设立每月自检的制度,确保每个月至少进行一次自检;2.每次自检的时间为2-3天,尽可能涵盖上述所有内容。
四、自检步骤:1.准备工作:确定自检时间,告知相关部门,并准备自检所需的表格和文件;2.自检执行:各个部门按照自检要求,进行相应的检查和记录;3.自检总结和整理:对自检结果进行整理和总结,将重点问题和解决方案记录下来;4.结果汇报和追踪:向相关部门负责人汇报自检结果,并跟踪解决问题的进展情况;5.整改措施的落实:对于自检中发现的问题,制定相应的整改措施,并确保及时执行和跟踪。
五、自检结果:1.自检结果应以书面形式记录,并保存至少1年;2.自检结果应及时进行汇总和分析,将问题总结归纳,并提出相应的改进措施;3.自检结果和改进措施应及时向相关部门通报,并跟踪整改情况。
六、自检记录:自检记录应包括以下内容:1.自检时间和地点;2.自检人员和职务;3.自检内容和项目;4.自检结果和问题整理;5.改进措施和整改责任人;6.整改跟踪和评估。


gmp自检报告GMP 自检报告一、自检目的为了确保本公司的生产操作和质量管理符合良好生产规范(GMP)的要求,提高产品质量和安全性,保障消费者的健康,特进行本次GMP 自检。
二、自检范围本次自检涵盖了公司的生产车间、仓库、质量控制实验室、设备设施、人员操作、文件管理等各个方面。
三、自检依据1、国家相关法律法规和 GMP 标准。
2、公司内部制定的质量管理体系文件,包括质量手册、程序文件、操作规程等。
四、自检小组成员组长:_____成员:_____、_____、_____、_____五、自检时间_____年_____月_____日至_____年_____月_____日六、生产车间检查情况(一)厂房与设施1、车间的布局合理,人流、物流分开,避免了交叉污染。
但在某些区域,如洁净区与一般生产区的过渡区域,标识不够清晰,容易导致人员误操作。
2、车间的墙壁、地面、天花板表面平整、光滑,易于清洁和消毒。
然而,在一些墙角和天花板的连接处,发现有细小的裂缝,可能会影响洁净度。
3、通风系统运行正常,能够保持车间内的空气洁净度和温湿度符合要求。
但在检查中发现,部分通风口的滤网需要及时更换,以确保空气质量。
(二)设备1、生产设备均经过了安装确认、运行确认和性能确认,并且有相应的维护保养记录。
但在检查中发现,一台关键设备的维护计划没有按照规定的时间间隔执行,存在设备故障的潜在风险。
2、设备的清洁规程制定合理,操作人员能够按照规程进行清洁操作。
但在检查中发现,部分设备的清洁效果不佳,有残留物料的迹象。
3、计量器具均经过了校准和检定,并有相应的证书和标识。
但在检查中发现,一些计量器具的校准周期设置不合理,需要重新评估和调整。
(三)物料管理1、原辅料、包装材料的采购渠道合法,供应商均经过了审核和评估。
但在检查中发现,部分供应商的资质文件没有及时更新,需要加强管理。
2、物料的储存条件符合要求,有相应的温湿度控制和防虫、防鼠措施。
但在检查中发现,一些物料的存放位置不正确,容易混淆。


gmp管理制度仓储一、引言GMP是Good Manufacturing Practice的缩写,意为良好生产规范,是指在生产过程中,通过合理的工艺设计、严格的操作规范和标准的设备设施,确保产品符合质量标准的管理规范。
在医药生产领域,GMP制度是非常重要的,它涉及到药品的安全、有效性、稳定性和生产质量。
仓储是GMP管理中的一个重要环节,本文将就GMP管理制度在仓储环节的要求进行详细的阐述。
二、仓储的GMP要求1.仓库布局与结构(1)合理布局GMP要求仓库的布局合理,分区明确,保持通风良好,保证货物的质量。
(2)结构完整仓库的结构要完整,保持干净整洁,无明显的结构缺陷,并做好防水、防潮、防腐、防火的工作。
(3)温湿度控制GMP要求仓库内温度、湿度应该处于可控的状态,符合药品的贮存要求。
2.货物的接收(1)货物验收对于进货货物的接收需要进行严格的验收,包括对货物外观、包装、标签等的检查,确认货物符合要求后方可入库。
(2)分装货物如果是散装的原料药,需要根据GMP的要求进行分装,确保分装操作的准确性和安全性。
3.货物的储存(1)分类储存GMP要求对货物进行分类储存,不同的药品应该分开存放,避免交叉污染。
(2)储存条件不同的药品对储存条件有不同的要求,GMP要求仓库内应该设有适合不同药品贮存的环境设施,如温湿度控制、防腐设备等。
(3)货位管理GMP要求对货物进行严格的货位管理,确保货物的存储位置清晰可见,便于管理和查询。
4.货物的分装GMP要求对散装药品进行分装时,应该严格按照操作规程进行操作,确保分装的准确性和安全性。
5.货物的出库(1)出库管理GMP要求对出库的药品进行严格的管理,包括对出库人员的资质要求、对相关文件的审核等。
(2)出库记录GMP要求对每次出库都要有详细的记录,包括出库时间、数量、接收人员等,确保出库的准确性和安全性。
6.仓库的清洁和消毒(1)定期清洁GMP要求对仓库进行定期的清洁工作,保持干净整洁,确保不会引入任何外来污染物。
经历欧盟GMP现场检查的体会一、欧盟GMP现场检查的基本流程本次欧盟GMP现场检查,AIFA派出两位检查员到我公司进行为期4天的现场检查,组长Dr. Fernanda Ferrazin是AIFA生产控制部门的GMP高级检查员,基本流程如下:1、初次见面会先由检查员介绍检查小组成员、检查目的并出示检查委托书,接着由企业简单介绍公司的基本情况和参会人员,企业负责人及质量受权人(QP)做简短的发言,最后由检查员声明检查内容及流程。
2、现场检查现场检查的顺序为厂房外围环境→仓库→取样室→生产区→实验室→公用工程。
在现场检查的过程中,检查员随身携带相机及记录本,对生产现场中的相关设施、设备、记录以及一些不符合欧盟GMP的地方进行拍照,并记录所观察到的不符合欧盟GMP的项目或待补证据进行确认的项目。
3、文件检查检查组长负责检查各种流程图和布置图、废弃物流程、验证、企业组织架构图、人员结构图、相关人员的职责、人员培训、产品(包括原辅料、供应商)的年度质量回顾和评价、批生产记录、生产SOP等文件。
另一名检查员负责质量保证体系及设备管理体系的检查。
其检查的内容包括批检验记录、产品放行、产品召回、用户投诉、产品重新加工、GMP自检、产品的稳定性考察、超标管理(OOS-Out ofspecifications)、偏差、变更、水质的年度质量情况及趋势分析、设备管理的相关文件等等。
对于主要文件,检查员会对文件的合理性进行确认,并要求提供相关实例进行检查,以确认是否已按文件的要求执行。
如发现文件所描述的情况与现场检查的情况不一致,再到现场进行核对和确认。
检查员认为文件不合理或有缺陷,也一一指出。
4、总结会由检查组长及成员对整个现场检查情况作简单的总结,对企业的配合及支持表示感谢,并表示将在15个工作日内给企业现场检查的完整报告。
二、现场检查之后的整改要求1、缺陷项目的整改:企业在接到检查员的现场检查报告后,应当在30个工作日内对不合格项目进行整改,由质量受权人(QP)将缺陷项目的整改情况报告提交给检查员。
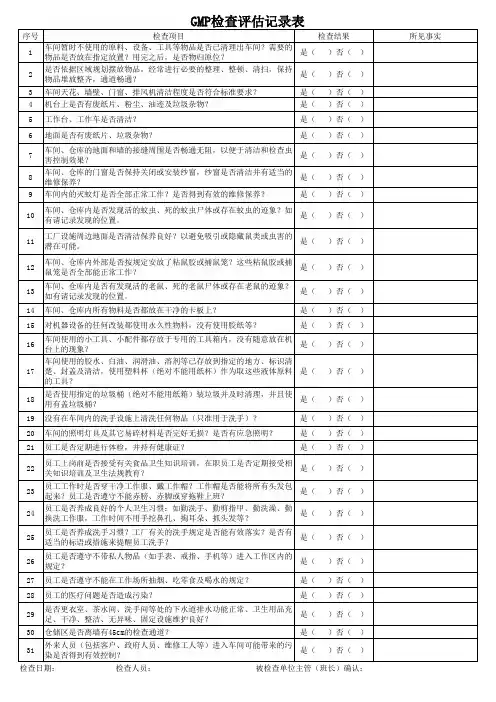
GMP检查表项 目一、食品安全1.0 虫害鼠害控制1.1制定书面的虫害鼠害控制计划。
1.2批准使用的杀虫剂清单,所有的安全资料,使用说明,浓度配制程序及杀虫剂的标签已归档。
1.3制定消杀频率,对虫害鼠害情况进行定期检查,并保持记录1.4定期对虫害鼠害检查情况进行评估,并做趋势分析,制定跟踪改进措施。
1.5厂区内及生产区域没有虫害鼠害活动的迹象。
1.6厂房外部没有虫害鼠害活动的迹象,没有动物活动的迹象。
1.7使用的防虫防鼠器材或诱饵不会对产品、包装材料造成污染。
1.8具备足够的防虫防鼠器材,摆放位置有效。
2.0 外部环境 / 厂区2.1具备垃圾及废弃物处理程序。
2.2厂房无漏水或导致漏水的隐患,厂2.3厂区内的垃圾及车间的下角料集中存放,定期清理,存放区域应与车间隔离,保持清洁。
2.4厂区内必须保证足够的照明,以便能观察到厂区的各个角落,确保厂区的安全。
2.5所有进出厂人员包括外来人员及所有外来车辆进出厂必须进行安全检查和登记。
2.6卫生间、员工食堂、员工宿舍应远离生产车间,并且必须有防止蚊蝇及其它害虫滋生的措施。
3.0卫生管理3.1制定了总体卫生程序,规定了清洗程序和操作步骤以避免造成交叉污染。
3.2制定了对所有清洁消毒操作人员的培训程序,并有记录。
3.3具备有毒有害化学品使用控制程序。
3.4清洁剂及消毒剂的浓度和使用符合卫生程序规定3.5用于清洁的设备或工器具及化学制品与食品、包装材料分开存储并有标识。
3.6具备生产前、生产过程中及生产结束后对卫生情况的检查记录,包括察看设备是否经过清洁和3.7对与产品接触的设备表面进行采样检测,以监测清洁及消毒程序的效果。
3.8生产区域、储存区域、休息区、更衣室、洗手间等区域保持干净整齐。
4 .0 人员要求4.1制定了人员培训程序,并保持培训记录。
4.2具备生产人员卫生及健康情况管理制度。
4.3所有进入车间的人员包括外来人员4.4员工在进入车间前应穿专用工作服、工作鞋,工作服保持清洁。
gmp 药品仓库温湿度记录表范文英文回答:GMP (Good Manufacturing Practice) is a set of guidelines that ensures the quality and safety of pharmaceutical products. As a pharmaceutical company, we have a responsibility to comply with GMP regulations, including the proper storage and monitoring of drugs in our warehouse.One important aspect of GMP compliance is the maintenance of proper temperature and humidity levels in the drug storage area. This is crucial to ensure that the drugs remain stable and effective throughout their shelf life. To monitor and record the temperature and humidity in our warehouse, we use a temperature and humidity recording sheet.The recording sheet contains columns for date, time, temperature, and humidity readings. Every day, ourwarehouse staff takes readings at regular intervals and records them on the sheet. This helps us track any fluctuations in temperature and humidity over time and take corrective actions if necessary.For example, let's say it's a hot summer day and the temperature in the warehouse starts to rise above the recommended range. The recording sheet will show this increase in temperature, and we can take immediate steps to bring it back to the desired level. This may involve adjusting the air conditioning or ventilation systems, or even relocating some of the heat-sensitive drugs to a cooler area of the warehouse.Similarly, if the humidity levels in the warehouse are too high, it can lead to moisture absorption by the drugs, which can affect their stability. By monitoring the humidity readings on the recording sheet, we can identify any deviations from the acceptable range and take appropriate measures to control the humidity levels. This may involve using dehumidifiers or implementing better ventilation systems to maintain optimal conditions for drugstorage.In addition to recording the temperature and humidity, the recording sheet also includes a section for any observations or actions taken. This allows us to document any incidents or issues that may have occurred during the monitoring process. For instance, if there was a power outage that affected the temperature control in the warehouse, we would make a note of it on the recording sheet.By diligently maintaining and reviewing the temperature and humidity recording sheet, we can ensure that our pharmaceutical products are stored under the appropriate conditions as required by GMP regulations. This helps us maintain the quality and efficacy of our drugs, ultimately ensuring the safety and well-being of the patients who rely on them.中文回答:GMP(良好生产规范)是一套确保药品质量和安全的指导方针。
GMP现场检查的注意事项和技巧GMP现场日常管理及审计检查细节汇总一、现场决不允许出现的问题1、各种现场存放的物料,出现帐、卡、物不符或没有标签或没有定置定位;2、现场演示无法操作或操作不合规、不能说清如何工作;3、现场(包括垃圾桶、垃圾站)存在废旧文件(受控或非受控),或有撕毁记录,随意涂改以及提前或明显滞后填写现象;4、专家面前推卸责任、争辩、训斥下属或有阻挠、干扰检查工作的现象;5、环境温湿度、压差、洁净区密封等方面存在问题;6、穿着洁净服行走在不同洁净级别区域之内;7、现场设备设施表面存在明显的锈迹、油污或粉尘。
.8、车间、仓库存在啮齿类动物尸体、粪便或其他活动痕迹。
二、各部门车间指定负责回答问题的人员素质要求1、有能力可胜任;2、沉稳自信;3、放心可靠、能信任的(以防故意捣乱);4、有经验及专业有知识;5、不该说的别乱说,以免节外生枝。
三、各部门必须注意的问题(一)设备设施方面必须避免出现的问题1、不合理安装(设计缺陷,可能引起操作不便及清洁不彻底情形,继而怀疑验证确认的合理性);2、管道连接不正确(存在交叉或较多盲端以及流通不畅、倾斜角度不对等);3、缺乏清洁(设备内表面有残留,清洗SOP的有效性);4、缺乏维护(现场存在跑冒滴漏的痕迹或正在进行);5、没有使用或运行记录;6、使用不合适的称量设备或检测设备;7、设备、管道无标志,未清楚地显示内容物名称和流向;8、有故障和闲置不用的设备未移走或标识不清楚。
9、压差表不回零或指示不准确.(二)生产现场检查时避免出现的问题或关注点1、人流、物流、墙壁、地面、交叉污染;2、每个区域,每次只能生产一个产品,或者必须没有混淆、交叉污染的危险;3、同一批物料或不同批号是否放在一起,相关管理措施;3、在开始生产之前,对生产区和设备的卫生进行检查;4、产品和物料要有防止微生物和其它污染源污染的措施;5、进入生产区人数受控、部分使用物品受控,偏差受控制,中间过程受控制;6、计算产量和收率,不一致的地方则要调查并解释;7、签字确认关键步骤;8、包装物或设备进入生产区之前,清除其上不适当的标签;9、环境检测;10、避免交叉污染,定期有效的检查,SOP及相关记录;11、避免灰尘产生和传播,通风或净化措施的处理;12、生产前要经过批准(有生产指令);13、中间产品和待包装品:储存条件符合,标识和标签齐全;14、重加工的SOP,执行情况;15、在生产区域内不得有:吃东西、喝水、吃零食、抽烟或存有食物、饮料,私人药品等私人物品;16、操作者不得裸手直接接触原料、中间产品和未包装的成品;17、GMP检查员的洁净服按男女备足合体;18、操作工熟悉本岗位操作、清洁SOP;19、设备在清洁、干燥的环境中进行储藏;20、完整的清洁记录,显示上一批产品;21、记录填写清晰符合规范,复核人签字,没有涂改,用墨水或其它不能擦掉的笔填写;22、记录及时和操作同步,按及时、准确、清晰、完整八字方针执行;23、记录错误修改:原来的字迹留存,修改者签名和修改日期,注明修改的原因,不得涂改;24、包装区域员工熟悉作废的印刷包材的销毁SOP,而且有记录;25、包装线很好地分开,或用物理栅栏隔离,防止混淆,外包区与洁净缓冲区进行很好管理,防止操作及人员的交叉;26、在包装场所或包装线上挂上包装的品名和批号;27、对进入包装部门的物料要核对,品名,与包装指令一致;28、打印(如批号和有效期)操作要复核并记录;29、手工包装要加强警惕,防止不经意的混淆,防止头发及其他随身物品脱落至包装袋中.30、关键设备确认状态的标签,如无菌注射剂的灯检机(三)化验室现场检查时的关注点1、清洁:地板、墙、天花板,集尘、通风,光照,管道,记录、记录本等现场整洁有序;2、文件和记录:取样和留样SOP及样品和记录的保存,稳定性试验,与质量有关的投诉的调查,所有物料和产品的检验,检验的管理,质量标准,相关GMP文件,记录本,检验结果,检验报告单,标签,趋势分析,归档;3、试剂、滴定液、毒品和危险品、标准品配制、标签、记录、存放等;4、玻璃器皿:安全使用(裂纹、碎裂、打破、未校者不得出现在现场);5、仪器校准:周期、相关记录、合格证等;6、PH计:操作、清洁、校准等SOP,缓冲液配制,标签,记录;7、天平:防震,校正、维护;8、分析方法验证(药典或非药典);9、稳定性实验(加速、长期);10、微生物实验室(无菌、微生物限度、阳性检查);11、各操作室或操作台洁净度检测结果、记录等。
食品企业GMP检查要点厂区厂区环境•厂区环境要整洁卫生、无异味•厂区内草坪、花卉、树木应修剪整齐•厂区主要通道硬化、无明显积水、无扬尘•厂区内存放的报废或停用设备等场所无虫鼠害孳生或藏匿非吸烟区不得发现烟头•厂区内不得发现鸟巢、猫、狗等动物及排泄物•吹哨人制度看板张贴在食堂等员工容易看到的位置•垃圾站及时清理并清洁有效,不得有大量蚊蝇滋生更衣室•更衣柜顶部不得存放杂物,室内所有设施如排风扇、纱窗、家具整洁无积尘、无异味•墙面、地面、天花板无破损,无洞、无缝、无脱落,墙壁用于固定的钉子等必须牢固•个人更衣柜内不得有食物、药品等存放•工作服/鞋与人员外出衣物/鞋分开存放,避免交叉污染•更衣镜、照明灯、门窗玻璃等玻璃制品要有防护措施•更衣室张贴更衣流程图及管理规则卫生间•车间工作服、工作鞋不得进入卫生间•墙面、地面、天花板无破损,无洞、无缝、无脱落,墙壁用于固定的钉子等必须牢固•卫生间应干净无异味、无蚊蝇•卫生间应有洗手设施、洗手消毒液,维护良好,有洗手消毒示意图维修间•库房门上锁,并授权进入•室内干净清洁,工具摆放整齐•墙面、地面、天花板无破损,无洞、无缝、无脱落,墙壁用于固定的钉子等必须牢固•化学品受管控,无非允许使用化学品•工具箱受控,并有工具清单•食品级润滑油受管制生产车间出入口设施•设施完好无损1、与外界相通的i门帘完整无破损(推荐黄色门帘) ,相互重叠,不得距离地面缝隙较大失去虫害防护功能2、风幕运行正常3、墙面、地面、天花板无破损,无洞、无缝、无脱落,墙壁用于固定的钉子等必须牢固•与外界相通的门窗完好,保持关闭,可开启的窗户应安装可防止虫害进入的纱窗,并保持纱窗完好无损•吹哨人制度看板张贴在考勤设备或车间入口等员工容易看到的位置•按要求放置虫鼠害防治措施并维护良好•所有门窗玻璃应使用防爆玻璃或贴膜防护•与外部直接相连的物料出入口应有虫害防护设施,建议使用双层门清洗消毒•洗手设施配备充足,水龙头数量与同班次食品加工人员数量匹配,配备足够的洗手消毒设施:如水龙头、消毒池、洗手液、消毒液、干手器或干手纸等(符合GB14881规定) ,多人使用不影响出水量•水龙头非手动开关,配备干手和消毒设施,状态良好•配备无味洗手液•消毒液浓度,与标准相符•消毒液配制记录要与标准、实际相符•消毒液等化学物品标识要清楚,上锁保存,专人发放•车间入口洗手消毒处应张贴洗手消毒流程图•洗手消毒设施、设备应处于正常使用状态、无破损工作服•应根据食品特定及生产工艺要求配备专用工作服如衣、裤、鞋袜、帽和发网等,以及口罩、围裙、套袖、手套等•制定有工作服定期清洁制度,必要时应及时替换,并应妥善保养,及时修补,起到和卫生和各种防护的功能。