铁的氢氧化物的制备
- 格式:doc
- 大小:31.50 KB
- 文档页数:2






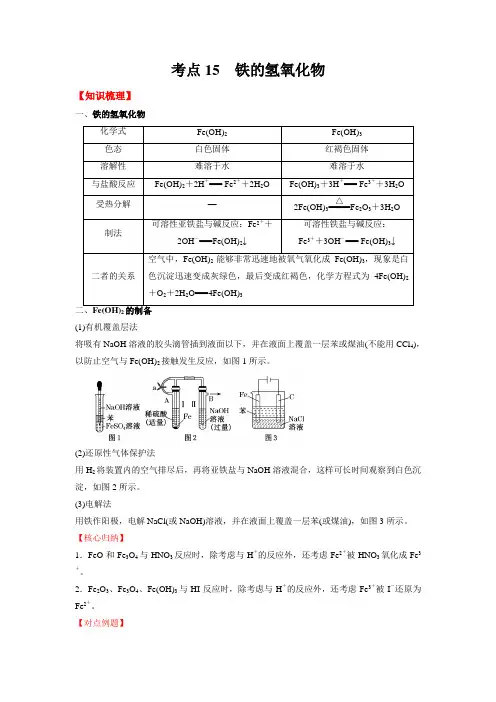
考点15 铁的氢氧化物【知识梳理】一、铁的氢氧化物化学式Fe(OH)2Fe(OH)3色态白色固体红褐色固体溶解性难溶于水难溶于水与盐酸反应Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+=== Fe3++3H2O受热分解—2Fe(OH)3=====△Fe2O3+3H2O制法可溶性亚铁盐与碱反应:Fe2++2OH-===Fe(OH)2↓可溶性铁盐与碱反应:Fe3++3OH-=== Fe(OH)3↓二者的关系空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3二、Fe(OH)2的制备(1)有机覆盖层法将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。
(2)还原性气体保护法用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。
(3)电解法用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖一层苯(或煤油),如图3所示。
【核心归纳】1.FeO和Fe3O4与HNO3反应时,除考虑与H+的反应外,还考虑Fe2+被HNO3氧化成Fe3+。
2.Fe2O3、Fe3O4、Fe(OH)3与HI反应时,除考虑与H+的反应外,还考虑Fe3+被I-还原为Fe2+。
【对点例题】例1.(2023·河南河南·高一阶段练习)下列各图示中能较长时间看到Fe(OH)2白色沉淀的是()A.①②③B.①②④C.①②③④D.②③④【答案】B【解析】Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,发生4Fe(OH)2+O2+2H2O = 4Fe(OH)3。
要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。
①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2 处在氢气的保护中;③无法避免氧气与氢氧化亚铁的反应;④中液面加苯阻止了空气进入,能较长时间看到白色沉淀,选B。

铁及其化合物的性质实验报告一、实验目的1、探究铁单质的物理性质和化学性质。
2、了解铁的氧化物(氧化亚铁、氧化铁、四氧化三铁)的性质。
3、掌握铁的氢氧化物(氢氧化亚铁、氢氧化铁)的制备和性质。
4、研究铁离子(Fe³⁺)和亚铁离子(Fe²⁺)的检验方法以及相互转化。
二、实验原理1、铁单质具有良好的导电性、导热性和延展性,能与氧气、酸等发生反应。
2、铁的氧化物中,氧化亚铁(FeO)为黑色粉末,氧化铁(Fe₂O₃)为红棕色粉末,四氧化三铁(Fe₃O₄)为黑色晶体。
它们在一定条件下能与酸等物质发生反应。
3、铁离子(Fe³⁺)溶液呈黄色,遇硫氰酸钾(KSCN)溶液变红;亚铁离子(Fe²⁺)溶液呈浅绿色,能与碱反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定,迅速被氧化为红褐色的氢氧化铁。
三、实验用品1、仪器:试管、胶头滴管、药匙、镊子、酒精灯、火柴、石棉网、三脚架、蒸发皿、玻璃棒。
2、药品:铁丝、铁粉、氧化亚铁粉末、氧化铁粉末、四氧化三铁粉末、稀盐酸、稀硫酸、氢氧化钠溶液、硫氰酸钾溶液、新制氯水。
四、实验步骤1、铁单质的物理性质观察用镊子夹取一段铁丝,观察其颜色、状态,感受其硬度和延展性。
用磁铁靠近铁丝,观察是否被吸引。
2、铁单质与酸的反应在两支试管中分别加入少量铁粉,向其中一支试管中加入稀盐酸,向另一支试管中加入稀硫酸,观察现象。
3、铁的氧化物与酸的反应分别取少量氧化亚铁粉末、氧化铁粉末、四氧化三铁粉末于三支试管中,向每支试管中加入适量稀盐酸,观察现象。
4、氢氧化亚铁的制备与性质在一支试管中加入适量氢氧化钠溶液,用胶头滴管吸取新制的硫酸亚铁溶液,将胶头滴管伸入氢氧化钠溶液液面以下,缓慢挤出硫酸亚铁溶液,观察现象。
5、氢氧化铁的制备与性质在一支试管中加入适量氢氧化钠溶液,滴加氯化铁溶液,观察现象。
6、铁离子(Fe³⁺)和亚铁离子(Fe²⁺)的检验在两支试管中分别加入少量氯化铁溶液和氯化亚铁溶液,向其中一支试管中滴加硫氰酸钾溶液,观察现象。


第三章 铁 金属材料第一节 铁及其化合物第1课时 铁的单质、氧化物和氢氧化物[核心素养发展目标] 1.结合生活中的铁制品应用,了解单质铁、铁的氧化物的性质及用途,培养化学服务社会的责任意识。
2.通过探究实验,认识铁单质与水蒸气反应的条件,对比钠与水的反应,加深对微观原子结构决定物质宏观性质的认识,培养宏观辨识与微观探析的能力。
3.通过实验掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
一、铁的单质1.铁元素的存在及使用(1)存在:铁在自然界中可以以单质形态(陨铁)存在,但主要以+2价和+3价化合物的形态存在,地壳中含量居第四位,仅次于氧、硅和铝。
(2)工业炼铁的原理(以Fe 2O 3为例) 3CO +Fe 2O 3=====高温2Fe +3CO 2。
2.铁的物理性质铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁体吸引。
其熔、沸点较高,熔点:1 535 ℃、沸点:2 750 ℃,密度:7.86 g·cm -3。
3.铁的化学性质(1)与某些非金属单质、酸和盐溶液反应化学性质化学方程式举例①Fe 与非金属单质反应②Fe 与非氧化性酸反应(H 2SO 4) Fe +H 2SO 4===FeSO 4+H 2↑ ③Fe 与盐溶液反应(CuSO 4)Fe +CuSO 4===Cu +FeSO 4结论:Fe 在反应中作还原剂,遇到较强的氧化剂(如Cl 2等)生成+3价铁的化合物,遇到较弱的氧化剂(如稀硫酸等)生成+2价铁的化合物。
(2)实验探究铁粉与水蒸气的反应实验装置操作现象用火柴点燃肥皂液,听到爆鸣声,证明生成了H2实验结论在高温下,铁能与水蒸气反应,化学方程式为3Fe+4H2O(g)=====高温Fe3O4+4H2提示:湿棉花的作用是受热时提供反应所需的水蒸气。
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质()(2)氯化亚铁既可由铁与盐酸反应制取也可由铁与氯气化合制取()(3)由于钠与水反应生成NaOH和H2,所以铁与水蒸气反应生成Fe(OH)3和H2()答案(1)×(2)×(3)×利用如图装置也可以实现Fe与水蒸气的反应(1)反应开始时,应先点燃处的酒精灯,其目的是,若点燃顺序反了,可能有什么后果?提示b用水蒸气排装置内的空气①Fe与O2生成了Fe3O4,无法与水蒸气反应;②Fe与水蒸气反应生成H2,在高温下与空气中的O2反应可能发生爆炸。

铁的氢氧化钠物一、教学目标1、知识与技能(1)了解铁的两种氢氧化物,了Fe(OH)3、Fe (OH)2 的特性及其制备方法。
(2)掌握防止Fe (OH)2氧化的方法(3)初步应用化学反应原理知识探讨Fe (OH)2制备实验。
进一步增强动手操作实验,观察分析实验的能力2、过程与方法(1)、通过设计实验方案和学生实验,学生掌握铁的氢氧化物的制备方法(2)、通过分析的Fe (OH)2不稳定性,设计制备Fe (OH)2的实验改进方法3、情感态度与价值观(1)通过小组活动,培养学生的科学态度和合作精神。
(2)培养与发展学生对化学学习的兴趣,以及理论与实践相结合能力。
(3)通过探索氢氧化亚铁制备方法的体验,培养学生的创新意识和创新思维能力,养成勤于思考、善于思考、敢于创新、不断创新的科学素养。
二、教学重点、难点教学重点:Fe(OH)3、Fe (OH)2的制备方法教学难点:分析和改进Fe (OH)2的制备三、学情分析1.学生是高一的学生在前面的几节课中已经学习过金属及金属的重要化合物,对本节课的学习一定的帮助和学习方法。
2.已经学习了铁和铁的氧化物,本节课是对铁的化合物知识的延伸。
四、具有独立思考,自我设计实验好,掌握简单实验操作步骤和分析实验现象的能力教学方法五、教学实验用品实验仪器:试管3支、胶头滴管实验试剂:氯化铁溶液、硫酸化亚铁溶液、氢氧化钠溶液,六、教学过程设计七、板书设设计铁的氢氧化物1. Fe(OH)32. Fe(OH)2组成:Fe3+、OH- Fe2+、OH-方程式:FeCl3+3NaOH== FeSO4+2NaOH==Fe(OH)2↓Fe(OH)3↓+3NaCl +Na2SO4 现象:红褐色絮状沉淀白色沉淀迅速变为灰绿色最后变为红褐色 4Fe(OH)2+O2+2H2O==4 Fe(OH)3防氧化方法:1.2.3.4.八、教学反思。
铁的氢氧化物的制备
【问】:同学们还记得Al(OH)3的制备原理吗?
【答】:记得在Al2(SO4)3溶液中加入氨水
【老师】:没错,Al(OH)3的制备原理就是在它的盐溶液中加碱。
其实,不仅Al(OH)3的制备原理是这样,铁的氢氧化物的制备也是这样,这节课我们就着重学习铁的氢氧化物的制备
【板书】:铁的氢氧化物的制备
【老师】:制备Al(OH)3时,当我们往Al2(SO4)3中滴入NH3·H2O,我们只看到了一种白色胶状物质,那我们接下来要制备的Fe(OH)3、Fe(OH)2会不会也是一种白色物质呢
【答】:······
【老师】:那我们就一起来看看它们到底是什么样的物质!现在有老师制备Fe(OH)3. 老师会请一位同学上来观察实验现象,有哪位同学愿意吗?···好,请XXX同学上来,老师制备时你就把你看到的现象告诉下面的同学. 这是FeCl3溶液,这是NaOH溶液,老师往里面加入NaOH溶液,告诉同学们你看到了什么现象
【答】: 红褐色沉淀
【问】:红褐色有再转变成其他颜色吗
【答】:没有
(让学生代表拿下去给其他学生看)
【师】:刚才的实验中反应只生成了一种红褐色沉淀,这说明反应直接生成了Fe(OH)3,而Fe(OH)3没有再转变成其他,既然已经知道了原理,请同学们在本子上写出制备Fe(OH)3的离子方程式
【板书】:Fe3+ + OH—== Fe(OH)3
【师】:同学们都可以写出来吧?···好,制备Fe(OH)3和Al(OH)3时,我们都只看到了单一的实验现象,比如Al(OH)3是白色沉淀,Fe(OH)3是红褐色沉淀,那Fe(OH)2的实验现象会不会也只有一种呢?···这个就需要同学们自己来验证了。
在你们的课桌上老师给你们准备了硫酸亚铁铵溶液和氢氧化钠溶液,你们就利用这两种药品制备Fe(OH)2,并写出离子方程式。
注意,制备时你们要将吸有氢氧化钠溶液的滴管深入试管底部,同时要注意观察这个过程中有没有颜色的变化
【师】:都制备好了吗?请XXX同学说一下你们制备的实验现象
【学】:现有白色沉淀,振荡后变成了灰绿色
【板书】:白
【师】:好,那请你上来把制备的离子方程式写出来
【师】:写对了吗?从刚才这位同学的描述中我们可以知道,反应先生成了一种白色沉淀,接着白色沉淀又变成了灰绿色,同学们知道这是什么原因吗?····事实上Fe(OH)2是一种白色沉淀,但由于Fe(OH)3不稳定,会被空气中的O2氧化,先生成灰绿色沉淀,最终氧化成另一种物质。
但是这个过程需要一定的时间,为了节省时间,又可以看到明显的实验现象,老师给你们准备了H2O2,它的作用和O2一样,现在请同学们加入H2O2,并于老师刚才制备的Fe(OH)3比较一下,看看有什么异同···
【答】:都是红褐色沉淀
【师】:这也就是说Fe(OH)2在H2O2的作用下转化成Fe(OH)3,在这个过程中Fe2+转化成Fe3+,Fe(OH)2充当了还原剂,H2O2充当了氧化剂
【板书】:2Fe(OH)2 + H2O2 == 2Fe(OH)3
【师】:我们都知道空气没有H2O2,但空气中有O2,Fe(OH)2在氧气的氧化作用下最终也会转化成Fe(OH)3
【板书】:4Fe(OH)2 + 2H2O+ O2 == 4Fe(OH)3
【师】:从这个反应是可以清楚的看到Fe(OH)2会被氧气氧化成Fe(OH)3,那我们如何才能得到纯净的Fe(OH)2呢?····请同学们课后思考这个问题,并写出方案。
这节课我们主要学习了铁的氢氧化物的制备原理,我们可以利用这些原理做些什么呢,下节课我们再来接着讲,这节课到此结束!。