人教版九年级化学下册下《溶解度》精品同步测试
- 格式:docx
- 大小:37.41 KB
- 文档页数:8
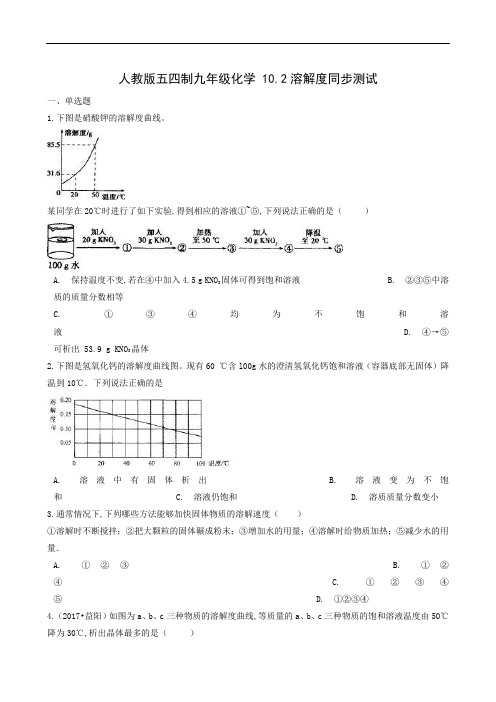
人教版五四制九年级化学 10.2溶解度同步测试一、单选题1.下图是硝酸钾的溶解度曲线。
某同学在20℃时进行了如下实验,得到相应的溶液①~⑤,下列说法正确的是()A. 保持温度不变,若在④中加入4.5 g KNO3固体可得到饱和溶液B. ②③⑤中溶质的质量分数相等C. ①③④均为不饱和溶液D. ④→⑤可析出 53.9 g KNO3晶体2.下图是氢氧化钙的溶解度曲线图。
现有60 ℃含l00g水的澄清氢氧化钙饱和溶液(容器底部无固体)降温到10℃.下列说法正确的是A. 溶液中有固体析出B. 溶液变为不饱和C. 溶液仍饱和D. 溶质质量分数变小3.通常情况下,下列哪些方法能够加快固体物质的溶解速度()①溶解时不断搅拌;②把大颗粒的固体碾成粉末;③增加水的用量;④溶解时给物质加热;⑤减少水的用量.A. ①②③B. ①②④ C. ①②③④⑤ D. ①②③④4.(2017•益阳)如图为a、b、c三种物质的溶解度曲线,等质量的a、b、c三种物质的饱和溶液温度由50℃降为30℃,析出晶体最多的是()A. aB.b C. cD. a和b5.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是()A. t1℃时,甲、乙两物质溶解度相等B. t2℃时25g甲加入50g水中,形成75g溶液C. 甲、乙两种物质的溶解度都随温度的升高而增大D. 甲、乙两种物质,都可以采用降温方法使接近饱和的额溶液变为饱和溶液6.下图是氯化钠和碳酸钠在水中的溶解度曲线,下列说法正确的是()A. 两种物质都属于易溶物质B. 碳酸钠的解度比氯化钠的溶解度受温度的影响较小C. 降温结晶可除去氯化钠中含有的少量碳酸钠D. 氯化钠的溶解度大于碳酸钠的溶解度7.下图是a、b两种固体物质的溶解度曲线。
下列说法中错误的是()A.a物质的溶解度随温度的升高而增大B.t2℃时b物质的溶解度比a物质的溶解度大C.M点表示在t1℃时a、b两种物质的溶解度相等D.升高温度可以将a、b的饱和溶液转化为不饱和溶液8.下列关于石灰水的叙述正确的是()A. 饱和石灰水是浓溶液B.饱和石灰水是纯净物C. 澄清石灰水一定是氢氧化钙的饱和溶液D. 加热饱和石灰水有沉淀产生,溶液变浑浊9.下列操作不能加快溶解速率的是()A. 升高温度B. 加溶剂C. 搅拌D. 粉碎固体10.下列操作通常能加速固体的溶解,又能改变其溶解度的是()A. 搅拌B. 振荡C. 加热D. 把固体研碎11.若要加快某固体物质的溶解速度而不影响实验效果,则下列方法不适宜的是()A. 不断搅拌B. 加热C. 将固体粉碎D. 加溶剂12.如图所示是A,B,C三种物质的溶解度,下列有关说法错误的是()A. 高于20℃以后,B的溶解度比C大B. 10℃时,C接近饱和的溶液升高温度可以达到饱和C. 20℃时,A、B的饱和溶液的溶质质量分数相等D. 35℃时,A物质的饱和溶液的溶质质量分数为30%二、填空题13.根据表中内容回答下列问题:温度/℃0 20 40 60 80溶解度/gKNO313.3 31.6 63.9 110 169NaCl 35.7 36.0 36.6 37.3 38.4Ca(OH)20.173 0.165 0.121 0.116 0.094(1)随温度升高,硝酸钾溶解度的变化趋势是________ (填“增大”“减小”或“不变”);(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是________ ;(3)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时有如图所示的实验现象,烧杯B中溶解的物质________ .14.小红在做饭时,发现很多因素都能影响食盐在水中溶解速率.(1)从你能想到的因素中,写出其中两项,并预测此因素对食盐溶解速率的影响:因素①________ ,你的预测________;因素②________ ,你的预测________ ;(2)从你所列因素中选出一个,通过实验验证你的预测.你设计的实验方案是:你要设计探究的因素为________ ,________ .15.图为甲、乙两种固体物质在水中的溶解度曲线:⑴当40℃时,两物质的溶解度的关系是________。

9.2 溶解度一.选择题1.下列有关溶液说法不正确的是()A.溶液一定是混合物B.氯化钠在水中的溶解度只受温度的影响C.将硝酸钾的饱和溶液降温,一定会析出晶体D.溶液中溶质只能有一种2.在室温为20℃时,将1.5g某物质溶于100g水中,恰好形成饱和溶液,则该物质属于()A.易溶物质B.可溶物质C.微溶物质D.难溶物质3.如图是利用海水提取粗盐的过程,根据海水晒盐的原理,下列说法中不正确的是()A.海水进入贮水池,海水的成分基本不变B.在蒸发池中,海水中水的质量逐渐减少C.粗盐中含有可溶性杂质和不溶性杂质D.结晶后的母液是氯化钠的不饱和溶液二.填空题4.结晶方法有两种:从硝酸钾溶液中获得硝酸钾晶体用方法,从海水中提取食盐,通常用的方法.5.结晶的方法有和.6.为加快白糖在水中的溶解速度,下列方法可行的是A.加入更多白糖 B.加入更多水 C.用热水溶解 D.7.把硝酸钾加入到一杯冷水中,欲使硝酸钾快速溶解的方法有:;.8.在如图所示装置的试管中,加入硝酸铵固体,片刻后,U型管中左侧液面将(填“上升”、“下降”或“不变”)9.如图,往试管中加入一定量的氢氧化钠固体,片刻后,U型管右侧液面将,试解释出现该现象的原因。
10.如图所示,广口瓶中盛有少量饱和澄清石灰水,小试管和U形管中均有适量水,现向小试管中加入适量氢氧化钠固体。
请回答:(1)可现察到饱和澄清石灰水,说明(任答一条);(2)U形管中,a、b液面变化情况是(填字母序号)。
A.a液面上升,b液面下降B.a液面下降,b液面上升11.A、B、C、D四个烧杯中分别盛有相等质量的水,在温度相同的条件下,向四个烧杯中分别加入20 g、15 g、10 g、5 g某物质,充分溶解后观察到如图所示的现象.请完成下列问题:(1)在A、B、C、D四个烧杯中,中盛的一定是饱和溶液;中盛的一定不是饱和溶液;中盛的可能是饱和溶液.,对盛有一定是饱和溶液的烧杯加热,随着温度升高,先变成不饱和(2)若固体是KNO3溶液的是.(3)在一定温度下,往A、B中加入相同质量的水,B中固体刚好溶解,A中固体能否全部溶解?.12.溶质继续溶解的溶液叫做。

9.2 溶解度一.选择题(共13小题)1.下列物质分别加入水中,能对汽水起到冰镇作用的物质是()A.活性炭B.氯化钠C.硝酸铵D.氢氧化钠2.如图所示,分别向试管内加入下列各物质时,能使U形管右侧管内液面显著升高的是()A.硝酸铵B.稀硫酸C.浓盐酸D.生石灰3.氢氧化钙的溶解度随温度升高而减小。
要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤恒温蒸发水。
其中措施正确的是()A.①②④B.①③④C.①③⑤D.①②⑤4.下列操作不能加快溶解速率的是()A.升高温度B.加溶剂C.搅拌D.粉碎固体5.实验室中的操作类似“海水晒盐”原理的是()A.溶解B.蒸发C.过滤D.搅拌6.下列各组物质,不适宜用冷却热饱和溶液法结晶的是()A.硝酸钾溶液B.食盐溶液C.硫酸铜溶液D.氯化铵溶液7.下列说法错误的是()A.饱和溶液一定是浓溶液B.糖水、汽水都是溶液C.洗洁精去油污是因为洗洁精具有乳化功能D.溶液都是均一、稳定的混合物8.25℃时50克水中最多可溶10克A,30℃时50克水中最多可溶15克B,则A、B溶解度相比较为()A.无法比较B.A大于B C.A小于B D.A等于B9.不影响固体溶解度大小的因素是()A.温度B.溶剂质量C.溶剂种类D.溶质种类10.如图为a、b、c三种固体物质的溶解度曲线。
下列说法中,正确的是()A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=cB.t1℃时,将20gc加入50g水中充分溶解,得到70克饱和溶液C.t2℃时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数D.t1℃时,a、b、c的饱和溶液中,溶质质量分数最大的是b11.溶液从80℃降至20℃后,有晶体析出,则原溶液()A.可能是饱和溶液,也可能是不饱和溶液B.一定是饱和溶液C.原溶液从80℃降温至60℃一定有晶体析出D.一定是不饱和溶液12.下列操作能增强蔗糖在水中的溶解性的是()A.B.C.D.13.据文字记载,我们的祖先在神农氏时代就开始利用海水晒盐。

九年级化学人教版下册9.2溶解度同步测试卷一、选择题1. 已知 20℃时 100 g 水中最多能溶解 36 g 氯化钠 ,20℃时向 100 g 水中加 50 g 氯化钠 , 充分溶解后 , 所得溶液中溶质的质量分数为 ( ) A.36% B.50% C.33.3% D.26.5%2. 向一定量的 10% 的硝酸钾溶液中加入少量氯化钠 , 搅拌至完全溶解 , 此时所得溶液中硝酸钾的质量分数与原溶液中硝酸钾的质量分数相比较 , 其变化是 ( )A.不变B.变小C.变大D.无法判断3. 除质量分数以外 , 人们有时也用体积分数来表示溶液的浓度。
例如 ,52% 的饮用白酒就是指每 100 体积的饮用白酒中含有 52 体积的乙醇。
下列溶液的浓度属于用体积分数来表示的是 ( )A.0.9% 的生理盐水B.5% 的葡萄糖注射液C.10% 的氢氧化钠溶液D.75% 的医用酒精4. 将 100 g 10% 的硝酸钾溶液与 200 g 10% 的硝酸钾溶液混合后 , 不发生改变的是 ( )A.溶质的量B.溶剂的量C.溶质质量分数D.溶液总量5. 下列关于溶解度的说法正确的是 ( )A.20 ℃时,20 g某物质加入水里形成饱和溶液,所以该物质的溶解度为20 gB.20 ℃时,20 g某物质溶解在100 g水里,所以该物质的溶解度为20 gC.20 g 某物质在100 g水里恰好饱和,所以该物质的溶解度为20 gD.20 ℃时,100 g水里最多溶解某物质20 g,所以该物质在20 ℃时的溶解度为20 g6. 20 ℃时,往50 g硝酸钾溶液中加入5 g硝酸钾晶体,充分搅拌后,尚有部分晶体未溶解。
稍加热后,晶体全部溶解。
下列说法正确的是( )A.搅拌后加热前一定是饱和溶液B.搅拌后加热前一定是不饱和溶液C.加热后一定是饱和溶液D.加热后一定是不饱和溶液7. 生活中的下列现象 , 能说明气体的溶解度随压强变化而变化的是( )A.夏天 , 鱼塘中的鱼常常会浮在水面呼吸B.烧开水时 , 沸腾前水中有气泡产生C.打开饮料瓶盖会有大量气泡冒出D.喝了汽水以后 , 常常会打嗝8. 增加二氧化碳在水中的溶解度 , 可行的操作是 ( )A.升温B.加压C.增加水量D.不断通入二氧化碳9. 打开汽水瓶盖 , 有大量气体逸出 , 下列说法不正确的是 ( )A.溶质减少B.溶解度减小C.浓度减小D.饱和溶液变成不饱和溶液10. 25℃时,50 g水中最多可溶10 g A,30℃时,50 g水中最多可溶15 g B,则A、B溶解度比较为( )A.无法比较B.A 大于 BC.A 小于BD.A 等于 B11. 某温度时 , 将 10 g 饱和氯化钾溶液蒸干 , 得氯化钾晶体 2 g, 则氯化钾在此温度下的溶解度为 ( )A.10 gB.2 gC.20 gD.25 g12. 将 2.5 g 硼酸在 20℃时溶于 50 g 水中即达到饱和 , 则一般把这种物质的溶解性划分为 ( )A.易溶物质B.可溶物质C.微溶物质D.难溶物质13. 下列加速物质溶解措施中 , 能改变固体溶解度的是 ( )A.加热B.搅拌C.振荡D.把固体研细14. 在常温下有一瓶接近饱和的硝酸钾溶液 , 为了使其变为饱和溶液 , 可采取多种方法 , 你认为不可行的是 ( )A.加入硝酸钾晶体至不再溶解B.升高温度增大硝酸钾的溶解能力C.降低温度至有少量晶体析出D.恒温蒸发水至有少量晶体析出15. 在 20℃时 , 往 100 g 饱和食盐溶液中 , 加入 5 g 食盐 , 保持不变的是 ( )A.溶质质量B.溶剂质量C.溶液质量D.以上皆是二、填空题16. 啤酒是生活中常见的饮料,其中含有二氧化碳、水等物质。

【若缺失公式、图片现象属于系统读取不成功,文档内容齐全完整,请放心下载。
】《9.2 溶解度》一.选择题1.下面关于饱和溶液的说法中,正确的是()A.含有溶质很多的溶液B.还能继续溶解某种溶质的溶液C.不能继续溶解某种溶质的溶液D.在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液2.从1L氯化钠饱和溶液中取出100mL液体,则原溶液发生的变化是()A.溶液由饱和变成了不饱和 B.溶液中会析出晶体C.溶液中只有溶剂减少了 D.溶液中溶剂和溶质都减少了3.饱和溶液用水稀释变成不饱和溶液的过程中,保持不变的是()A.溶质的质量 B.溶剂的质量C.溶液的质量 D.溶质与溶剂的质量比4.下列关于溶液的说法中,正确的是()A.极稀的溶液可能是饱和溶液B.饱和溶液是不能再溶解溶质的溶液C.不饱和溶液降温后可能变成饱和溶液D.饱和溶液升高温度后一定变成不饱和溶液5.能证实20℃时原KNO3的溶液是饱和溶液的事实是()A.降温到10℃时有KNO3晶体析出B.蒸发掉10克水,有KNO3晶体析出C.加热到30℃后,再加入KNO3晶体仍能继续溶解D.在20℃时,向上述KNO3溶液中加入少量KNO3晶体,溶液的质量不变.6.在一定温度下,使固体物质的饱和溶液变为不饱和溶液最可靠的方法是()A.加入溶质或蒸发溶剂 B.加入溶剂C.都采用升高温度的方法 D.都采用降低温度的方法7.20℃时氯化钠的溶解度是36g,则氯化钠属于()A.易溶物质 B.可溶物质 C.微溶物质 D.难溶物质8.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳,溶解度随温度的升高而增大的是()A.①② B.③④ C.①③④ D.只有①二、非选择题9.叫饱和溶液.叫不饱和溶液.10.一般地说,要确定某一溶液是否饱和,只要看在下,有没有继续溶解的存在,如有,且的量不再减少,那么这种溶液就是饱和溶液.11.在一定温度下,向某溶液中加入足量该溶质,振荡后加入的溶质质量并不减少,则原溶液是溶液;再将该混合物加热,未溶的溶质全部溶解,这说明..12.饱和溶液如何转化为不饱和溶液?不饱和溶液如何转化为饱和溶液?13.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液吗?14.溶解度表示在下,某固态物质在里达到时所溶解度的质量.如果不指明溶剂,通常所说的溶解度是指物质在里的溶解度.15.20℃时氯化钠的溶解度是36g,它的涵义是.16.气体的溶解度是指在压强为101KPa和一定温度时气体溶解在1体积水里达到饱和状态时的气体体积.17.0℃时,氧气的溶解度为0.049的含义是什么?.18.在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是g.19.在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是g.20.20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?温度溶质的质量溶剂的质量溶液的质量21.如图,A、B是两种物质的溶解度曲线图,(1)A物质的溶解度曲线表明A物质(2)M点表示在℃时,A和B和溶解度,在A物质的溶解度大于B物质的溶解度.在A物质的溶解度小于B物质的溶解度.22.如图是A、B、C三种物质在水中的溶解度曲线,请回答:(1)M点的含义是.(2)当温度为t1℃,三种物质溶解度由小到大依次为,当温度为t3℃时,溶解度最大的是.(3)C可能表示哪种物质:.人教版九年级下册《9.2 溶解度》同步练习卷参考答案与试题解析一.选择题1.下面关于饱和溶液的说法中,正确的是()A.含有溶质很多的溶液B.还能继续溶解某种溶质的溶液C.不能继续溶解某种溶质的溶液D.在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液【考点】饱和溶液和不饱和溶液.【专题】结合课本知识的信息.【分析】饱和溶液是指在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液.【解答】解:A、含有溶质很多的溶液不一定是饱和溶液.故错误;B、还能继续溶解某种溶质的溶液是不饱和溶液.故错误;C、不能继续溶解某种溶质的溶液,没有指明温度和溶剂的量.故错误;D、在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液.故正确.故选D.【点评】解答本题时要充分理解饱和溶液的特征,即一定温度、一定量的溶剂、不能再溶解该种溶质.2.从1L氯化钠饱和溶液中取出100mL液体,则原溶液发生的变化是()A.溶液由饱和变成了不饱和 B.溶液中会析出晶体C.溶液中只有溶剂减少了 D.溶液中溶剂和溶质都减少了【考点】溶液的概念、组成及其特点.【专题】溶液、浊液与溶解度.【分析】根据溶液具有均一、稳定的特点,各部分性质均相同.【解答】解:因为溶液各部分性质均相同,从1L氯化钠饱和溶液中取出100mL液体,剩余溶液的浓度、密度、溶质质量分数、饱和状况都没有发生变化,但是剩余溶液中的溶质、溶剂减少了,因为取出的溶液中也含有溶质和溶剂.故选D.【点评】要熟记溶液的三大特点:均一、稳定、混合物.3.饱和溶液用水稀释变成不饱和溶液的过程中,保持不变的是()A.溶质的质量 B.溶剂的质量C.溶液的质量 D.溶质与溶剂的质量比【考点】用水稀释改变浓度的方法.【专题】溶液、浊液与溶解度.【分析】根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.【解答】解:饱和溶液用水稀释变成不饱和溶液的过程中,溶质质量不变,溶剂质量增加,溶液的质量增加.A、饱和溶液用水稀释变成不饱和溶液的过程中,溶质的质量不变,故选项正确.B、饱和溶液用水稀释变成不饱和溶液的过程中,溶剂的质量增加,故选项错误.C、饱和溶液用水稀释变成不饱和溶液的过程中,溶液的质量增加,故选项错误.D、饱和溶液用水稀释变成不饱和溶液的过程中,溶质与溶剂的质量比发生改变,故选项错误.故选:A.【点评】本题难度不大,考查溶液的稀释问题,掌握溶液稀释前后溶质的质量不变是正确解答此类题的关键所在.4.下列关于溶液的说法中,正确的是()A.极稀的溶液可能是饱和溶液B.饱和溶液是不能再溶解溶质的溶液C.不饱和溶液降温后可能变成饱和溶液D.饱和溶液升高温度后一定变成不饱和溶液【考点】饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法;浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系.【专题】溶液、浊液与溶解度.【分析】A、从饱和氢氧化钙溶液中含有溶质很少,是极稀的溶液去分析;B、从饱和溶液是一定温度下不能再溶解这种溶质的溶液去分析;C、从物质的溶解度随温度升高而增大的物质的不饱和溶液降温后可能变成饱和溶液去分析;D、从饱和氢氧化钙溶液升温后溶质会析出,仍是饱和溶液去分析.【解答】解:A、极稀的溶液可能是饱和溶液,如饱和氢氧化钙溶液中含有溶质很少,是极稀的溶液;故正确;B、饱和溶液是一定温度下不能再溶解这种溶质的溶液;题目中没有说明一定温度;故错误;C、物质的溶解度随温度升高而增大的物质的不饱和溶液降温后可能变成饱和溶液;故正确;D、饱和溶液升高温度后不一定变成不饱和溶液,如饱和氢氧化钙溶液升温后溶质会析出,仍是饱和溶液;故错误;故答案为:AC.【点评】本题主要考查了饱和溶液、不饱和溶液、浓溶液、稀溶液之间的关系及饱和溶液与不饱和溶液之间的转化等,准确理解相关定义是解题的关键.5.能证实20℃时原KNO3的溶液是饱和溶液的事实是()A.降温到10℃时有KNO3晶体析出B.蒸发掉10克水,有KNO3晶体析出C.加热到30℃后,再加入KNO3晶体仍能继续溶解D.在20℃时,向上述KNO3溶液中加入少量KNO3晶体,溶液的质量不变.【考点】饱和溶液和不饱和溶液.【专题】溶液、浊液与溶解度.【分析】饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液,据此进行分析解答.【解答】解:饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液.A、硝酸钾的溶解度随着温度的降低而减小,接近饱和的硝酸钾溶液,降温至10℃时也可能有晶体析出,不能证实20℃时原KNO3的溶液是饱和溶液,故选项错误.B、蒸发掉10克水,有KNO3晶体析出,原溶液可能是饱和溶液,也可能是接近饱和的溶液,不能证实20℃时原KNO3的溶液是饱和溶液,故选项错误.C、硝酸钾的溶解度随着温度的升高而增大,加热到30℃后,硝酸钾的饱和溶液与不饱和溶液再加入KNO3晶体,均能继续溶解,不能证实20℃时原KNO3的溶液是饱和溶液,故选项错误.D、在20℃时,向上述KNO3溶液中加入少量KNO3晶体,溶液的质量不变,说明加入的KNO3晶体没有溶解,说明原溶液为20℃时的饱和溶液,故选项正确.故选:D.【点评】本题是对饱和溶液概念的理解,理解饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液是解题的关键.6.在一定温度下,使固体物质的饱和溶液变为不饱和溶液最可靠的方法是()A.加入溶质或蒸发溶剂 B.加入溶剂C.都采用升高温度的方法 D.都采用降低温度的方法【考点】饱和溶液和不饱和溶液相互转变的方法.【专题】溶液、浊液与溶解度.【分析】在一定温度下,固体物质的饱和溶液变为不饱和溶液:增加溶剂或升高温度,都可使饱和溶液变成不饱和溶液;对于溶解度随温度升高而增大的物质,升温可使饱和溶液变成不饱和溶液;对于溶解度随温度升高而减小的物质,降温可使饱和溶液变成不饱和溶液.【解答】解:A、向固体物质的饱和溶液中加入溶质或蒸发溶剂,饱和溶液仍为饱和溶液,故选项一定不可行.B、向不饱和溶液中加入溶剂,溶液仍为不饱和溶液,故选项一定可行.C、对于溶解度随温度升高而增大的物质,升温可使饱和溶液变成不饱和溶液;对于溶解度随温度升高而减小的物质,降温可使饱和溶液变成不饱和溶液;故选项不一定可行.D、对于溶解度随温度升高而增大的物质,升温可使饱和溶液变成不饱和溶液;对于溶解度随温度升高而减小的物质,降温可使饱和溶液变成不饱和溶液;故选项不一定可行.故选:B.【点评】本题难度不大,掌握大多数物质饱和溶液变成不饱和溶液一般采取:增加溶剂、改变温度是正确解答本题的关键.7.20℃时氯化钠的溶解度是36g,则氯化钠属于()A.易溶物质 B.可溶物质 C.微溶物质 D.难溶物质【考点】物质的溶解性及影响溶解性的因素.【专题】溶液、浊液与溶解度.【分析】物质的溶解性是根据在20℃(室温)时的溶解度来划分的,溶解度大于10g,属于易溶物质;溶解度大于1g,属于可溶物质;溶解度在0.01g~1g之间的,属于微溶物质;小于0.01g的,属于难溶物质(习惯上叫不溶);据此进行分析判断.【解答】解:物质的溶解性是根据在20℃(室温)时的溶解度来划分的,由题意20℃时氯化钠的溶解度是36g,溶解度大于10g,属于易溶物质.A、20℃时氯化钠的溶解度是36g,大于10g,则氯化钠属于易溶物质,故选项正确.B、20℃时氯化钠的溶解度是36g,大于10g,则氯化钠属于易溶物质,不属于可溶物质,故选项错误.C、20℃时氯化钠的溶解度是36g,大于10g,则氯化钠属于易溶物质,不属于微溶物质,故选项错误.D、20℃时氯化钠的溶解度是36g,大于10g,则氯化钠属于易溶物质,不属于难溶物质,故选项错误.故选:A.【点评】本题难度不大,熟悉固体物质溶解性的分类与分类依据(室温时的溶解度)是正确解答本题的关键.8.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳,溶解度随温度的升高而增大的是()A.①② B.③④ C.①③④ D.只有①【考点】固体溶解度的影响因素;气体溶解度的影响因素.【专题】溶液、浊液与溶解度.【分析】根据常见固体物质的溶解度受温度影响的变化趋势,气体的溶解度随温度的升高而减小,进行分析判断即可.【解答】解:①硝酸钾的溶解度随着温度的升高而增大;②熟石灰的溶解度随着温度的升高而减小.③氧气、④二氧化碳均为气体,气体的溶解度随温度的升高而减小.故只有①的溶解度随温度的升高而增大.故选:D.【点评】本题难度不大,掌握固体物质的溶解度受温度影响的变化趋势、气体的溶解度随温度的升高而减小是正确解答本题的关键.二、非选择题9.一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液叫饱和溶液.还能继续溶解某种溶质的溶液叫不饱和溶液.【考点】饱和溶液和不饱和溶液.【专题】溶液、浊液与溶解度.【分析】根据饱和溶液与不饱和溶液的概念进行分析解答即可.【解答】解:我们把在一定温度下,在一定量的溶剂里,不能再继续溶解某种溶质的溶液,叫做饱和溶液;还能继续溶解某种溶质的溶液,叫做该溶质的不饱和溶液.故答案为:一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液;还能继续溶解某种溶质的溶液.【点评】本题年度版的,掌握饱和溶液与不饱和溶液俄概念即可正确解答本题.10.一般地说,要确定某一溶液是否饱和,只要看在一定温度下,有没有继续溶解的溶质存在,如有,且溶质的量不再减少,那么这种溶液就是饱和溶液.【考点】饱和溶液和不饱和溶液.【专题】溶液、浊液与溶解度.【分析】根据饱和溶液与不饱和溶液的概念及特点,说明饱和溶液与不饱和溶液的转变方法及饱和溶液的判断方法.【解答】解:要确定某一溶液是否饱和,只要看在一定温度下,有没有继续溶解的溶质存在,如有,且溶质的量不再减少,那么这种溶液就是饱和溶液.答案:一定温度;溶质;溶质.【点评】本题难度不大,掌握饱和溶液与不饱和溶液的概念并能灵活运用是去解答本题的关键.11.在一定温度下,向某溶液中加入足量该溶质,振荡后加入的溶质质量并不减少,则原溶液是饱和溶液;再将该混合物加热,未溶的溶质全部溶解,这说明该物质的溶解度随着温度的升高而增大..【考点】饱和溶液和不饱和溶液.【专题】溶液、浊液与溶解度.【分析】根据饱和溶液的定义、以及物质溶解度与温度的关系来分析解答.【解答】解:在一定温度下,向某溶液中加入足量该溶质,振荡后加入的溶质质量并不减少,则原溶液是饱和溶液,再将该混合物加热,未溶的溶质全部溶解,这说明该物质的溶解度随着温度的升高而增大;答案:饱和;该物质的溶解度随着温度的升高而增大.【点评】本题考查了饱和溶液和不饱和溶液的相关知识,判断溶液是否饱和要看一定温度下,一定量溶剂里还能否继续溶解某物质的溶液.12.饱和溶液如何转化为不饱和溶液?不饱和溶液如何转化为饱和溶液?【考点】饱和溶液和不饱和溶液相互转变的方法.【专题】溶液、浊液与溶解度.【分析】大多数物质的溶解度随着温度的升高而增大,由大多数物质饱和溶液变为不饱和溶液、不饱和溶液转化为饱和溶液的方法,进行分析解答.【解答】解:大多数物质的溶解度随着温度的升高而增大,一般将饱和溶液转化为不饱和溶液,可以采用升高温度的方法,升高温度,溶解度增大,能将饱和溶液转化为不饱和溶液;增加溶剂,能将饱和溶液转化为不饱和溶液.大多数物质的溶解度随着温度的升高而增大,一般将不饱和溶液转化为饱和溶液,常用的方法有:增加溶质、蒸发溶剂、降低温度.故答案为:升高温度、增加溶剂;增加溶质、蒸发溶剂、降低温度.【点评】本题难度不大,掌握大多数物质饱和溶液与不饱和溶液相互转化的方法是正确解答本题的关键.13.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液吗?【考点】浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系.【专题】溶液、浊液与溶解度.【分析】浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,据此进行分析解答.【解答】解:浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,浓溶液不一定是饱和溶液,也可能是稀溶液;稀溶液不一定是不饱和溶液,也可能是饱和溶液,如氢氧化钙的饱和溶液就为稀溶液.故答案为:浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液.【点评】本题难度不大,掌握浓稀溶液与溶液是否饱和的关系是正确解答本题的关键.14.溶解度表示在一定温度下,某固态物质在100g溶剂里达到时饱和状态所溶解度的质量.如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度.【考点】固体溶解度的概念.【专题】溶液、浊液与溶解度.【分析】溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;溶解度定义中的四要素:一定温度、100g溶剂、溶液达到饱和状态、溶解的质量及单位克.【解答】解:溶解度表示在一定温度下,某固态物质在100g溶剂里达到饱和状态所溶解的溶质质量.如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度.故答案为:一定温度;100g溶剂;饱和状态;水.【点评】本题难度不大,了解溶解度的概念,熟记溶解度的四要素(温度、100g溶剂、饱和状态、单位是克)是正确解答本题的关键.15.20℃时氯化钠的溶解度是36g,它的涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态.【考点】固体溶解度的概念.【专题】溶液、浊液与溶解度.【分析】溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;要熟记溶解度定义中的四要素:一定温度、100g溶剂、溶液达到饱和状态、溶解的质量及单位克.【解答】解:根据溶解度的概念,20℃时氯化钠的溶解度是36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态.故答案为:20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态.【点评】本题难度不大,理解溶解度的概念,熟记溶解度的四要素:温度、100g溶剂、饱和状态、溶解的质量是正确解答本题的关键.16.气体的溶解度是指在压强为101KPa和一定温度时气体溶解在1体积水里达到饱和状态时的气体体积.【考点】气体溶解度的影响因素.【专题】溶液、浊液与溶解度.【分析】根据气体溶解度的概念进行判断.【解答】解:气体的溶解度是指压强为101kPa时,一定温度下,气体溶解在1体积水里达到饱和状态时,所溶解的气体体积,故本说法正确.【点评】本题考查了气体溶解度的影响因素.解题的关键是了解气体溶解度的含义.17.0℃时,氧气的溶解度为0.049的含义是什么?在0℃,当氧气的压力为101kPa时,1体积水中最多可溶解0.049体积的氧气,此时溶液达到饱和溶液.【考点】气体溶解度的影响因素.【专题】溶液、浊液与溶解度.【分析】根据气体溶解度的概念:气体的溶解度是指在一定温度和压强为101kPa时,某气体在1体积水里达到饱和状态时所溶解的体积,进行分析解答即可.【解答】解:气体的溶解度是指在一定温度和压强为101kPa时,某气体在1体积水里达到饱和状态时所溶解的体积,则0℃时,氧气的溶解度为0.049,这说明在0℃,当氧气的压力为101kPa时,1体积水中最多可溶解0.049体积的氧气,此时溶液达到饱和溶液.故答案为:在0℃,当氧气的压力为101kPa时,1体积水中最多可溶解0.049体积的氧气,此时溶液达到饱和溶液.【点评】本题难度不大,掌握气体溶解度的概念并能灵活运用即可正确解答本题.18.在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是36 g.【考点】固体溶解度的概念.【专题】溶液、浊液与溶解度.【分析】溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;溶解度定义中的四要素:一定温度、100g溶剂、溶液达到饱和状态、溶解的质量及单位克.【解答】解:溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是36g.故答案为:36.【点评】本题难度不大,理解溶解度的概念,熟记溶解度的四要素(温度、100g溶剂、饱和状态、单位是克)是正确解答本题的关键.19.在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是13.3 g.【考点】固体溶解度的概念.【专题】溶液、浊液与溶解度.【分析】根据固体溶解度的概念分析即可,溶解度表示在一定温度时,某固体物质在一定在100克溶剂里达到饱和状态时所溶解的质量.【解答】解:固体溶解度的概念,溶解度表示在一定温度时,某固体物质在一定在100克溶剂里达到饱和状态时所溶解的质量.在0℃时,100g水中最多可溶解13.3g硝酸钾,说明在0℃时,100g 水中溶解13.3g硝酸钾正好达到饱和状态,则0℃时硝酸钾溶解度是13.3g;故填:13.3.【点评】本题考查溶解度的概念,难度不大;溶解度的概念包括四个要素:①一定温度;②溶剂为100 g;③达到饱和状态;④单位为g.20.20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?温度溶质的质量溶剂的质量溶液的质量【考点】固体溶解度的概念.【专题】溶液、浊液与溶解度.【分析】据固体溶解度的概念分析即可,溶解度表示在一定温度时,某固体物质在溶解在100克溶剂里达到饱和状态时所溶解的质量.【解答】解:溶解度表示在一定温度时,某固体物质在溶解在100克溶剂里达到饱和状态时所溶解的质量.20℃时硝酸钾的溶解度是31.6g,是指20℃时,100g水中溶解31.6g硝酸钾正好达到饱和状态;故答案为:20℃时,100g水中溶解31.6g硝酸钾正好达到饱和状态.【点评】溶解度的概念包括四个要素:①指明一定温度;②溶剂为100 g;③必须达到饱和状态;④单位为g.21.如图,A、B是两种物质的溶解度曲线图,(1)A物质的溶解度曲线表明A物质的溶解度随温度的升高而增大(2)M点表示在t ℃时,A和B和溶解度相等,在大于t℃时A物质的溶解度大于B物质的溶解度.在小于t℃时A物质的溶解度小于B物质的溶解度.【考点】固体溶解度曲线及其作用.【专题】溶液、浊液与溶解度.【分析】根据题目信息和溶解度曲线可知:A固体物质的溶解度,是随温度升高而增大,而B的溶解度随温度的升高而减少;M点表示在t℃时,A和B和溶解度相等;在大于t℃时,A物质的溶解度大于B物质的溶解度;在小于t℃时,A物质的溶解度小于B物质的溶解度.【解答】解:(1)A物质的溶解度曲线表明A物质,的溶解度随温度的升高而增大;故答案为:的溶解度随温度的升高而增大;(2)M点表示在t℃时,A和B和溶解度相等;在大于t℃时,A物质的溶解度大于B物质的溶解度;在小于t℃时,A物质的溶解度小于B物质的溶解度;故答案为:t;相等;大于t℃时;小于t℃时;【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了溶解度大小的比较等,有关的计算要准确,本考点主要出现在选择题和填空题中.22.如图是A、B、C三种物质在水中的溶解度曲线,请回答:(1)M点的含义是t2℃时A与C两物质溶解度相等.(2)当温度为t1℃,三种物质溶解度由小到大依次为B<A<C ,当温度为t3℃时,溶解度最大的是 A .(3)C可能表示哪种物质:氢氧化钙.【考点】固体溶解度曲线及其作用.【专题】溶液、浊液与溶解度.【分析】(1)溶解度曲线交点M的含义:溶解度曲线交于一点表明两物质的溶解度此时相等;(2)根据溶解度曲线可以比较同一温度下不同物质的溶解度大小;(3)根据氢氧化钙或气体的溶解度随温度的升高而减小解答.【解答】解:(1)t2℃时A与C两物质溶解度曲线的交点,说明此时它们的溶解度相等.。

9.2 溶解度同步卷4一.选择题(共10小题)1.如图是甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是()A.15℃时,甲、乙两种饱和溶液中溶质质量相等B.甲物质的溶解度大于乙物质的溶解度C.将30℃的等质量甲、乙两种溶液降温至15℃时,析出晶体的质量甲一定大于乙D.乙中含有少量甲,可用蒸发结晶的方法提纯乙2.t1℃时,将a、b两种固体物质各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图甲所示;升温到t2℃时(忽略水分蒸发),现象如图乙所示;图丙是a、b两种固体物质在水中的溶解度曲线。
下列说法正确的是()A.图丙中曲线N表示b物质的溶解度曲线B.图甲中两烧杯内a、b溶液的溶质质量分数相等C.图乙中烧杯内b溶液的溶质质量分数为25%D.可用降温结晶的方法从饱和a溶液中得到固体a3.侯氏制碱法制取的碳酸钠中含有少量的氯化钠,称取50g侯氏制碱法制取的碳酸钠溶于40℃的100g水中配制得溶液。
下列说法正确的是()A.碳酸钠和氯化钠的溶解度不同B.将溶液降温至10℃,结晶后过滤可提纯碳酸钠C.配制的溶液是40℃时碳酸钠的饱和溶液D.向溶液中滴加无色酚酞试液检验是否含有氯化钠4.NaCl和KNO3的溶解度数据表和溶解度曲线如图所示,下列说法错误的是()0102030405060温度/℃溶解度/g物质NaCl35.735.836.036.336.637.037.3 KNO313.320.931.645.863.985.5110A.甲是KNO3的溶解度曲线B.KNO3的溶解度大于NaCl的溶解度C.20℃时,向100g水中加入20g NaCl,形成不饱和溶液D.NaCl中混有少量的KNO3,可采用蒸发结晶的方法提纯5.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是()A.甲物质的溶解度为50克B.甲物质的溶解度大于乙物质的溶解度C.t2℃时,在100g饱和溶液中含有50g甲物质D.t1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液6.如图是MgCl2、KCl和MgSO4的溶解度曲线。
【若缺失公式、图片现象属于系统读取不成功,文档内容齐全完整,请放心下载。
】课题2《溶解度》一、选择题1.下列有关溶液的叙述正确的是()A.稀溶液一定是不饱和溶液B.饱和溶液就是不能再溶解如何物质的溶液C.溶质的溶解度都随温度的升高而增大D.溶质在溶解的过程中,有的放出热量,有的吸收热量考查目的:饱和溶液和不饱和溶液、溶解度、溶解过程的吸热和放热。
答案: D解析:稀溶液不一定是不饱和溶液,浓溶液也不一定是不饱和溶液;饱和溶液是一定温度下、一定量溶剂中不能继续溶解该种溶质的溶液;固体溶质的溶解度受温度影响,有的随温度升高而增大,有的随温度升高而降低,有的受温度影响不大;溶质在溶解的过程中,有的放出热量,有的吸收热量。
2.结合下图判断,下列说法正确的是()A.硝酸钾的溶解度为45.8gB.硝酸钾的溶解度大于氯化钠的溶解度C.升高温度可将硝酸钾的不饱和溶液变为饱和溶液D.两条曲线的交点表示在该温度下两种物质的溶解度相等考查目的:饱和溶液、溶解度及曲线的应用。
答案: D解析:A项应该是30℃硝酸钾的溶解度为45.8g,B项比较溶解度必须指明温度,升高温度,硝酸钾的溶解度随温度升高而增大,升高温度不饱和溶液会变得更加不饱和,两条曲线的交点的含义就是表示在该温度下两种物质的溶解度相等。
3.对“20℃时,硝酸钾溶解度为31.6g”这句话解释正确的是()A.20℃时,100g硝酸钾溶液中含有31.6g硝酸钾B.在100克水中溶解31.6g硝酸钾就达到饱和状态。
C.20℃时,100克水中溶解31.6g硝酸钾就达到饱和状态。
D.20℃时,31.6g硝酸钾被水溶解考查目的:对溶解度的理解。
答案:C。
解析:溶解度概念中包含四个因素:一定温度下、饱和、100g水、单位是g。
这句话可以理解成20℃时,100克水中溶解31.6g硝酸钾就达到饱和状态,或者说20℃时,100克水中最多溶解31.6g 硝酸钾。
4.有关溶液的说法正确的是()A.具有均匀性、稳定性的液体一定是溶液B.配制溶液时,搅拌可以增大固体溶质的溶解度C.饱和溶液的浓度一定比不饱和溶液的浓度大D.融雪剂的原理是利用某些物质水溶液的凝固点低于0℃考查目的:饱和溶液和不饱和溶液、溶解度。
课题2 溶解度第1课时饱和溶液与不饱和溶液01知识管理1.饱和溶液与不饱和溶液定义:在__一定温度__下,向__一定量的溶剂__里加入某种溶质,当溶质__不能继续溶解__时,所得到的溶液叫做这种溶质的饱和溶液;还能__继续溶解__的溶液,叫做这种溶质的不饱和溶液。
注意:(1)明确前提条件:一定温度和一定量的溶剂。
若改变溶剂的量或温度,饱和溶液与不饱和溶液可以相互转化。
(2)明确“这种溶质”。
饱和溶液是针对某种溶质饱和,对另一种溶质可能不饱和。
如:在一定条件下氯化钠的饱和溶液,仍能溶解硝酸钾,即该溶液是氯化钠的饱和溶液,是硝酸钾的不饱和溶液。
饱和的标志:在一定温度下,若溶液中有不能__继续溶解__的剩余__溶质__存在,且剩余溶质的量__不再减少__,则该溶液就是该溶质在该温度下的饱和溶液。
相互转化:一般情况下,当温度和溶剂的量发生改变时,饱和溶液与不饱和溶液可以相互转化,其转化关系为:2.结晶定义:溶液中的溶质由于__温度__或__溶剂__的变化而从溶液中__析出__的过程。
方法:结晶的方法有两种:一是__蒸发溶剂__,二是__冷却热饱和溶液__。
02基础题考点1饱和溶液与不饱和溶液1.某物质的饱和溶液一定是(D)A.浓溶液B.稀溶液C.含100克水的溶液D.不能再溶解该物质的溶液2.(2018·温州)某“天气瓶”通过樟脑在酒精溶液中的结晶情况反映气温变化。
如图为该“天气瓶”在三种不同气温下的状况,则瓶内溶液一定为相应气温下樟脑饱和溶液的是(C)A.甲、乙 B.甲、丙C.乙、丙 D.甲、乙、丙3.T℃时,在两只各盛有50克水的烧杯中,分别加入30克氯化钠和蔗糖固体,搅拌使其充分溶解,结果如图所示。
下列说法正确的是(C)A.两烧杯中的溶液质量相等B.继续搅拌最终可使氯化钠溶解C.氯化钠溶液一定是该温度下的饱和溶液D.蔗糖溶液一定是该温度下的不饱和溶液4.20 ℃时,50 g水中溶解了18 g氯化钠恰好成为饱和溶液。
第九单元课题2 溶解度一、单选题1.在60 ℃时50克水中溶解硝酸钾55克,恰好饱和。
下列叙述正确的是()A.硝酸钾的溶解度是55克B.硝酸钾的溶解度是110克C.60 ℃时硝酸钾的溶解度是55克D.60 ℃时硝酸钾的溶解度是110克2.某温度下,将3 g A物质放入7 g水中,得到10 g溶液,该溶液是( )A.饱和溶液B.不饱和溶液C.浓溶液D.无法确定3.下列关于溶解度的说法正确的是()A.表示某物质在100g溶剂中所能溶解的最多克数B.表示一定温度时,100g溶剂与某物质制成的饱和溶液中溶解该物质的克数C.表示某温度时,某物质在100g溶剂中溶解的克数D.表示一定温度时,100g饱和溶液中溶解溶质的克数4.小红同学为证明某硝酸钾溶液是否达到饱和状态,设计了以下方案。
一定能达到目的的是()A.温度不变,向溶液中加入少量硝酸钾溶液B.温度不变,向溶液中加入少量硝酸钾晶体C.给溶液加热,直至有硝酸钾晶体析出D.给溶液降温,直至有硝酸钾晶体析出5.2004年6月5日世界环境日的主题为“海洋存亡,匹夫有责”。
下列说法正确的是( )A.海水是纯净物B.海水中的溶质只有氯化钠一种C.海水是饱和溶液D.海水晒盐的原理是蒸发溶剂得到晶体6.下列说法中,正确的是( )A.在100 g水里,最多能溶解36 g食盐,所以食盐的溶解度为36 gB.所有固体物质的溶解度都随着温度的升高而增大C.有过剩溶质与溶液共存的溶液一定是该温度时的饱和溶液D.20 ℃时100 g水里溶解了30 g硝酸钾,所以硝酸钾的溶解度是30 g7.氯化钠和碳酸钠晶体的溶解度(0℃—30℃)如下表所示: ()根据上表分析下列几种说法:①碳酸钠晶体的溶解度受温度影响较大②将含水各100 g的氯化钠与碳酸钠的饱和溶液,从30℃降至0℃,析出晶体的质量相等③氯化钠和碳酸钠晶体的溶解度相等时所对应的温度在20℃—30℃之间④欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式上述说法中,完全正确的一组是( )A.①②B.①②③C.①③④D.①②④8.取70 g某温度下的氯化钾饱和溶液,将其恒温蒸发10 g水,析出4 g氯化钾固体,则剩余溶液中所含溶质质量为( )A.16 gB.20 gC.40 gD.56 g9.在室温的条件下,试管里盛有一种无色透明的溶液,将试管放入盛有热水的烧杯中,可观察到试管里的溶液变浑浊。
课题2 溶解度5分钟训练1.下列因素不可能影响固体物质溶解性的是( )A.溶剂的量B.温度C.溶质的性质D.溶剂的性质解析:影响固体物质溶解性的因素是:溶质、溶剂的性质、温度,而溶剂的量不会产生影响。
答案:A2.饱和溶液是指( )A.浓度较大的溶液B.还能继续溶解某种溶质的溶液C.不能再溶解其他溶质的溶液D.一定温度下,一定量溶剂中不能再溶解某种溶质的溶液解析:饱和溶液是指一定温度下,一定量的某种溶剂中,对某种溶质不能继续溶解的溶液。
但可以继续溶解其他溶质,只是对某一特定溶质不能继续溶解。
答案:D3.40 ℃时,200 g硝酸钾饱和溶液,蒸发掉20 g水后,仍然冷却到40 ℃,则蒸发前后保持不变的是( )①溶液的质量②溶液中溶质在溶液中的质量分数③溶剂的质量④溶质的质量⑤硝酸钾的溶解度A.①②B.②③C.②⑤D.②④解析:温度不变,物质的溶解度不变。
虽然析出溶质,但饱和溶液的溶质的质量分数仍然不变。
答案:C4.下列说法是否正确?正确的,在( )中打“√”,错误的,在( )中打“×”。
(1)100 g水溶解了30 g某物质,则该物质的溶解度为30 g( )(2)任何物质的溶解度随温度升高都增大( )(3)饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液( )(4)饱和溶液析出晶体后,其溶质在整个溶液中的质量分数一定减小( )(5)温度相同的条件下,同一种物质的饱和溶液比不饱和溶液溶质的质量分数要大一些( )解析:(1)没有说明温度,也没有说明溶液是否饱和,所以错误。
(2)大多数物质的溶解度随温度升高而增大,少数物质的溶解度随温度升高而减小,如Ca(OH)2。
(3)判断是饱和溶液,还是不饱和溶液要看在某一温度和一定量溶剂中能否再溶解溶质,而浓、稀溶液是指一定量的溶液中含溶质的数量的多少,所以没有必然的联系。
(4)饱和溶液析出晶体后,还是饱和溶液,溶质的质量分数不变。
(5)温度相同的条件下,相同质量溶剂的同一种物质饱和溶液所含溶质较多,不饱和溶液所含溶质较少。
人教版九年级下《溶解度》精品同步测试一.选择题1.下列有关溶液的说法不正确的是()A.汽水和蔗糖水都属于溶液B.物质的溶解度不一定都随温度升高而增大C.在一定条件,饱和溶液与不饱和溶液之间可相互转化D.某物质在100g溶剂里达到饱和状态时所溶解的质量就是该物质的溶解度考点:悬浊液、乳浊液的概念及其与溶液的区别;饱和溶液和不饱和溶液;固体溶解度的概念;固体溶解度的影响因素.专题:生产、生活、环保类简答题.分析:A、根据溶液的特点回答;B、根据溶解度的影响因素来做题;C、根据饱和溶液与不饱和溶液的相互转化关系回答;D、根据溶解度的概念(在一定温度下,某固体溶质在100克溶剂里达到饱和状态所溶解的溶质质量.)来做题.解答:解:A、溶液的特点:均一性、稳定性、属于混合物,汽水和蔗糖水都是均一、稳定、混合物,故对;B、物质的溶解度不一定都随温度升高而增大:如熟石灰随温度的升高溶解度减小;故对C、改变温度、增加溶质的量或蒸发溶剂或增加溶剂饱和溶液与不饱和溶液之间可相互转化;故对D、根据溶解度的概念;可知溶解度必须指明温度;故错故选D点评:熟记溶液的特点:均一性、稳定性、属于混合物.知道饱和溶液与不饱和溶液的相互转化关系、溶解度的影响因素、溶解度的概念.2.(3分)在20℃时,测得50 g水中溶解18 g氯化钠恰好形成饱和溶液,从实验中可知()A.氯化钠的溶解度为18g B.氯化钠的溶解度为36gC.20℃时氯化钠的溶解度为18g D.20℃时氯化钠的溶解度为36g考点:固体溶解度的概念.专题:生活实际型;实验探究和数据处理题.分析:在叙述固体溶解度时,要指明在一定温度下,在100g溶剂中达到饱和状态,所溶解的质量.解答:解:A、溶解度是100g溶剂中溶的质量,还缺少温度,所以A是错误的;B、氯化钠的溶解度为36g,缺少温度,所以B是错误的;C、温度有了,但是18g是在50g水中所溶的质量,而溶解度是指在100g水中溶的质量,所以C也是错误的;D、在20℃时,测得50 g水中溶解18 g氯化钠恰好形成饱和溶液,所以在100g水中最多溶36g,20℃时氯化钠的溶解度为36g.故选D点评:固体溶解度的概念要注意四要素:一定温度、100g溶剂、饱和状态、单位为:g3.(3分)某温度下,将5g氯化钠放入10g水中,得到13.6g氯化钠溶液,该溶液一定是()A.饱和溶液B.不饱和溶液C.稀溶液D.无法判断考点:饱和溶液和不饱和溶液;浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系;固体溶解度的概念.专题:实验推断题.分析:饱和溶液和不饱和溶液的判断,主要看能不能继续溶解某种溶质.解答:解:由题意可知,在该温度下,5g氯化钠只溶解了3.6g,不能再继续溶解,所以所得溶液为饱和溶液.溶液的浓稀是指含溶质的多少而言,并没有具体的界限.溶液的“浓”、“稀”是相对的,如35%的硫酸溶液被认为是稀硫酸,而35%的盐酸则被认为是浓盐酸本题中的氯化钠溶液如果从生活的角度看,已经是很咸的溶液,应属于浓溶液.故不选C.故选A.点评:判断一种溶液是否是饱和,关键看能否继续溶解这种溶质,在一定温度下,在一定量的容剂不能再溶,就是该种溶质的饱和溶液.4.(3分)(2011•威海)下列哪种方法不可能用于分离饱和溶液中的溶质和溶剂()A.过滤B.蒸发C.蒸馏D.结晶考点:过滤的原理、方法及其应用.专题:实验性简答题.分析:A、根据不溶性杂质不会透过滤纸,溶液会通过滤纸进行分析,B、根据饱和溶液的溶质和溶剂成比例进行分析,C、根据蒸馏的原理进行分析,D、根据结晶的原理判断,解答:解:A、过滤只能将没有溶解的固体物质和溶液进行分离,而饱和溶液中溶质是均匀的分布在溶剂中的,不能够分离,故A错误,B、饱和的氯化钠溶液随着溶剂的蒸发,固体会逐渐的析出,故B正确,C、蒸馏是将水提纯的一个过程,将水分离出来,氯化钠就随之析出了,故C正确,D、结晶是将水分蒸发使晶体析出的过程,故D正确,故选A.点评:本体主要考查了在利用过滤、蒸发、蒸馏、结晶等提纯物质时的适用范围.5.(3分)某温度下,将3g A物质放入7g水中,得到10g溶液,该溶液是()A.饱和溶液B.不饱和溶液C.浓溶液D.无法确定考点:饱和溶液和不饱和溶液.专题:溶液、浊液与溶解度.分析:根据饱和溶液和不饱和溶液的判断,主要看能不能继续溶解某种溶质.解答:解:由题意可知,某温度下,将3gA物质放入7g水中,得到10g溶液,说明3gA物质全部溶解,那么形成的可能是饱和溶液,也可能是不饱和溶液.溶液的浓稀是指含溶质的多少而言,并没有具体的界限.溶液的“浓”、“稀”是相对的,如35%的硫酸溶液被认为是稀硫酸,而35%的盐酸则被认为是浓盐酸,所以该溶液无法确定.故选D.点评:判断一种溶液是否是饱和,关键看能否继续溶解这种溶质,在一定温度下,在一定量的容剂不能再溶,就是该种溶质的饱和溶液.6.(3分)测定20℃时硝酸钾在水中的溶解度时,所用的溶液一定是20℃时硝酸钾的()A.浓溶液B.稀溶液C.饱和溶液D.不饱和溶液考点:固体溶解度的概念.专题:结合课本知识的信息.分析:利用溶解度的概念解决,溶解度是一定条件下溶质溶解的最大量,即饱和状态下的溶质的数值.解答:解:溶解度是在一定温度100克溶剂下达到饱和状态时所溶解的溶质的量.故测定溶解度时溶液是饱和的,浓溶液与稀溶液是相对的时候溶质质量分数的大致表示,与溶解度关系不大.故选C点评:此题考查了对溶解度概念的理解,知道了溶解度是在饱和状态下测定的,同时也了解了浓溶液、稀溶液与饱和溶液、不饱和溶液的区别.7.(3分)把室温下的不饱和食盐水变成饱和溶液,最好的方法是()A.蒸发水B.加食盐C.给溶液降温D.给溶液升温考点:饱和溶液和不饱和溶液相互转变的方法.专题:溶液、浊液与溶解度.分析:氯化钠的溶解度随温度升高而增大,若将一杯不饱和的食盐水变成饱和溶液,可采取的方法为:增加溶质氯化钠、蒸发溶剂水或降低温度的方法实现.解答:解:A、将食盐水蒸发水,可以使溶剂的质量变少,而可能使溶液达到饱和,但是得考虑到温度影响操作较麻烦,故A方法不好;B、增加溶质食盐的量,可使不饱和食盐水变成饱和溶液,操作简单易行,故B方法好;C、把食盐水的温度降低,由于食盐溶解受温度影响不大,因此,降温可能能使不饱和食盐水变成饱和溶液,但也有可能降温后仍无法达到饱和的情况,故C方法不好;D、升高温度只能使溶液更不饱和,故D方法不对.故选B.点评:增加溶质或蒸发溶剂,都可使不饱和溶液变成饱和溶液;对于溶解度随温度升高而增大的物质而言,将其不饱和溶液变成饱和溶液通常还可采取降温.8.(3分)20℃时,食盐的溶解度是36g,它的含义是()A.20℃时,136g饱和食盐水中含有36g食盐B.在100g水中最多溶解36g食盐C.20℃时,饱和食盐水中含有36g食盐D.20℃时,100g饱和食盐水中含有36g食盐考点:固体溶解度的概念.专题:溶液、浊液与溶解度.分析:根据固体物质溶解度概念解答:固体物质溶解度是指在一定温度下,某物质在100g 溶剂中达到饱和状态时所溶解的溶质质量.解答:解:根据溶解度概念可知:20℃时,食盐的溶解度是36g其含义表示20℃时,36g食盐溶解在100g水里恰好形成136g饱和溶液.此饱和溶液中溶质质量为36g,溶剂水的质量为100g,溶液质量为136g.B、没有温度;C、没有饱和食盐水的质量;D、100g应是水的质量.故选A点评:注意溶解度四要素:温度、100g溶剂、饱和状态、溶质质量单位是克缺一不可,9.(3分)下列物质中,当温度升高时,其在水中的溶解度降低的是()A.C a(OH)2B.K NO3C.N aCl D.N H4NO3考点:固体溶解度的影响因素;固体溶解度曲线及其作用.专题:溶液、浊液与溶解度.分析:根据不同物质溶解度受温度影响情况而解答解答:解:氢氧化钙的溶解度随温度升高而减小,KNO3、NaCl、NH4NO3溶解度都随温度升高而增大.故选A点评:记住各种物质溶解度受温度影响的变化情况是解答本题关健.10.(3分)(2011•淄博)如图是某物质的溶解度曲线,60℃时,取100g水配制成该物质的饱和溶液,当温度降低至30℃时所得溶液的质量为()A.130g B.140g C.160g D.180g考点:固体溶解度曲线及其作用;溶液、溶质和溶剂的相互关系与判断.专题:生产实践型;压轴实验题;图表分析,寻找有效数据.分析:根据溶解度曲线的含义和右图可知:60℃时,该物质的溶解度是80克;也就是在60℃时,在100克水中溶解该物质80克就达到饱和状态.由图可知,该物质随温度的升高溶解度增大,所以当温度降低至30℃时,溶解度降低到40克,此时溶液的质量变为:100+40=140(克)解答:解:根据题意可知:60℃时,取100g水配制成该物质的饱和溶液时候,溶质等于其溶解度80克;由于该物质随温度的升高溶解度增大,当温度降低至30℃时,溶解度变为40克,有固体析出;所以此时溶剂的质量100克,溶质的质量为40克,溶液的质量=溶剂的质量+溶质的质量=100+40=140(克)故选:B点评:本题考查了学生对溶解度曲线图的掌握情况,由于该物质随温度的升高溶解度减小,所以当降温时仍是饱和溶液由图中的溶解度直接得出答案.二.填空题11.(3分)20℃时,硝酸钾的溶解度是31.6g,则20℃时,50g水中最多能溶解15.8g 硝酸钾.考点:固体溶解度的概念.专题:溶液、浊液与溶解度.分析:由硝酸钾在20℃时的溶解度可知,在20℃时,100克水中最多溶解31.6克硝酸钾.所以利用溶解度的计算公式可以计算出50克水中最多能溶解的硝酸钾的质量.解答:解:在20℃时,100克水中最多溶解31.6克硝酸钾,所以20℃时,50g水中最多能溶解硝酸钾的质量为=15.8g.故答案为:15.8.点评:溶解度是在一定温度下,100克水中所溶解的溶质的最大量,所以溶解度有单位,单位为克.在计算时一定要写上单位.12.(3分)(2012•自贡)(1)20℃时,硝酸钾的溶解度为31.6g,其含义是:在20℃时,100g 水中溶解31.6g硝酸钾就达到饱和状态.(2)在t℃时,将一定质量的某不饱和硝酸钾溶液分成等质量的A、B两份.在恒温下,将A溶液蒸发掉5g水,析出1g晶体;在恒温下,将B溶液蒸发掉10g水,析出3g晶体.则t℃时硝酸钾的溶解度为40g.考点:固体溶解度的概念.专题:常规题型;压轴实验题.分析:(1)根据溶解度的定义:在一定温度下,100g溶剂中达到饱和状态所溶解的质量;(2)根据饱和溶液中100g水中最多溶解的质量考虑.解答:解:(1)根据溶解度的定义可知表示在20℃时,100g水中溶解31.6g硝酸钾就达到饱和状态,或100g水中最多溶解31.6g硝酸钾;(2)将A溶液蒸发掉5g水,析出1g晶体;在恒温下,将B溶液蒸发掉10g水,析出3g晶体.说明在析出1g晶体后的溶液属于饱和溶液,在饱和溶液蒸发时蒸发了5g 水析出晶体:3g﹣1g=2g,所以50g水中最多溶解20g硝酸钾,那么100g水中最多溶解40g所以溶解度为40g.故答案为:(1)100g水中溶解31.6g硝酸钾就达到饱和状态;(2)40.点评:解答本题关键是要了解溶解度定义中的四大因素:温度、100g溶剂、饱和状态、溶解的质量.13.(3分)在一定的温度下,检验某溶液是否为饱和溶液,最简单的方法是保持温度不变,向溶液中加少量该溶质,不能继续溶解则溶液为饱和溶液.考点:饱和溶液和不饱和溶液.专题:溶液、浊液与溶解度.分析:根据饱和溶液与不饱和溶液的概念及特点来解答该题.解答:解:根据饱和溶液是不能继续溶解该溶质的溶液,因此,可向溶液中加少量该溶质,不能继续溶解则溶液为饱和溶液;故答案为:保持温度不变,向溶液中加少量该溶质,不能继续溶解则溶液为饱和溶液.点评:熟练掌握饱和溶液和不饱和溶液的定义,然后根据定义能够判断溶液时否饱和.14.(3分)在通常情况下,采取蒸发溶剂和加入溶质的方法,可将不饱和溶液转化为饱和溶液.将一定温度下的饱和食盐水变成不饱和食盐水,最好的方法是加入溶剂.将一定温度下的硝酸钾不饱和溶液变成饱和溶液,最好的方法是加入足量硝酸钾.考点:饱和溶液和不饱和溶液相互转变的方法.分析:温度一定、溶剂的量一定,不能再溶解某种溶质的溶液是饱和溶液.还能继续溶解某种溶质的溶液是不饱和溶液;硝酸钾的溶解度随温度的升高而升高.解答:解:不饱和溶液与同条件下的饱和溶液相比,还能继续溶解溶质,所以转化为饱和溶液的方法可以是加入溶质或蒸发溶剂;所以不饱和的硝酸钾溶液变为饱和溶液最好的方法是加入硝酸钾.食盐的饱和溶液变为不饱和溶液的最好方法是加入溶剂.故答案为:蒸发溶剂;增加溶质;加入溶剂;加入足量硝酸钾.点评:要掌握好饱和溶液和不饱和溶液之间的相互转化.15.(3分)硝酸铵在10℃时的溶解度为140g,这说明在10℃时,将140g硝酸铵溶解在100g水中,就可以得到240g硝酸铵饱和溶液.考点:饱和溶液和不饱和溶液;固体溶解度的概念.专题:溶液、浊液与溶解度.分析:根据溶解度的定义及溶液质量的求法来解答本题.解答:解:在一定温度下,某固体溶质在100克溶剂里达到饱和状态所溶解的溶质质量,所以可以判断在10℃时140g溶解在100g水达到饱和状态,则溶液的质量为140g+100g=240g;故答案为:100;240.点评:要熟记溶解度定义中的四要素:温度、100g溶剂、饱和状态、溶解的质量.16.(3分)根据如图溶解度曲线填写:温度A与B的溶解度比较(用>,=,<表示)t1t2t3考点:固体溶解度曲线及其作用.专题:元素化合物知识型.分析:从溶解度曲线上可以看出每一温度下对应的溶质的溶解度,进而可以比较不同物质在同一温度下的溶解度大小.解答:解:温度为t1时,B物质的溶解度曲线在A的上方,此时A溶解度小于B溶解度;t2时,A、B两物质溶解度曲线相交,溶解度相等;t3时,A物质的溶解度曲线在B 的上方,此时A溶解度大于B溶解度;故答案为:<、=、>.点评:此题属于固体物质溶解度曲线的简单应用,从图中即可读出相关信息,较简单.17.(3分)气体的溶解度一般随着温度的升高减小,当温度不变时,随着压强的增大,气体的溶解度变大.考点:气体溶解度的影响因素.分析:当温度升高时,气体分子运动速率加大,容易自水面逸出,当压强一定时,气体的溶解度随着温度的升高而减小.当温度一定时,气体的溶解度随着气体的压强的增大而增大.这是因为当压强增大时,液面上的气体的浓度增大,因此,进入液面的气体分子比从液面逸出的分子多,从而使气体的溶解度变大.解答:解:当压强一定时,气体的溶解度随着温度的升高而减小.当温度一定时,气体的溶解度随着气体的压强的增大而增大.故答:减小,变大.点评:气体的溶解度大小,首先决定于气体的性质,同时也随着气体的压强和溶剂的温度的不同而变化.初中化学试卷金戈铁骑制作。