石墨烯是一种由碳原子构成的单层片状结构的新材料
- 格式:docx
- 大小:32.74 KB
- 文档页数:12

安徽高考第七题专项练习1.(09安徽)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下), 可由石墨剥离而成,具有极好的应用前景。
下列说法正确的是 D A .石墨烯与石墨互为同位素 B .0.12g 石墨烯中含有6.02×1022个碳原子 C 石墨烯是一种有机物D .石墨烯中的碳原子间以共价键结合 2.(10安徽)亚氨基锂(Li 2NH )是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li 2NH+H 2−−→←−− Li 2NH+LiH ,下列有关说法正确的是 B A. Li 2NH 中N 的化合价是1- B.该反应中H 2既是氧化剂又是还原剂 C.+Li 和H -的离子半径相等 D.此法储氢和钢瓶储氢的原理相同3.(11年安徽)科学家最近研制出可望成为高效火箭推进剂的N(NO 2)3(如图所示)。
已知该分子N —N —N 键角都是108.1°,下列有关的说法正确的是 C A .分子中N 、O 间形成的共价键是非极性键 B .分子中四个氮原子共平面C .该物质既有氧化性又有还原性D .15.2 g 该物质含有6.02×1022个原子 4.(12年安徽)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为: NaHCO 3+H 2 HCOONa+H 2O 下列有关说法正确的是 BA .储氢、释氢过程均无能量变化B .NaHCO 3、HCOONa 均含有离子键和共价键C .储氢过程中,NaHCO 3被氧化D .释氢过程中,每消耗0.1molH 2O 放出2.24L 的H 2 5.(13年安徽)我国科学家研制出一中催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O 2催化剂 CO2+H 2O 。
下列有关说法正确的是 C A .该反应为吸热反应 B .CO 2分子中的化学键为非极性键 C .HCHO 分子中既含α键又含π键 D .没生成1.8gH 2O 消耗2.24L O 2 6.(14年安徽)CO 2的资源化利用是解决温室效应的重要途径。

高考化学物质结构元素周期律试题赏析一、选择题1.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是()A.同一元素不可能既表现金属性,又表现非金属性B.第三周期元素的最高正化合价等于它所处的主族序数C.短周期元素形成离子后,最外层电子都达到8 电子稳定结构D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同2.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。
下列说法正确的是()A.石墨烯与石墨互为同位素B.0.12g 石墨烯中含有6.02×1022个碳原子C.石墨烯是一种有机物D.石墨烯中的碳原子间以共价键结合3.某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。
下列叙述中错误的是()A.它是副族元素B.它是第六周期元素C.它的原子核内有63 个质子D.它的一种同位素的核内有89 个中子4.下列有关化学用语使用正确的是()A.硫原子的原子结构示意图:B.NH4Cl 的电子式:C.原子核内有10 个中子的氧原子:D.对氯甲苯的结构简式:5.X、Y、Z、W、R 是5种短周期元素,其原子序数依次增大。
X 是周期表中原子半径最小的元素,Y 原子最外层电子数是次外层电子数的3倍,Z、W、R 处于同一周期,R与Y 处于同一族,Z、W原子的核外电子数之和与Y、R 原子的核外电子数之和相等。
下列说法正确的是()A.元素Y、Z、W 具有相同电子层结构的离子,其半径依次增大B.元素X 不能与元素Y 形成化合物X2Y2C.元素Y、R 分别与元素X 形成的化合物的热稳定性:X m Y>X m RD.元素W、R 的最高价氧化物的水化物都是强酸6.下表是元素周期表的一部分,有关说法正确的是()A.e 的氢化物比d的氢化物稳定B.a、b、e 三种元素的原子半径:e>b>aC.六种元素中,c 元素单质的化学性质最活泼D.c、e、f 的最高价氧化物对应的水化物的酸性依次增强7.我国稀土资源丰富。
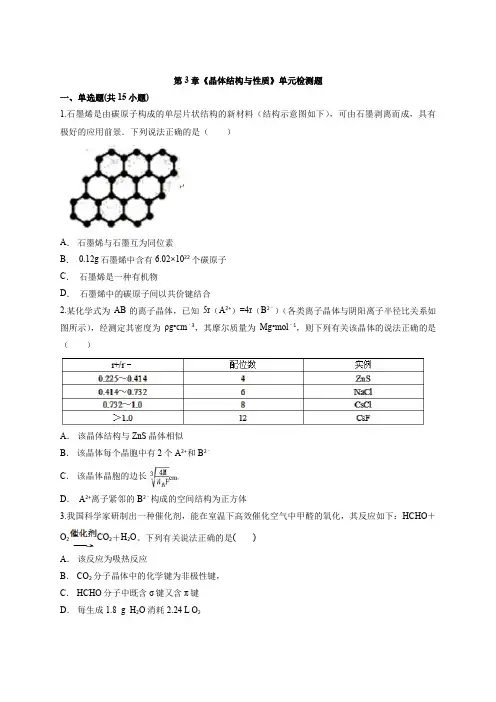
第3章《晶体结构与性质》单元检测题一、单选题(共15小题)1.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是()A.石墨烯与石墨互为同位素B. 0.12g石墨烯中含有6.02×1022个碳原子C.石墨烯是一种有机物D.石墨烯中的碳原子间以共价键结合2.某化学式为AB的离子晶体,已知5r(A2+)=4r(B2﹣)(各类离子晶体与阴阳离子半径比关系如图所示),经测定其密度为ρg•cm﹣3,其摩尔质量为Mg•mol﹣1,则下列有关该晶体的说法正确的是()A.该晶体结构与ZnS晶体相似B.该晶体每个晶胞中有2个A2+和B2﹣C.该晶体晶胞的边长D. A2+离子紧邻的B2﹣构成的空间结构为正方体3.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2CO2+H2O。
下列有关说法正确的是()A.该反应为吸热反应B. CO2分子晶体中的化学键为非极性键,C. HCHO分子中既含σ键又含π键D.每生成1.8 g H2O消耗2.24 L O24.下列有关金属键的叙述错误的是()A.金属键没有饱和性和方向性B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用C.金属键中的电子属于整块金属D.金属的物理性质和金属固体的形成都与金属键有关5.关于铜晶体的堆积方式说法正确的是()A.按ABABAB……方式堆积,配位数为12B.按ABABAB……方式堆积,配位数为8C.简单立方堆积,配位数为6D.按ABCABC……方式堆积,配位数为126.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。
由此可推测BeCl2()A.熔融态不导电B.水溶液呈中性C.熔点比BeBr2高D.不与NaOH溶液反应7.离子晶体中一定不存在的相互作用力是()A.离子键B.极性键C.非极性键D.范德华力8.下列关于晶格能的叙述中正确的是()A.晶格能仅与形成晶体的离子所带电荷数有关B.晶格能仅与形成晶体的离子半径有关C.晶格能是指相邻的离子间的静电作用D.晶格能越大的离子晶体,其熔点越高9.关于下图不正确的说法是()A.此种最密堆积为面心立方最密堆积B.该种堆积方式称为铜型C.该种堆积方式可用符号……ABCABC……表示D.该种堆积方式称为镁型10.如图所示,食盐晶体由钠离子和氯离子构成。

中学化学试卷(满分:150分)考生注意:可能用到的相对原子质量:H:1C:12N:14O:16Na:23Cl:35.5K:39Ca:40Mn:55Fe:56Cu:64Zn:65一、单项选择题(每小题2分,共50分)1.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如右图所示),可由石墨剥离而成,具有极好的应用前景。
下列说法正确的是( )。
A. 石墨烯与石墨互为同位素B. 0.12 g石墨烯中含6.02×1022个碳原子C. 石墨烯是一种有机物D. 石墨烯中碳原子间以共价键结合2.下列物质的实验室制法,正确的是( )。
A. 用石灰石跟稀硫酸反应制二氧化碳B. 用锌跟稀硝酸反应制氢气C. 用乙烷跟氯气在见光条件下反应制一氯乙烷D. 在过氧化氢的水溶液中加入少量MnO2制氧气3.某温度下,相同pH的盐酸和醋酸分别加水稀释,平衡pH随溶液体积变化的曲线如右图所示。
据图判断正确的是( )。
A. Ⅱ为盐酸稀释时的pH变化曲线B. b点溶液的导电性比c点溶液的导电性强C. a点Kw的数值比c点Kw的数值大D. b点酸的总浓度大于a点酸的总浓度4.同一周期的主族元素,从左到右,原子半径逐渐( ),金属性逐渐( )。
A. 增大增强B. 增大减弱C. 减小减弱D. 减小增强5.关于离子键与共价键的各种叙述中,正确的是( )。
A. 在离子化合物里,只存在离子键,没有共价键B. 熔融状态下,离子化合物可以导电C. 在共价化合物分子内,可能存在离子键D. Na2O2分子中只存在极性键6.可逆反应2A + B(s)3C达到平衡后,加压、升温,平衡均向正反应方向移动。
则下列结论正确的是( )。
A. A为气体,C为固体,正反应为放热反应B. A为固体,C为气体,正反应为放热反应C. A为气体,C为固体,正反应为吸热反应D. A、C均为气体,正反应为吸热反应7.在pH=13的无色溶液中,可以大量共存的一组离子是( )。


石墨烯电子能带结构的计算摘要:本文简要阐述了石墨烯的结构和主要特性,采用碳原子的SP2 杂化理论和能带理论,运用紧束缚近似方法计算了石墨的能带结构。
关键词:石墨烯,结构和性质,紧束缚近似,能带结构一、引言石墨烯是一种由碳原子构成的单层片状结构的新材料。
是一种由碳原子以SP2杂化轨道组成六角型呈蜂巢晶格的平面薄膜,只有一个碳原子厚度的二维材料。
石墨烯目前是世上最薄,最坚硬,电阻率最小的材料。
而且电子迁移的速度极快,因此被期待可用来发展出更薄、导电速度更快的新一代电子元件或晶体管。
由于石墨烯实质上是一种透明、良好的导体,也适合用来制造透明触控屏幕、光板、甚至是太阳能电池。
二、石墨烯结构石墨烯是由碳六元环组成的两维(2D)周期蜂窝状点阵结构, 它可以翘曲成零维(0D)的富勒烯(fullerene),卷成一维(1D)的碳纳米管(carbon nano-tube, CNT)或者堆垛成三维(3D)的石墨(graphite), 因此石墨烯是构成其他石墨材料的基本单元。
石墨烯的基本结构单元为有机材料中最稳定的苯六元环, 是目前最理想的二维纳米材料。
理想的石墨烯结构是平面六边形点阵,可以看作是一层被剥离的石墨分子,每个碳原子均为sp2杂化,并贡献剩余一个p轨道上的电子形成大π键,π电子可以自由移动,赋予石墨烯良好的导电性。
二维石墨烯结构可以看是形成所有sp2杂化碳质材料的基本组成单元。
三、石墨烯特性1、电子运输石墨烯表现出了异常的整数量子霍尔行为。
其霍尔电导为量子电导的奇数倍,且可以在室温下观测到。
这个行为已被科学家解释为“电子在石墨烯里遵守相对论量子力学,没有静质量”。
2、导电性石墨烯结构非常稳定。
石墨烯中各碳原子之间的连接非常柔韧,当施加外部机械力时,碳原子面就弯曲变形,从而使碳原子不必重新排列来适应外力,也就保持了结构稳定。
这种稳定的晶格结构使碳原子具有优秀的导电性。
石墨烯中的电子在轨道中移动时,不会因晶格缺陷或引入外来原子而发生散射。



一、选择题1.关于同分异构体和同系物,下列说法中不正确的是A .具有相同分子式,但结构不同的化合物互为同分异构体B .C 6H 5CH 2OH 和C 6H 5OH 在分子组成上相差一个CH 2原子团,故两者互为同系物 C .同分异构体之间的转化属于化学变化D .组成元素的质量分数相同,且相对分子质量也相同的不同化合物,互为同分异构体2.一定质量的甲烷燃烧后得到的产物为CO 、2CO ,和水蒸气,此混合气体质量为49.6g ,当其缓慢经过无水2CaCl 时,2CaCl 增重25.2g ,原混合气体中2CO 的质量为( ) A .12.5g B .13.2g C .19.7g D .24.4g3.下列有关化学用语表示正确的是( )A .3NH 分子的结构模型:B .3Al +的结构示意图:C .次氯酸钠的电子式:Na :O :Cl :D .HClO 的结构式:H —Cl —O 4.设阿伏伽德罗常数的值为N A ,则下列说法正确的是A .标准状况下,22.4L 氯仿中含有的氯原子数目为3N AB .7.8g 苯分子中碳碳双键的数目为0.3N AC .17.6g 丙烷中所含的极性共价键为4N AD .常温常压下,4.2gC 2H 4和C 9H 18混合物中含有的碳原子数为0.3N A5.下列各组有机物以任意比混合,若总物质的量一定,完全燃烧时生成水的质量和消耗氧气的质量不变的是A .C 3H 8、C 4H 6B .C 3H 6、C 4H 6O 2 C .C 2H 2、C 6H 6D .CH 4O 、C 4H 4O 5 6.通过测定血液或尿液中某物质的含量可诊断糖尿病患者的病情,该物质为( )A .蛋白质B .葡萄糖C .淀粉D .油脂 7.2019年在武汉举办的“世界军运会”开幕式上,主火炬(燃料是天然气)在水中点燃呈现“水交融”的景象,惊艳世界。
下列说法不正确的是A .天然气的主要成分是甲烷B .天然气易溶于水C .天然气燃烧是放热反应D .天然气燃烧的主要产物是CO 2和H 2O 8.2020 年伊始,新冠肺炎肆虐神州,一场疫情阻击战打响, 一时间消杀试剂成为紧俏物品。

2009年普通高等学校招生全国统一考试(安徽卷)理科综合能力测试相对原子质量(原子量):H 1 C 12 O 16 S 12 Cr 52 Fe 56 1. 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。
下列说法正确的是( ) A .石墨烯与石墨互为同位素B .0.12 g 石墨烯中含有6.02×1022个碳原子C 石墨烯是一种有机物D .石墨烯中的碳原子间以共价键结合 答案:D解析:同位素的研究对象是原子,A 选项错误;0.12 g 石墨烯的物质的量为0.01 mol ,所含碳原子个数为0.01 N A ,B 选项错误;有机物一般含有碳、氢元素,C 选项错误;由图示可知,石墨烯中碳原子间均为共价键结合,D 选项正确。
2. 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )A .含有碳碳双键、羟基、羰基、羧基B .含有苯环、羟基、羰基、羧基C .含有羟基、羰基、羧基、酯基D .含有碳碳双键、苯环、羟基、羰基 答案:A解析:从图示可以分析,该有机物的结构中存在3个碳碳双键、1个羰基、1个醇羟基、1个羧基。
A 选项正确。
3. 下列选用的相关仪器符合实验要求的是( )OOHCOOH(提示:是羰基) O答案:B解析:浓硝酸具有强氧化性,不能用橡胶塞,一般用玻璃塞,A选项错误;水和乙酸乙酯的互不相溶,用分液漏斗分离,B选项正确;量筒量取液体只能精确到0.1mL,C选项错误;实验室制取乙烯需要的温度为170℃,该温度计的量程不足,D选项错误。
4.在溶液中能大量共存的一组离子或分子是()A.NH4+、H+、NO3-、HCO3-B.K+、Al3+、SO42-、NH3·H2OC.Na+、K+、SO32-、Cl2D.Na+、CH3COO-、CO32-、OH-答案:D.解析:A项中H+与HCO3-能够反应生成CO2气体,不能大量共存,错误;Al3+与氨水可以发生反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,B选项错误;Cl2具有氧化性,可以将SO32-氧化为SO42-,方程式为:Cl2+H2O+SO32-=SO42-+Cl-+2H+,C选项错误。

石墨烯薄膜扬声器美国研究人员利用石墨烯制作了一种新型的薄膜扬声器,这种扬声器有着跨越整个音频范围(20赫兹-20千赫兹)的频率响应,并且有着优异的低功耗性能。
而这些特性,完全是源于材料的特殊性,而并非借助独特的设计获得。
基本原理石墨烯是一种由碳原子构成的单层片状结构的新材料,它是已知的世上最薄、最坚硬的纳米材料。
这种材料具有优异的透光性,吸收率仅为2.3%,导热系数高达5300 W/m·K,同时也是目前世上电阻率最小的材料。
这种扬声器,主要是利用了这种薄膜材料的机械性能和导电性能。
其原理如图1所示。
图1 石墨烯薄膜扬声器结构示意图扩音器通过振动一层极薄的石墨烯隔膜来工作。
当声波在空气中传播时,声波的振动在周围空气中产生压力波,并且,其频率依赖于声音的频率。
人类的耳朵能探测到介于20赫兹(极低的音调)和20千赫兹(极高的音调)之间的频率。
由于石墨烯薄膜的质量极小,因此,其本身的惯性对频率共振的影响差异也极小。
从而,在人类的可听频率范围内,石墨烯薄膜有着相当均匀的频率响应。
工艺技术来自伯克利(Berkeley)的研究人员采用化学蒸汽沉积的方法,制作了30纳米厚、7毫米宽的石墨烯薄膜;将这片石墨烯夹在两个涂有二氧化硅的驱动多孔硅电极之间,以防止石墨烯在非常大的驱动振幅下意外短路。
当电极通电之后,产生的静电力使得石墨烯片振动,进而产生声音。
通过改变所加电能的大小,就会产生不同的声音。
如前面所述,这些声音能被人耳轻易的捕捉到,同时也有着高保真度。
经过测试,这种扬声器(核心部件)的性能,不输于高质量的商业耳机(Sennheiser® MX-400)。
同时,由于石墨烯膜很薄,扬声器不需要人工阻尼(与商业配置不同)来消除系统的某些干扰频率,而仅有空气阻尼所造成的减幅。
这使得这种器件能在几纳安培的电流下运行,因而消耗了远少于传统扩音器所需的能量。
石墨烯拉伸结果
摘要:
一、石墨烯简介
二、石墨烯拉伸实验
三、石墨烯拉伸结果及应用
四、石墨烯拉伸技术前景
正文:
石墨烯是一种由碳原子构成的单层片状结构新材料,具有高强度、导电性、透明性等特点,一直被认为是假设性的结构,无法单独稳定存在。
然而,英国曼彻斯特大学物理学家安德烈·海姆和康斯坦丁·诺沃肖洛夫在2004 年成功地在实验中从石墨中分离出石墨烯,证实它可以单独存在,两人也因此获得了2010 年诺贝尔物理学奖。
石墨烯的拉伸实验是研究其性能和应用的关键环节。
通过拉伸实验,可以改变石墨烯的结构和性能,从而为实际应用提供可能。
近年来,研究人员在石墨烯拉伸方面取得了显著进展,包括成功地将石墨烯拉伸至前所未有的长度和强度。
石墨烯拉伸的结果令人振奋。
实验表明,石墨烯在拉伸过程中可以保持其优异的性能,如高强度、高导电性和透明性。
此外,拉伸石墨烯还具有许多新特性,如可变形性、弹性和柔韧性等。
这些特性使拉伸石墨烯在许多领域具有广泛的应用前景,如柔性显示屏、可穿戴设备、航空航天、汽车制造等。
石墨烯拉伸技术仍处于初级阶段,但已经展示出巨大的潜力。
未来,随着
研究的深入和技术的进步,石墨烯拉伸技术有望进一步优化和成熟,为人类带来更多便利和创新。
2009年黑龙江省某市特岗教师招聘考试中学化学试卷(满分:150分)考生注意:可能用到的相对原子质量:H:1C:12N:14O:16Na:23Cl:35.5K:39Ca:40Mn:55Fe:56Cu:64Zn:65一、单项选择题(每小题2分,共50分)1.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如右图所示),可由石墨剥离而成,具有极好的应用前景。
下列说法正确的是()。
A. 石墨烯与石墨互为同位素B. 0.12 g石墨烯中含6.02×1022个碳原子C. 石墨烯是一种有机物D. 石墨烯中碳原子间以共价键结合2.下列物质的实验室制法,正确的是()。
A. 用石灰石跟稀硫酸反应制二氧化碳B. 用锌跟稀硝酸反应制氢气C. 用乙烷跟氯气在见光条件下反应制一氯乙烷D. 在过氧化氢的水溶液中加入少量MnO2制氧气3.某温度下,相同pH的盐酸和醋酸分别加水稀释,平衡pH随溶液体积变化的曲线如右图所示。
据图判断正确的是()。
A. Ⅱ为盐酸稀释时的pH变化曲线B. b点溶液的导电性比c点溶液的导电性强C. a点Kw的数值比c点Kw的数值大D. b点酸的总浓度大于a点酸的总浓度4.同一周期的主族元素,从左到右,原子半径逐渐(),金属性逐渐()。
A. 增大增强B. 增大减弱C. 减小减弱D. 减小增强5.关于离子键与共价键的各种叙述中,正确的是()。
A. 在离子化合物里,只存在离子键,没有共价键B. 熔融状态下,离子化合物可以导电C. 在共价化合物分子内,可能存在离子键D. Na2O2分子中只存在极性键6.可逆反应2A + B(s)3C达到平衡后,加压、升温,平衡均向正反应方向移动。
则下列结论正确的是()。
A. A为气体,C为固体,正反应为放热反应B. A为固体,C为气体,正反应为放热反应C. A为气体,C为固体,正反应为吸热反应D. A、C均为气体,正反应为吸热反应7.在pH=13的无色溶液中,可以大量共存的一组离子是()。
一、选择题1.乙烯的结构简式是A.C2H4B.CH2=CH2C.CH2CH2D.2.下列物质或方法中不可以用来鉴别甲烷和乙烯的是A.溴水B.H2C.酸性KMnO4溶液D.燃烧法3.下列各组物质互为同分异构体的是()A.甲烷和乙烷B.乙烷和乙烯C.溴苯和硝基苯D.葡萄糖和果糖4.下列反应中,属于取代反应的是()A.乙烯与溴反应制1,2-二溴乙烷B.苯与浓硝酸、浓硫酸混合共热制取硝基苯C.乙烯使酸性高锰酸钾溶液褪色D.在一定条件下苯与氢气反应制取环己烷5.下列物质的化学用语表达正确的是A.甲烷的球棍模型:B.33(CH)COH的名称:2,2-二甲基乙醇C.乙醛的结构式:3CH CHOD.羟基的电子式:·····O:H6.下列过程属于物理变化的是A.乙烯聚合B.石油裂化C.石油分馏D.煤的干馏7.医用一次性口罩的结构如图所示,过滤层所用的材料是聚丙烯,具有阻隔病毒和细菌的作用。
下列有关说法不正确的是A.该口罩是一种混合物B.聚丙烯难溶于水C.该口罩用完后不应随意丢弃D.用“84”消毒液清洗该口罩上的污溃后可继续使用8.央视纪录片《稻米之路》全面展示了“稻米”这种古老食物所走过的奇妙之旅。
下列有关说法不正确的是A.淀粉属于糖类,但没有甜味B.淀粉是天然高分子化合物C.淀粉在人体内水解最终生成葡萄糖D.大米中所含的主要营养物质是纤维素9.下列由实验得出的结论正确的是选项实验结论A 将石蜡油蒸气依次通过加热的内含碎瓷片的玻璃管、盛有酸性高锰酸钾溶液的洗气瓶,高锰酸钾溶液褪色石蜡油中含有不饱和键的烃B 将胆矾晶体悬挂于盛有浓H2SO4的密闭试管中,蓝色晶体逐渐变为白色浓H2SO4具有吸水性C 将硫酸酸化的双氧水滴入硝酸亚铁溶液中,溶液黄色H2O2的氧化性比Fe3+强D 向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制 Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀蔗糖未水解A.A B.B C.C D.D10.下列各组物质中,互为同位素的是()A.白磷和红磷B.冰和干冰C.正丁烷和异丁烷D.16O和18O二、填空题11.近年来,乳酸成为研究热点之一。
石墨烯薄膜介绍
石墨烯薄膜是一种由碳原子构成的单层片状结构的新材料,其厚度仅为人类头发直径的三十万分之一。
这种材料具有极佳的导电和导热性能,被认为是目前世界上最薄、最坚硬、导电和导热最好的纳米材料。
石墨烯薄膜的制备方法有多种,包括化学气相沉积、物理气相沉积、剥离法等。
其中,化学气相沉积法是制备大面积、高质量石墨烯薄膜的关键技术。
石墨烯薄膜在新能源、电子信息、化工材料、高端装备、节能环保、医疗健康等领域有着巨大的应用空间。
例如,在电池领域,石墨烯薄膜可以作为电极材料,提高电池的能量密度和充电速度;在电子信息领域,石墨烯薄膜可以用于制造柔性电子器件和集成电路;在医疗领域,石墨烯薄膜可以用于药物载体和生物成像技术。
总之,石墨烯薄膜作为一种新型材料,具有广阔的应用前景和巨大的市场潜力,有望在未来引领新一轮科技革命和产业变革方向。
一、选择题1.乙烯的结构简式是A.C2H4B.CH2=CH2C.CH2CH2D.2.下列说法不正确的是A.蛋白质遇到双缩脲试剂会呈现紫玫瑰色B.可通过控制溶液的pH分离氨基酸C.将纤维素溶解在铜氨溶液中,将形成的溶液压入稀硫酸中,取出生成物用水洗涤重新得到蓝色的铜氨纤维D.物证技术中常用茚三酮显现指纹3.分子结构丰富多样。
下列分子呈正四面体结构的是A.乙醇B.乙烯C.甲烷D.乙酸4.医用一次性口罩的结构如图所示,过滤层所用的材料是聚丙烯,具有阻隔病毒和细菌的作用。
下列有关说法不正确的是A.该口罩是一种混合物B.聚丙烯难溶于水C.该口罩用完后不应随意丢弃D.用“84”消毒液清洗该口罩上的污溃后可继续使用5.下列反应属于取代反应的是A.乙烯和溴的四氯化碳溶液反应B.乙烯和酸性高锰酸钾溶液反应C.在光照条件下甲烷和氯气反应D.在镍作催化剂、加热的条件下苯和氢气的反应6.生活中的一些问题常常涉及到化学知识。
下列叙述中不正确的是A.糯米中的淀粉一经水解,就酿成了酒B.将米饭在嘴里咀嚼有甜味,是因为部分淀粉在唾液酶催化下水解生成麦芽糖C.棉花的主要成分是纤维素D.未成熟的苹果遇碘水会变蓝7.下列说法正确的是A.CH2=CH2、三种物质中都有碳碳双键,都可发生加成反应B.1 mol 与过量的NaOH溶液加热充分反应,能消耗3mol NaOHC.将溴水加入苯中,溴水的颜色变浅,这是由于发生了取代反应D.用溴水即可鉴别苯酚溶液、2,4一己二烯和甲苯8.2019年12月以来,我国部分地区突发的新冠病毒肺炎威胁着人们的身体健康。
下列有关说法正确的是()A.新型冠状病毒由C,H,O三种元素组成B.口罩中间的熔喷布具有核心作用,其主要原料为聚丙烯,属于有机高分子材料C.过氧化氢、乙醇、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的D.“84”消毒液(有效成分为NaClO)可以与洁厕灵(主要成分为盐酸)混合使用9.某些成人由于长期偏食,会形成“多酸症”,引起人体缺钙、血液黏度过大。
新材料石墨烯石墨烯及其应用石墨烯是一种由碳原子构成的单层片状结构的新材料,以sp2杂化轨道组成,六角型呈蜂巢晶格的平面薄膜,只有一个碳原子厚度的二维材料。
石墨烯一直被认为是假设性的结构,无法单独稳定存在,直至2004年,英国曼彻斯特大学物理学家安德烈·海姆和康斯坦丁·诺沃肖洛夫,成功地在实验中从石墨中分离出石墨烯,而证实它可以单独存在,两人也因“在二维石墨烯材料的开创性实验”为由,共同获得2010年诺贝尔物理学奖。
石墨烯目前是世上最薄却也是最坚硬的纳米材料,它几乎是完全透明的,只吸收2.3%的光";导热系数高达5300 W/m·K,高于碳纳米管和金刚石,常温下其电子迁移率超过15000 cm²/V·s,又比纳米碳管或硅晶体高,而电阻率只约10-6 Ω·cm,比铜或银更低,为目前世上电阻率最小的材料。
因为它的电阻率极低,电子迁移的速度极快,因此被期待可用来发展出更薄、导电速度更快的新一代电子元件或晶体管。
由于石墨烯实质上是一种透明、良好的导体,也适合用来制造透明触控屏幕、光板、甚至是太阳能电池。
石墨烯另一个特性,是能够在常温下观察到量子霍尔效应。
石墨烯的结构非常稳定,石墨烯内部的碳原子之间的连接很柔韧,当施加外力于石墨烯时,碳原子面会弯曲变形,使得碳原子不必重新排列来适应外力,从而保持结构稳定。
这种稳定的晶格结构使石墨烯具有优秀的导热性。
石墨烯是构成下列碳同素异形体的基本单元:石墨,木炭,碳纳米管和富勒烯。
完美的石墨烯是二维的,它只包括六边形(等角六边形); 如果有五边形和七边形存在,则会构成石墨烯的缺陷。
12个五角形石墨烯会共同形成富勒烯。
石墨烯卷成圆桶形可以用为碳纳米管;另外石墨烯还被做成弹道晶体管并且吸引了大批科学家的兴趣。
在2006年3月,佐治亚理工学院研究员宣布, 他们成功地制造了石墨烯平面场效应晶体管,并观测到了量子干涉效应,并基于此结果,研究出以石墨烯为基材的电路.一特性1电子运输在发现石墨烯以前,大多数(如果不是所有的话)物理学家认为,热力学涨落不允许任何二维晶体在有限温度下存在。
所以,它的发现立即震撼了凝聚态物理界。
虽然理论和实验界都认为完美的二维结构无法在非绝对零度稳定存在,但是单层石墨烯在实验中被制备出来。
这些可能归结于石墨烯在纳米级别上的微观扭曲。
石墨烯还表现出了异常的整数量子霍尔行为。
其霍尔电导=2e²/h,6e²/h,10e²/h.... 为量子电导的奇数倍,且可以在室温下观测到。
这个行为已被科学家解释为“电子在石墨烯里遵守相对论量子力学,没有静质量”。
石墨烯结构非常稳定,迄今为止,研究者仍未发现石墨烯中有碳原子缺失的情况。
石墨烯中各碳原子之间的连接非常柔韧,当施加外部机械力时,碳原子面就弯曲变形,从而使碳原子不必重新排列来适应外力,也就保持了结构稳定。
这种稳定的晶格结构使碳原子具有优秀的导电性。
石墨烯中的电子在轨道中移动时,不会因晶格缺陷或引入外来原子而发生散射。
由于原子间作用力十分强,在常温下,即使周围碳原子发生挤撞,石墨烯中电子受到的干扰也非常小。
石墨烯最大的特性是其中电子的运动速度达到了光速的1/300,远远超过了电子在一般导体中的运动速度。
这使得石墨烯中的电子,或更准确地,应称为“载荷子”(electric charge carrier),的性质和相对论性的中微子非常相似。
石墨烯是人类已知强度最高的物质,比钻石还坚硬,强度比世界上最好的钢铁还要高上100倍。
哥伦比亚大学的物理学家对石墨烯的机械特性进行了全面的研究。
在试验过程中,他们选取了一些直径在10—20微米的石墨烯微粒作为研究对象。
研究人员先是将这些石墨烯样品放在了一个表面被钻有小孔的晶体薄板上,这些孔的直径在1—1.5微米之间。
之后,他们用金刚石制成的探针对这些放置在小孔上的石墨烯施加压力,以测试它们的承受能力。
研究人员发现,在石墨烯样品微粒开始碎裂前,它们每100纳米距离上可承受的最大压力居然达到了大约2.9微牛。
据科学家们测算,这一结果相当于要施加55牛顿的压力才能使1微米长的石墨烯断裂。
如果物理学家们能制取出厚度相当于普通食品塑料包装袋的(厚度约100纳米)石墨烯,那么需要施加差不多两万牛的压力才能将其扯断。
换句话说,如果用石墨烯制成包装袋,那么它将能承受大约两吨重的物品。
2电子的相互作用利用世界上最强大的人造辐射源,美国加州大学、哥伦比亚大学和劳伦斯·伯克利国家实验室的物理学家发现了石墨烯特性新秘密:石墨烯中电子间以及电子与蜂窝状栅格间均存在着强烈的相互作用。
科学家借助了美国劳伦斯伯克利国家实验室的“先进光源(ALS)”电子同步加速器。
这个加速器产生的光辐射亮度相当于医学上X射线强度的1亿倍。
科学家利用这一强光源观测发现,石墨烯中的电子不仅与蜂巢晶格之间相互作用强烈,而且电子和电子之间也有很强的相互作用。
二制备方法石墨烯的研究热潮也吸引了国内外材料制备研究的兴趣,石墨烯材料的制备方法已报道的有:机械剥离法、化学氧化法、晶体外延生长法、化学气相沉积法、有机合成法和碳纳米管剥离法等。
1微机械剥离法2004年,Geim等首次用微机械剥离法,成功地从高定向热裂解石墨(highly oriented pyrolytic graphite)上剥离并观测到单层石墨烯。
Geim研究组利用这一方法成功制备了准二维石墨烯并观测到其形貌,揭示了石墨烯二维晶体结构存在的原因。
微机械剥离法可以制备出高质量石墨烯,但存在产率低和成本高的不足,不满足工业化和规模化生产要求,2004年只能作为实验室小规模制备。
2化学气相沉积法化学气相沉积法首次在规模化制备石墨烯的问题方面有了新的突破(参考化学气相沉积法制备高质量石墨烯)。
CVD法是指反应物质在气态条件下发生化学反应,生成固态物质沉积在加热的固态基体表面,进而制得固体材料的工艺技术。
麻省理工学院的Kong等、韩国成均馆大学的Hong等和普渡大学的Chen等在利用CVD法制备石墨烯。
他们使用的是一种以镍为基片的管状简易沉积炉,通入含碳气体,如:碳氢化合物,它在高温下分解成碳原子沉积在镍的表面,形成石墨烯,通过轻微的化学刻蚀,使石墨烯薄膜和镍片分离得到石墨烯薄膜。
这种薄膜在透光率为80%时电导率即可达到1.1×106S/m,成为透明导电薄膜的潜在替代品。
用CVD法可以制备出高质量大面积的石墨烯,但是理想的基片材料单晶镍的价格太昂贵,这可能是影响石墨烯工业化生产的重要因素。
CVD 法可以满足规模化制备高质量石墨烯的要求,但成本较高,工艺复杂。
3氧化-还原法氧化-还原法制备成本低廉且容易实现,成为制备石墨烯的最佳方法,而且可以制备稳定的石墨烯悬浮液,解决了石墨烯不易分散的问题。
氧化-还原法是指将天然石墨与强酸和强氧化性物质反应生成氧化石墨(GO),经过超声分散制备成氧化石墨烯(单层氧化石墨),加入还原剂去除氧化石墨表面的含氧基团,如羧基、环氧基和羟基,得到石墨烯。
氧化-还原法被提出后,以其简单易行的工艺成为实验室制备石墨烯的最简便的方法,得到广大石墨烯研究者的青睐。
Ruoff等发现通过加入化学物质例如二甲肼、对苯二酚、硼氢化钠(NaBH4)和液肼等除去氧化石墨烯的含氧基团,就能得到石墨烯。
氧化-还原法可以制备稳定的石墨烯悬浮液,解决了石墨烯难以分散在溶剂中的问题。
氧化-还原法的缺点是宏量制备容易带来废液污染和制备的石墨烯存在一定的缺陷,例如,五元环、七元环等拓扑缺陷或存在-OH基团的结构缺陷,这些将导致石墨烯部分电学性能的损失,使石墨烯的应用受到限制。
4溶剂剥离法溶剂剥离法的原理是将少量的石墨分散于溶剂中,形成低浓度的分散液,利用超声波的作用破坏石墨层间的范德华力,此时溶剂可以插入石墨层间,进行层层剥离,制备出石墨烯。
此方法不会像氧化-还原法那样破坏石墨烯的结构,可以制备高质量的石墨烯。
在氮甲基吡咯烷酮中石墨烯的产率最高(大约为8%),电导率为6500S/m。
研究发现高定向热裂解石墨、热膨胀石墨和微晶人造石墨适合用于溶剂剥离法制备石墨烯。
溶剂剥离法可以制备高质量的石墨烯,整个液相剥离的过程没有在石墨烯的表面引入任何缺陷,为其在微电子学、多功能复合材料等领域的应用提供了广阔的应用前景。
缺点是产率很低。
5溶剂热法溶剂热法是指在特制的密闭反应器(高压釜)中,采用有机溶剂作为反应介质,通过将反应体系加热至临界温度(或接近临界温度),在反应体系中自身产生高压而进行材料制备的一种有效方法。
溶剂热法解决了规模化制备石墨烯的问题,同时也带来了电导率很低的负面影响。
为解决由此带来的不足,研究者将溶剂热法和氧化还原法相结合制备出了高质量的石墨烯。
Dai等发现溶剂热条件下还原氧化石墨烯制备的石墨烯薄膜电阻小于传统条件下制备石墨烯。
溶剂热法因高温高压封闭体系下可制备高质量石墨烯的特点越来越受科学家的关注。
溶剂热法和其他制备方法的结合将成为石墨烯制备的又一亮点。
6其它方法石墨烯的制备方法还有高温还原、光照还原、外延晶体生长法、微波法、电弧法、电化学法等。
笔者在以上基础上提出一种机械法制备纳米石墨烯微片的新方法,并尝试宏量生产石墨烯的研究中取得较好的成果。
如何综合运用各种石墨烯制备方法的优势,取长补短,解决石墨烯的难溶解性和不稳定性的问题,完善结构和电性能等是今后研究的热点和难点,也为今后石墨烯的制备与合成开辟新的道路。
三应用前景1纳电子器件方面2005年,Geim研究组与Kim研究组发现,室温下石墨烯具有10倍于商用硅片的高载流子迁移率(约10 am /V·s),并且受温度和掺杂效应的影响很小,表现出室温亚微米尺度的弹道传输特性(300 K下可达0.3 m),这是石墨烯作为纳电子器件最突出的优势,使电子工程领域极具吸引力的室温弹道场效应管成为可能。
较大的费米速度和低接触电阻则有助于进一步减小器件开关时间,超高频率的操作响应特性是石墨烯基电子器件的另一显著优势。
此外,石墨烯减小到纳米尺度甚至单个苯环同样保持很好的稳定性和电学性能,使探索单电子器件成为可能。
利用石墨烯加入电池电极材料中可以大大提高充电效率,并且提高电池容量。
自我装配的多层石墨烯片不仅是锂空气电池的理想设计,也可以应用于许多其他潜在的能源存储领域如超级电容器、电磁炮等。
此外,新型石墨烯材料将不依赖于铂或其他贵金属,可有效降低成本和对环境的影响。
2代替硅生产超级计算机科学家发现,石墨烯还是目前已知导电性能最出色的材料。
石墨烯的这种特性尤其适合于高频电路。
高频电路是现代电子工业的领头羊,一些电子设备,例如手机,由于工程师们正在设法将越来越多的信息填充在信号中,它们被要求使用越来越高的频率,然而手机的工作频率越高,热量也越高,于是,高频的提升便受到很大的限制。