腐蚀学第二章 金属电化学腐蚀热力学
- 格式:ppt
- 大小:3.69 MB
- 文档页数:94









第二章电化学腐蚀热力学2.1金属腐蚀倾向的热力学判据自然界中绝大多数金属元素(除Au,Pt等贵金属之外)均以化合态存在。
大部分金属单质是通过外界对化合态体系提供能量(热能或者电能)还原而成的,因此,在热力学上金属单质是一个不稳定体系。
在一定的外界环境条件下,金属的单质状态可自发地转变为化合物状态,生成相应的氧化物、硫化物和相应的盐等腐蚀产物,使体系趋于稳定状态,即有自动发生腐蚀的倾向。
金属发生腐蚀的可能性和程度不仅与金属性质有关,还与腐蚀介质的特性和外界条件有关。
研究腐蚀现象需要从两个方面着手,一方面是看腐蚀的自发倾向大小。
另—方面是看腐蚀进程的快慢,前者需要用热力学原理进行分析,后者则要借助动力学理论。
金属腐蚀反应体系是一个开放体系。
在反应过程中,体系与环境既有能量的交换又有物质的交换。
金属腐蚀反应一般都是在恒温和恒压的条件下进行的,用体系的热力学状态函数吉布斯(Gibb)自由能判据来判断反应的方向和限度较为方便。
吉布斯自由能用G表示,对于等温等压并且没有非体积功的过程,腐蚀体系的平衡态或稳定态对应于古布斯自由能G为最低的状态。
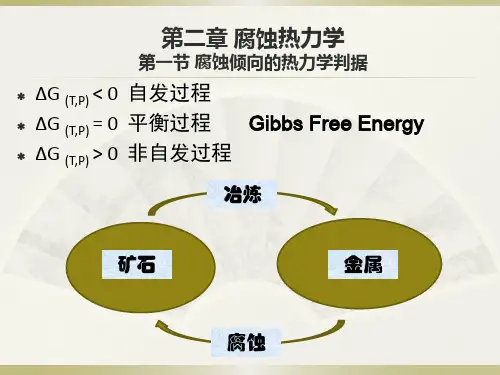
设物质系统吉布斯自由能变化为ΔG,则有<0自发过程ΔG=0平衡状态(2-1)>0非自发过程自然环境中的大多数金属的单质态和化合物状态的吉布斯自由能高低表现出如图2.1所示的状况,即腐蚀产物与矿石一样处于低能的稳定状态,金属单质处于高能的状态。
因此金属腐蚀具有自发倾向。
图2.1物质的吉布斯自由能一个腐蚀体系是由金属和外围介质组成的多组分敞开体系。
对于一个腐蚀化学反应,可用下式表示。
0iiAi(2-2)式中νi为反应式中组分i的化学计量数,反应物的计量数取负值,生成物的计量数取正值;Ai为参加腐蚀反应的物质组分。
在任意情况下,腐蚀反应体系吉布斯自由能的改变ΔG服从范特荷甫等温方程。
GGRTlnQ(2-3)式中ΔG为反应的标准吉布斯自由能的改变;R为气体常数;T为热力学温度,Q为活度商(或者逸度商)用下式表示。