高中化学复习知识点:弱电解质的电离方程式
- 格式:docx
- 大小:326.47 KB
- 文档页数:11

高一化学弱电解质与电离方程式嘿,朋友!咱开始唠唠高一化学里的弱电解质和电离方程式哈。
弱电解质啊,就像是一群害羞的小娃娃。
你看醋酸(CH₃COOH),它就是个典型的弱电解质。
它在水里电离的时候,扭扭捏捏的,就像小朋友第一次上台表演似的。
它的电离方程式是CH₃COOH ⇌ CH₃COO⁻ + H⁺,这个过程就像是醋酸分子这个小家庭,偶尔有一个成员(H⁺)想要出去闯荡一下,但大部分时候还是紧紧抱在一起的呢。
再看看碳酸(H₂CO₃),这可是个超级“不稳定”的家伙,就像个调皮的小精灵。
它的电离方程式可有趣了,分两步走呢。
第一步H₂CO₃⇌ H⁺ + HCO₃⁻,就好像碳酸这个大袋子,先漏出了一个氢离子这个小豆子,还留着个碳酸氢根(HCO₃⁻)在袋子里。
第二步HCO₃⁻⇌ H⁺ + CO₃²⁻,这就是那个碳酸氢根又不太情愿地再放出一个氢离子。
整个过程就像拆盲盒,一个一个地把氢离子这个小惊喜给放出来。
还有一水合氨(NH₃·H₂O),它呀,就像一个有点神秘的魔术师。
它的电离方程式是NH₃·H₂O ⇌ NH₄⁺ + OH⁻。
一水合氨分子就像魔术师手里的道具,悄悄地把铵根离子(NH₄⁺)和氢氧根离子(OH⁻)变出来,而且还不是一下子全变出来,就那么一点一点的,很是神秘。
磷酸(H₃PO₄)就像一个层层包裹的洋葱。
它的电离方程式分三步呢。
第一步H₃PO₄⇌ H⁺ + H₂PO₄⁻,就像剥掉了洋葱的最外层。
第二步H₂PO₄⁻⇌ H⁺ + HPO₄²⁻,再剥一层。
第三步HPO₄²⁻⇌ H⁺ + PO₄³⁻,一层一层地把氢离子释放出来,每次都小心翼翼的,就像剥洋葱怕辣眼睛一样。
氢氟酸(HF)呢,是个很有个性的“小刺头”。
它的电离方程式HF ⇌H⁺ + F⁻,它电离得很少,就像那种有点倔强的孩子,不太愿意听老师(溶剂水)的话去分解成离子,总是紧紧守着自己的小地盘。
次氯酸(HClO)就像个微弱的小烛光。

一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下自身能够电离出自由移动离子的化合物,叫电解质。
非电解质:在水溶液中且熔化状态下自身都不能电离出自由移动离子的化合物。
概念理解:①电解质、非电解质都是化合物,能导电的物质可能是溶液(混合物)、金属(单质),但他们不属于电解质非电解质的研究对象,因此他们既不是电解质也不是非电解质;②自身电离:so2、NH3、co2、等化合物能和水反应形成酸或碱,但发生电离的并不是他们本身吗,因此属于非电解质;③只能在水中发生电离的电解质有酸或者某些易溶于水高温下易分解的盐,如液态氯化氢是化合物,只存在分子,没有发生电离,因此不能导电,又如NaHCO3在高温时即分解,不能通过熔融态证明其为电解质;只能在熔融状态下电离的电解质是活泼金属氧化物,如Na2O、CaO,他们在溶液中便不存在,要立刻反应生成键,因此不能通过溶液中产生离子证明;既能在水溶液中又能在溶液中发生电离的物质是某些高温难分解盐,绝大多数盐溶解在水中都能发生完全电离,某些盐熔融时也发生电离,如BasO4。
④电离不需要通电等外界条件,在熔融或者水溶液中即能够产生离子;⑤是电解质,但是要产生离子也要在溶液状态或者熔融状态,否则即便存在离子也无法导电,比如NaCI,晶体状态不能导电。
⑥电解质的强弱与导电性、溶解性无关。
如如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质。
导电性与自由移动离子的浓度和带电荷数等有关。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分电离成离子的电解质。
2.常见的电解质为酸碱盐、活泼金属氧化物、水,其中强电解质与偌电解质常见分类:强电解质弱电解质电贻质3、电离方程式的书写——“强等号,弱可逆,多元弱酸分步离”①强电解质:如H2SO4:H2SO4===2H++SO2-②弱电解质a.—元弱酸,如CH3COOH:CH3COOH==CH3COO-+H+b.多元弱酸,分步电离,分步书写且第一步电离程度远远大于第二步的电离程度,如H2CO3:H2CO^H++HCO-、HCO-H++CO3-。

第一节弱电解质的电离弱电解质的电离平衡1.电离平衡的建立在一定条件(如温度、浓度)下,当弱电解质分子离解成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到了平衡。
2.电离平衡的特征3.外界条件对电离平衡的影响电离是一个吸热过程,主要受温度、浓度的影响。
以弱电解质CH 3COOH 的电离为例:CH 3COOHCH 3COO -+H +⎩⎪⎪⎨⎪⎪⎧平衡右移⎨加水稀释平衡左移 电离平衡常数 1.表达式(1)对于一元弱酸HA : HAH ++A -,平衡常数K=c (H +)·c (A -)c (HA );(2)对于一元弱碱BOH : BOH B ++OH -,平衡常数K =c (B +)·c (OH -)c (BOH )。
2.意义相同条件下,K 值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
3.特点(1)多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第一步电离。
1.易误诊断(正确的打“√”,错误的打“×”)。
(1)溶液导电能力弱的电解质一定是弱电解质()(2)弱电解质浓度越大,电离程度越大()(3)温度升高,弱电解质的电离平衡右移()(4)0.1 mol/L某一元酸HA溶液的pH=3,HA溶液中存在:HA===H++A-()(5)温度不变,向CH3COOH溶液中加入CH3COONa,平衡左移()(6)电离平衡常数(K)越小,表示弱电解质电离能力越弱()(7)不同浓度的同一弱电解质,其电离平衡常数(K)不同()(8)电离平衡右移,电离平衡常数一定增大()【答案】(1)×(2)×(3)√(4)×(5)√(6)√(7)×(8)×2.NH3·H2O在水溶液中的电离方程式为:__________________________,其电离常数表达式为:_____________________________________________。


弱电解质电离方程式书写
弱电解质是在水溶液中部分电离的化合物,它们形成氢离子(或羟基离子)和共轭碱(或共轭酸)离子。
弱电解质的电离方程式可以表示如下:
1. 弱酸的电离方程式:
HA + H2O ⇌ H3O+ + A-
其中,HA 代表弱酸,A- 代表共轭碱离子。
常见的弱酸如乙酸(CH3COOH)、碳酸氢根离子(HCO3-)等。
2. 弱碱的电离方程式:
B + H2O ⇌ BH+ + OH-
其中,B 代表弱碱,BH+ 代表共轭酸离子。
常见的弱碱如氨(NH3)、氢氧化铵(NH4OH)等。
3. 多质子弱酸的电离方程式:
多质子弱酸在水溶液中可分步电离,每步电离都有相应的电离方程式。
以磷酸(H3PO4)为例:
第一步:H3PO4 + H2O ⇌ H3O+ + H2PO4-
第二步:H2PO4- + H2O ⇌ H3O+ + HPO4^(2-)
第三步:HPO4^(2-) + H2O ⇌ H3O+ + PO4^(3-)
通过书写弱电解质的电离方程式,可以更好地理解它们在水溶液中的行为,并预测电离平衡的方向。
电离方程式也是计算溶液中各种离子
浓度的基础。

弱电解质的电离方程式弱电解质是指在水溶液中只部分电离产生离子的物质。
它的电离方程式描述了该物质在水中电离的过程和产生的离子。
在这篇文章中,我们将详细解释弱电解质的电离方程式,并对其进行扩展描述。
我们需要了解什么是电离。
电离是指将分子或化合物转化为带电离子的过程。
在水溶液中,电离常常由溶质分子与水分子发生相互作用而引起。
弱电解质相对于强电解质而言,其电离程度较低,只有一部分分子会电离为离子,而大部分分子仍然保持为分子状态。
以一元弱酸CH3COOH为例,它的电离方程式可以表示为:CH3COOH ⇌ CH3COO- + H+在这个方程式中,CH3COOH是弱酸的分子形式,CH3COO-是乙酸根离子,H+是氢离子。
接下来,我们来解释这个电离方程式的意义。
首先,方程式中的箭头“⇌”表示反应是可逆的,也就是说,电离过程既可以发生,也可以逆反应,即离子可以重新结合成分子。
在这个电离方程式中,CH3COOH分子与水分子发生相互作用,部分CH3COOH分子失去一个H+离子,生成CH3COO-离子和H+离子。
CH3COO-离子是一个阴离子,带有一个负电荷,而H+离子是一个阳离子,带有一个正电荷。
需要注意的是,弱电解质的电离程度较低,所以在水溶液中,CH3COOH的大部分仍然是分子形式存在,只有少部分分子发生电离。
这也是为什么称之为弱电解质的原因。
弱电解质的电离方程式不仅仅适用于弱酸,还适用于其他弱电解质,如弱碱和弱盐。
以一元弱碱NH3为例,它的电离方程式可以表示为:NH3 + H2O ⇌ NH4+ + OH-在这个方程式中,NH3是弱碱的分子形式,NH4+是氨根离子,OH-是氢氧根离子。
同样地,NH3分子与水分子发生相互作用,部分NH3分子接受一个H+离子,生成NH4+离子和OH-离子。
NH4+离子是一个阳离子,带有一个正电荷,OH-离子是一个阴离子,带有一个负电荷。
虽然弱电解质的电离程度较低,但它们仍然能在水溶液中产生一定数量的离子。
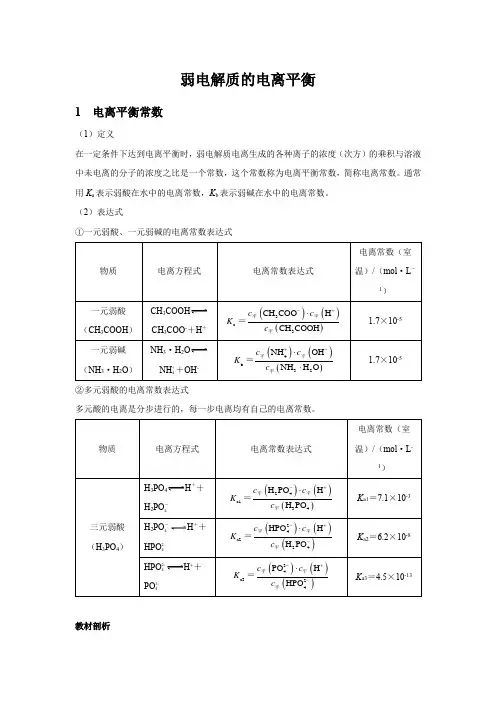
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。


弱电解质的电离平衡知识点集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下自身能够电离出自由移动离子的化合物,叫电解质。
非电解质:在水溶液中且熔化状态下自身都不能电离出自由移动离子的化合物。
概念理解:①电解质、非电解质都是化合物,能导电的物质可能是溶液(混合物)、金属(单质),但他们不属于电解质非电解质的研究对象,因此他们既不是电解质也不是非电解质;②自身电离:SO2、NH3、CO2、等化合物能和水反应形成酸或碱,但发生电离的并不是他们本身吗,因此属于非电解质;③只能在水中发生电离的电解质有酸或者某些易溶于水高温下易分解的盐,如液态氯化氢是化合物,只存在分子,没有发生电离,因此不能导电,又如NaHCO3在高温时即分解,不能通过熔融态证明其为电解质;只能在熔融状态下电离的电解质是活泼金属氧化物,如Na2O、CaO,他们在溶液中便不存在,要立刻反应生成键,因此不能通过溶液中产生离子证明;既能在水溶液中又能在溶液中发生电离的物质是某些高温难分解盐,绝大多数盐溶解在水中都能发生完全电离,某些盐熔融时也发生电离,如BaSO4。
④电离不需要通电等外界条件,在熔融或者水溶液中即能够产生离子;⑤是电解质,但是要产生离子也要在溶液状态或者熔融状态,否则即便存在离子也无法导电,比如NaCl ,晶体状态不能导电。
⑥电解质的强弱与导电性、溶解性无关。
如如BaSO 4不溶于水,但溶于水的BaSO 4全部电离,故BaSO 4为强电解质。
导电性与自由移动离子的浓度和带电荷数等有关。
强电解质 :在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分电离成离子的电解质 。
2.常见的电解质为酸碱盐、活泼金属氧化物、水,其中强电解质与偌电解质常见分类:3、电离方程式的书写——“强等号,弱可逆,多元弱酸分步离”①强电解质:如H 2SO 4:H 2SO 4===2H ++SO 2-4 。

以下是©⽆忧考⽹为⼤家整理的关于《⾼⼆化学知识点总结:电离平衡》,供⼤家学习参考!⼀、强弱电解质的判断1、电解质和⾮电解质均指化合物,单质和混合物既不是电解质⼜不是⾮电解质。
2、判断电解质的关键要看该化合物能否⾃⾝电离。
如NH3、SO2等就不是电解质。
3、电解质的强弱要看它能否完全电离(在⽔溶液或熔化时),与其溶解性、导电性⽆关。
4、离⼦化合物都是强电解质如NaCl、BaSO4等,共价化合物部分是强电解质如HCl、H2SO4等,部分是弱电解质如HF、CH3COOH、HCN、HNO2、H3PO4、H2SO3、H2CO3、HClO、NH3·H2O等,部分是⾮电解质如酒精、蔗糖等。
⼆、电离平衡1、弱电解质才有电离平衡,如⽔:2H2O =H3O++OH-。
2、电离平衡的特征:等(V电离=V结合≠0)动(动态平衡)定(各微粒浓度⼀定)变3、影响电离平衡的外界条件:温度越⾼,浓度越⼩,越有利于电离。
加⼊和弱电解质具有相同离⼦的强电解质,能抑制弱电解质的电离。
4、电离⽅程式:(1)强电解质完全电离,⽤等号,如:HCl=H++Cl_ NaHSO4=Na++H++SO42-(2)弱电解质部分电离,⽤可逆符号;多元弱酸分步电离,以第⼀步电离为主,电离级数越⼤越困难;且各步电离不能合并。
如:H3PO4 H++H2PO4- H2PO4- H++HPO42- HPO42- H++PO43-三、⽔的离⼦积(Kw)1、由⽔的电离⽅程式可知:任何情况下,⽔所电离出的H+与OH-的量相等.2、Kw=c(H+)·c(OH-),25℃时,Kw=1×10-14。
Kw只与温度有关,温度越⾼,Kw越⼤。
四、溶液的pH1、pH=-lg{c(H+)},溶液的酸碱性与pH的关系(25℃):中性溶液:C(H+)=C(OH-)=1×10-7mol/L pH=7 ,酸性溶液:C(H+)>C(OH-) pH<7,碱性溶液:C(H+)7。

弱电解质的电离、盐类的水解知识精讲一. 学习内容弱电解质的电离、盐类的水解二. 学习目的1. 掌握弱电解质的电离平衡的建立过程2. 了解电离平衡常数和电离度3. 理解盐类水解的本质,掌握盐类水解的方程式的书写4. 了解影响盐类水解的因素以及水解平衡的移动,了解盐类水解的利用三.学习教学重点、难点盐类水解的过程四.知识分析(一)、弱电解质的电离平衡1. 电离平衡(1)研究对象:弱电解质(2)电离平衡的建立:CH3COOH CH3COO— + H+(3)定义:在一定条件(如温度、浓度)下,当电解质电离成离子的速率和离子重新结合成分子的速率相等时,电离就达到了平衡状态,这叫做电离平衡。
(4)电离平衡的特点:动:v电离=v结合、定:条件一定时,各组分浓度一定;变:条件改变时,平衡移动2. 电离平衡常数(1)定义:电离常数受温度影响,与溶液浓度无关,温度一定,电离常数一定。
根据同一温度下电离常数的大小可判断弱电解质电离能力的相对强弱。
(2)表达式:CH3COOH CH3COO— + H+Ka = [CH3COO—][H+]/ [CH3COOH]注:弱酸的电离常数越大,[H+]越大,酸性越强;反之,酸性越弱。
H3PO4H2PO4— + H+ Ka1 = 7.1 × 10—3mol·L—1H2PO4—HPO42— + H+ Ka2 = 6.2 × 10—8mol·L—1HPO42—PO43— + H+ Ka3 = 4.5× 10—13mol·L—1注:多元弱酸各级电离常数逐级减少,且一般相差很大,故氢离子主要由第一步电离产生弱碱与弱酸具类似规律:NH3·H2O NH4+ + OH—K b=[NH4+][OH—]/[NH3·H2O]室温:K b(NH3·H2O)= 1.7 × 10—5mol·L—13. 电离度α=已电离的溶质分子数/原始溶质分子总数× 100%注:①同温同浓度,不同的电解质的电离度不同②同一弱电解质,在不同浓度的水溶液中,电离度不同;溶液越稀,电离度越大。
弱电解质的电离平衡知识点弱电解质的电离平衡是指在水溶液中,电解质分子部分离解为离子,并且离子和未离子之间的反应达到平衡的过程。
弱电解质在溶液中的电离程度相对较低,因此离子与未离子之间的平衡反应更加显著。
下面是弱电解质的电离平衡的几个重要知识点:1.电离方程式HA⇌H++A-这个方程式表示了HA分子在水中部分离解产生H+离子和A-离子。
2.平衡常数平衡常数(K)描述了反应物与生成物的浓度之间的关系。
对于弱电解质的电离反应,可以使用离子质量浓度或者摩尔浓度来表示。
例如对于上述的电离反应,平衡常数K可以计算为:K=[H+][A-]/[HA]其中[H+],[A-],和[HA]分别代表H+离子、A-离子和HA分子的浓度。
3.离子积离子积是离子浓度的乘积。
对于上述电离反应,离子积可以表示为:离子积=[H+][A-]离子积是一个测量电离反应进行程度的指标。
值得注意的是,弱电解质的电离平衡中,离子积通常比平衡常数小得多。
4.改变电离程度的因素5.pH值弱电解质的电离程度直接关系到水溶液的pH值。
水溶液的pH值是表征溶液中H+离子浓度的一个指标。
对于弱酸来说,更多的H+离子会使溶液的pH值降低,因此溶液越酸。
反之,如果被添加到溶液中的溶质可以与H+离子结合形成HA分子,那么会降低H+离子浓度,使得溶液的pH值升高,溶液会变得更碱性。
总结:弱电解质的电离平衡是指在水溶液中电解质分子部分离解为离子,并且离子和未离子之间的反应达到平衡的过程。
这个平衡过程可以用电离方程式来表示,并且有一个平衡常数和离子积。
弱电解质的电离程度可以受到多个因素的影响,包括浓度、温度、溶液中其他物质的存在以及溶解度等。
在水溶液中,弱电解质的电离程度直接关系到溶液的pH值。
高中化学方程式:电离方程式
电离方程式描述了化学反应中的电离过程,指出了物质在水溶液中的电离成分和它们的电离程度。
下面是几个常见的高中化学电离方程式示例:
1. 酸的电离方程式:
HCl → H⁺ + Cl⁻
H₂SO₄ → 2H⁺ + SO₄²⁻
2. 碱的电离方程式:
NaOH → Na⁺ + OH⁻
KOH → K⁺ + OH⁻
3. 强电解质的电离方程式:
NaCl → Na⁺ + Cl⁻
HCl → H⁺ + Cl⁻
HNO₃ → H⁺ + NO₃⁻
4. 弱电解质的电离方程式:
CH₃COOH ⇌ CH₃COO⁻ + H⁺
H₂CO₃⇌ HCO₃⁻ + H⁺
需要注意的是,电离方程式的方向性表示了电离的程度。
箭头向右表示完全电离,箭头向左表示有反应物反离子的生成,并且这两种情况同时发生。
在弱电解质的情况下,电离方程式包含了双向箭头来表示平衡状态。
第三章第一节弱电解质的电离一、电解质、非电解质、1、电解质:在水溶液里或熔融状态下能导电的化合物。
实例:酸、碱、盐、活泼金属氧化物、水。
2、非电解质:在水溶液里和熔融状态下都不能导电的化合物。
实例:大多数有机物、酸性氧化物、氨气等。
①电解质和非电解质均指化合物,单质和混合物既不属于电解质也不属于非电解质。
②电解质必须是自身能直接电离出自由移动的离子的化合物。
如:SO2、CO2则不是。
③条件:水溶液或融化状态:对于电解质来说,只须满足一个条件即可,而对非电解质则必须同时满足两个条件。
④难溶性化合物不一定就是弱电解质。
例如:BaSO4、AgCl 难溶于水,导电性差,但由于它们的溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,所以他们是电解质。
⑤酸、碱、盐、金属氧化物和水都是电解质(特殊:盐酸是电解质溶液)。
蔗糖、酒精为非电解质。
练习1:下列物质中属于电解质的是( )①NaCl溶液②NaOH ③H2SO4 ④Cu ⑤CH3COOH ⑥NH3·H2O ⑦CO2 ⑧乙醇⑨水二、强电解质与弱电解质1、强电解质:溶于水或熔融状态下几乎完全电离的电解质。
2、弱电解质:溶于水或熔融状态下只有部分电离的电解质。
①电解质的强弱与化学键有关,但不由化学键类型决定。
强电解质含有离子键或强极性键,但含有强极性键的不一定都是强电解质,如H2O、HF等都是弱电解质。
②电解质的强弱与溶解度无关。
如BaSO4、CaCO3等③ 电解质的强弱与溶液的导电能力没有必然联系。
说明 离子化合物在熔融或溶于水时离子键被破坏,电离产生了自由移动的离子而导电;共价化合物只有在溶于水时才能导电.因此,可通过使一个化合物处于熔融状态时能否导电的实验来判定该化合物是共价化合物还是离子化合物。
电解质的强弱与其水溶液的导电能力有何关系? 3、电解质溶液的导电性和导电能力① 电解质不一定导电(如NaCl 晶体、无水醋酸),导电物质不一定是电解质(如石墨),非电解质不导电,但不导电的物质不一定是非电解质;② 电解质溶液的导电性强弱决定于溶液离子浓度大小,浓度越大,导电性越强。
第八章水溶液中的离子平衡第1课时弱电解质的电离平衡知识点一弱电解质的电离平衡及其影响因素1.强、弱电解质(1)概念及分类(2)电离方程式的书写强电解质用“===”连接,弱电解质用“⇌”连接。
(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质分子电离产生离子的速率和离子结合成弱电解质分子的速率相等时,电离过程达到了平衡。
电离平衡建立过程如图所示:①开始时,v(电离)最大,而v(结合)为0。
②平衡的建立过程中,v(电离)>v(结合)。
③当v(电离)=v(结合)时,电离过程达到平衡状态。
(2)电离平衡的特征(3)外界条件对电离平衡的影响以CH3COOH H++CH3COO-ΔH>0为例:改变条件移动方向n(H+)c(H+)c(CH3COO-)电离程度浓度加水稀释正向增大减小减小增大加冰醋酸正向增大增大增大减小同离子效应通入HCl(g)逆向增大增大减小减小加醋酸钠固体逆向减小减小增大减小升高温度正向增大增大增大增大说明①稀醋酸加水稀释时,溶液中不一定所有的离子浓度都减小;②电离平衡右移,电解质分子的浓度不一定减小,离子的浓度也不一定增大;③电离平衡右移,电离程度也不一定增大电解质溶液导电能力取决于自由移动离子的浓度和离子所带电荷数,自由移动离子的浓度越大、离子所带电荷数越多,导电能力越强。
将冰醋酸、浓醋酸和稀醋酸分别加水稀释,其导电能力随加水量的变化曲线如图:知识点二电离平衡常数与电离度1.电离平衡常数(1)概念:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比值是一个常数,这个常数叫做电离平衡常数,用K(弱酸用K a,弱碱用K b)表示。
(2)表达式相同条件下,K 值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
(4)特点①电离常数只与温度有关,与电解质的浓度、酸碱性无关,由于电离过程是吸热的,故温度升高,K 增大。
化学高中电离方程式一、电离方程式是什么呢?电离方程式啊,就像是化学世界里的一种小密码呢。
它是用来表示电解质在溶液中或者熔融状态下电离成离子的式子。
比如说吧,盐酸(HCl),它在水中会电离成氢离子(H⁺)和氯离子(Cl⁻),那它的电离方程式就是HCl = H⁺ + Cl⁻。
二、强电解质的电离方程式1. 强酸强酸那可都是电离能力超强的家伙。
像硫酸(H₂SO₄),它在水中是完全电离的哦。
它的电离方程式就是H₂SO₄= 2H⁺+ SO₄²⁻。
这里的2个氢离子可不能写错啦,因为硫酸分子里有2个氢原子,而且在电离的时候都会变成氢离子跑到溶液里呢。
硝酸(HNO₃)也一样,电离方程式是HNO₻ = H⁺ + NO₃⁻。
2. 强碱强碱也不示弱呢。
氢氧化钠(NaOH)在水中电离就变成了钠离子(Na⁺)和氢氧根离子(OH⁻),方程式就是NaOH = Na⁺ + OH⁻。
氢氧化钾(KOH)也是类似的,KOH = K⁺ + OH⁻。
3. 大多数盐像氯化钠(NaCl)这种盐,在水里会电离成钠离子和氯离子,方程式为NaCl = Na⁺ + Cl⁻。
还有硫酸铜(CuSO₄),它的电离方程式是CuSO₄ = Cu²⁺+ SO₄²⁻。
三、弱电解质的电离方程式1. 弱酸弱酸就不像强酸那么干脆啦。
比如说醋酸(CH₃COOH),它在水中是部分电离的,电离方程式是CH₃COOH ⇌ H⁺ + CH₃COO⁻。
这里的“⇌”可重要啦,它表示这个电离是可逆的,也就是说醋酸分子一边电离成氢离子和醋酸根离子,一边氢离子和醋酸根离子又会重新结合成醋酸分子呢。
2. 弱碱氨水溶液中的一水合氨(NH₃·H₂O)是弱碱,它的电离方程式是NH₃·H₂O ⇌ NH₄⁺ + OH⁻。
四、多元弱酸和多元弱碱的电离1. 多元弱酸多元弱酸的电离是分步进行的哦。
就拿碳酸(H₂CO₃)来说吧,它的第一步电离是H₂CO₃⇌ H⁺ + HCO₃⁻,然后碳酸氢根离子(HCO₃⁻)还会进一步电离,不过这一步就更难了,方程式是HCO₃⁻⇌ H⁺+ CO₃²⁻。
第一节弱电解质的电离一、电解质1、定义:○1电解质:在水溶液中或熔化状态下能导电的化合物;○2非电解质:在水溶液中或熔化状态下都不能导电的化合物;(非金属氧化物、大多数有机物。
如)○3强电解质:在水溶液里全部电离成离子的电解质;(强酸、强碱、大多数盐。
如)○4弱电解质:在水溶液里只有一部分分子电离成离子的电解质。
(弱酸、弱碱,极少数盐,水。
如HClO、)2、电解质与非电解质的本质区别:电解质——离子化合物或共价化合物非电解质——共价化合物注意:○1电解质、非电解质都是化合物○2强电解质不等于易溶于水的化合物(如不溶于水,但溶于水的全部电离,故为强电解质)○3电解质的强弱与导电性、溶解性无关【习题一】(2017秋•邢台期末)下列事实不能证明H2C2O4(乙二酸)是弱电解质的是()A.草酸能使酸性KMnO4溶液褪色B.常温下,0.1mol/L的H2C2O4溶液的PH=2C.浓度均为1mol/L=l的H2C2O4溶液的导电能力比硫酸的导电能力弱D.常温下,pH=4的H2C2O4溶液稀释100倍,pH约为5【考点】弱电解质的判断.【专题】电离平衡与溶液的pH专题.【分析】强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,只要说明乙二酸部分电离就能证明乙二酸是弱电解质,据此分析解答。
【解答】解:A.草酸能使酸性KMnO4溶液褪色,是草酸的还原性,不能证明为弱酸,故A符合;B.常温下,0.1mol/L的H2C2O4溶液的PH=2,说明溶液中存在电离平衡,草酸为弱电解质,故B不符合;C.浓度均为1mol/L的H2C2O4溶液的导电能力比硫酸的导电能力弱,说明草酸部分电离,为弱电解质,故C不符合;D.常温下,pH=4的H2C2O4溶液稀释100倍,若为强电解质PH变化为6,pH 约为5,说明稀过程中草酸又电离出氢离子,存在电离平衡,说明为弱电解质,故D不符合;故选:A。
【习题二】(2017秋•平罗县校级期末)下列说法中,正确的是()A.强电解质的水溶液一定比弱电解质溶液的导电能力强B.强电解质都是离子化合物,弱电解质都是共价化合物C.强电解质的水溶液中不存在溶质分子D.不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质【考点】强电解质和弱电解质的概念.【专题】电离平衡与溶液的pH专题.【分析】A.溶液导电能力取决于溶液中离子浓度大小,与电解强弱无关;B.某些共价化合物是强电解质;C.强电解质完全电离成离子;D.某些不溶性盐是强电解质;某些可溶性酸是弱电解质;某些具有极性键的化合物是弱强电解.【解答】解:A.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故A错误;B.强电解质不一定都是离子化合物,如氯化氢;弱电解质都是共价化合物,故B错误;C.强电解质的特征水溶液中完全电离,所以不存在溶质分子,故C正确;D.不溶性盐不一定是弱电解质,如硫酸钡;可溶性酸不一定是强电解质如醋酸;具有极性键的化合物不一定是强电解,如甲烷,故D错误,故选:C。