早期食管癌IPCL分型
- 格式:pdf
- 大小:159.05 KB
- 文档页数:2
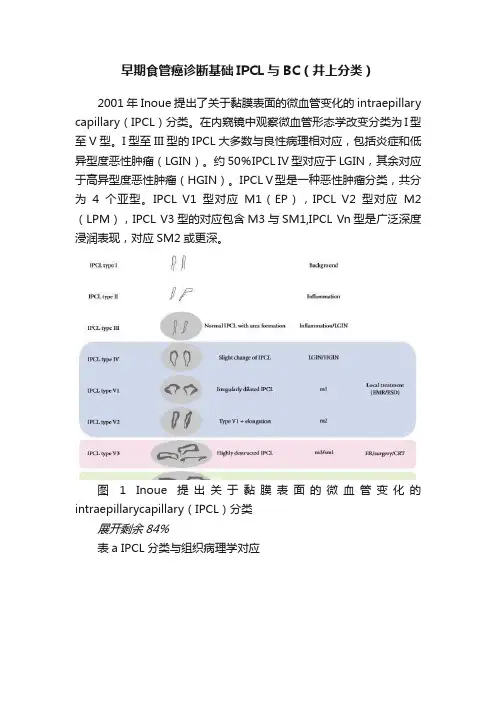
早期食管癌诊断基础IPCL与BC(井上分类)2001年Inoue提出了关于黏膜表面的微血管变化的intraepillary capillary(IPCL)分类。
在内窥镜中观察微血管形态学改变分类为I型至V型。
I型至III型的IPCL大多数与良性病理相对应,包括炎症和低异型度恶性肿瘤(LGIN)。
约50%IPCL IV型对应于LGIN,其余对应于高异型度恶性肿瘤(HGIN)。
IPCL V型是一种恶性肿瘤分类,共分为4个亚型。
IPCL V1型对应M1(EP),IPCL V2型对应M2(LPM),IPCL V3型的对应包含M3与SM1,IPCL Vn型是广泛深度浸润表现,对应SM2或更深。
图 1 Inoue 提出关于黏膜表面的微血管变化的intraepillarycapillary(IPCL)分类展开剩余84%表a IPCL分类与组织病理学对应井上分类的特点是由多种亚分型的微血管表现与组织病理学相互对应。
通过亚分型的IPCL直径变化来明确区分需要进一步病理评估的病变。
IPCL type I~ IPCL type V-1各型的差异表现于平坦(表浅)病变鳞状上皮的变化。
另一方面IPCL type V-1~ IPCL type Vn各型的差异反映鳞状状上皮癌的浸润深度。
图2 IPCL I型(第一行);IPCL II型(第二行);IPCL III型(第三行);IPCL IV型(第四行)图3 IPCL V1型(第一行);IPCL V2型(第二行);IPCL V3型(第三行);IPCL Vn型(第四行)井上分类说明IPCL type I型为正常黏膜表面的微血管形态表现。
IPCL type II型为炎症性,经常存在于慢性食管炎,原则上随访考虑。
IPCL type III型存在慢性食管炎或低异型度恶性肿瘤,应为随访或治疗对象。
IPCL type IV型包括低级别/高级别上皮内瘤变(原位癌),因此应考虑为内镜治疗对象。

早期食管癌常见镜下分型早期癌是指癌组织仅累及黏膜下层以上的浅表部位而未侵犯肌层或未发生淋巴结转移或远处转移者。
学习早期食管癌的分型,我们首先要了解一个概念。
IPCL:部分粘膜肌层向复层鳞状上皮内凸出呈乳头状,乳头内粘膜肌层血管如乳头袢状发出,即形成IPCL这是正常食管粘膜的血管结构。
这里我们可以看到,癌区的IPCL可见明显的增粗、扭曲。
所以,我们根据IPCL来对早期食管癌进行分型。
早期食管癌常见的分型有食管学会(JES)AB分型和食管井上分型。
一、食管学会AB分型Type A:轻度的,血管形态无变化无或轻度的上皮内毛细血管(IPCL)变化Type B:深度的,血管形态有变化B1:襻状的异常血管(对应浸润 M1、M2)B2:没有襻形成的,呈现贫乏的异常血管(对应浸润M2、SM1)B3:高度扩张的不规则血管(对应浸润SM2更深)无血管区域Avascular area(AVA)AVA-小:<0.5mm (对应浸润 M1、M2)AVA-中:0.5mm-3mm(对应浸润M2、SM1)AVA-大:>3mm(对应浸润SM2更深)二、食管井上分型TypeⅠ正常内镜所见排列整齐、斜型头尾一致、分布较稀疏TypeⅡ内镜下炎症所见排列基本整齐、个别IPCL轻微扩张TypeⅢ内镜下低级别所见排列基本正常,IPCL轻微密集并伴轻微扩张TypeⅣ内镜下高级别所见IPCL排列混乱、分布密集、环形增粗TypeⅤ1型(M1浸润)IPCL排列混乱、密集、点状扩张伴口径不等TypeⅤ2型(M2浸润)IPCL扩张、混乱、单向扭曲、Ⅴ1型表现上延长TypeⅤ3型(M3-SM浸润)IPCL蛇行延长扩张、高度破坏表现TypeⅤN型(SM2浸润)肿瘤新生血管,绿色粗大,其血管直径相当于IPCL TypeⅤ3血管的3倍三、食管学会(AB)分型与食管井上分型对应情况Type B1(m1,m2)B1:所有扩张、弯曲、口径不同形状不均的环状异常血管(井上V1-2)Type B2(m3,sm1)B2:难形成环状的异常血管(井上V3 )Type B3(sm2以上)B3:高度扩张的不规则血管(井上Vn)四、食管分型的意义1、鉴别癌或非癌2、判断浸润深度3、治疗下一步治疗(内镜下治疗或外科手术)河南省肿瘤医院内镜中心愿为每一位爱健康的您保驾护航!。

2024染色内镜用于食管癌早期诊断的研究进展要点(全文)目前消化道肿瘤的发病率及死亡率在全球范围内呈上升趋势,食管癌为全球发病率第7位、病死率第6位的恶性肿瘤。
早期食管癌患者症状不典型,大多数患者就诊时已至中晚期,5年生存率低,对于后期出现食管恶性狭窄且无法接受外科治疗的患者,生活质量显著下降。
上消化道内镜检查可发现早期肿瘤性病变,对于食管癌的早诊早治具有重要意义,但由于早期病变面积较小、与周围黏膜色差不明显,白光内镜(WLI)下容易漏诊。
随着染色内镜的出现,食管早癌检出率显著提高。
染色内镜包括化学染色内镜及电子染色内镜,通过不同的方式提高病变黏膜的可视性,帮助内镜操作者识别早期微小病变。
本文就不同染色内镜的镜下特点及在食管癌早期诊断中的应用进行综述。
一、化学染色内镜化学染色内镜,指检查时通过对消化道黏膜上皮染色,进而提高对病变的识别、诊断能力。
目前Lugol′s液染色内镜(LCE)在食管早癌的诊断及术前评估方面应用甚广。
1. LCE镜下特点:肿瘤细胞由于过度消耗糖原,碘染色后镜下呈现出不同程度的淡染、拒染表现,黏膜着色程度可反映其内含糖原细胞层的厚度,并且染色后的病变边缘锐度可以预测含糖细胞层向不含糖细胞层的转化是突变还是逐渐过渡。
食管高级别上皮内瘤变(HGIN)或癌变黏膜可出现“粉色征”(PCS)。
2. LCE的临床应用:LCE可显著提高食管早癌及癌前病变的检出率,PCS 的出现与HGIN及食管癌密切相关,其诊断灵敏度及特异度均较高,尤其是染色1 min内出现的PCS对于诊断HGIN及食管癌的准确率高达88.6%。
鉴于LCE的高灵敏度,目前指南及共识均推荐白光联合LCE用于食管癌的筛查。
但由于食管黏膜在炎症背景下也可出现淡染表现,LCE 特异度仅有52%~94%。
LCE在食管癌病灶边界判断方面具有优势,但Lugol′s染液可破坏黏膜上皮细胞,对于短时间内拟行ESD手术的患者可能会影响病变边界判定。



食管癌卢戈氏液碘染临床意义碘染色模式分为4级:Ⅰ级为浓染区,比正常食管黏膜染色深,多见于糖原棘皮症;Ⅱ级为正常表现,呈棕褐色;Ⅲ级为淡染区,多见于LGIN或急慢性炎症;Ⅳ级为不染区,多见于浸润癌、原位癌和HGIN。
在食管黏膜炎症、LGIN、HGIN以及癌变部位都可以出现碘溶液不染区,此时可借助于“粉色征”进行区分,即在喷洒碘溶液后病变部位呈不染或者淡黄色,2~3min后,HGIN和癌变部位可变为粉红色。
“粉色征”在NBI下观察可以被强化,呈闪亮的银色,称为“银色征”。
利用粉色征或银色征来判断HGIN和癌变的敏感度和特异度可达88%和95%。
常用碘溶液的浓度为0.5%~0.75%,喷洒碘溶液前宜应用链霉蛋白酶冲洗食管,去掉表面的黏液,自贲门向口侧喷洒至食管上段,抬高床头,染色完毕后应用2.5%硫代硫酸钠溶液喷洒脱碘或西甲硅油溶液冲洗食管,以将黏液和多余的碘洗去便于观察,观察完毕后注意将胃腔内碘液吸出以减轻患者的痛苦。
应用食管碘染色时,需要注意询问患者有无应用碘溶液后出现心慌不适、血压下降等过敏史,有碘过敏史者应避免碘染色;甲状腺功能亢进患者及孕妇避免应用碘染色;部分患者在进行食管碘染色后会出现明显的胸骨后烧灼感以及食管痉挛,可予以硫代硫酸钠中和碘溶液缓解患者的不适感;另外还需注意的是,食管黏膜损伤会影响碘染色效果,故再次碘染色应在7天后进行。
值得注意的是:1、卢戈氏碘作为判断边界使用而非判断病变性质所用。
2、诊断时尽量不要用碘,ESD当时做,否则会导致病变范围变小。
3、如果外院做了碘染,收治时需要根据情况判断(高级内瘤变的建议2-3个月后再行ESD)观察lpcl参照原图扩大范围行ESD。
碘染后二个副作用:1、食道粘膜痉挛-死死的抱住内镜影响esd操作。
处理技巧为:脱碘剂的使用及润滑油的使用。
2、上皮破坏。
等正常细胞生长过来,否则影响病变范围的确定,一般2-3个月恢复。
早期食管癌内镜下改变:①白光内镜光镜下黏膜异常(色泽改变、黏膜粗糙、分支血管网消失等);②复方碘染色淡染或不染;③放大-NBI(ME-NBI)可观察到异常的IPCL。


食管癌病理分型
食管癌
考点:病理分型
1.早期食管癌的病理形态分型根据内镜或手术切除标本所见,可分为:(1)充血型:是食管癌最早期的表现,多为原位癌。
(2)糜烂型:癌细胞分化较差。
(3)斑块型:最多见,癌细胞分化较好。
(4)乳头型:癌细胞分化一般较好。
2.中晚期食管癌的病理形态分型
(1)髓质型:管壁明显增厚并向腔内外扩展,边缘呈坡状隆起,侵及
食管壁各层及周
围组织,切面灰白色如脑髓,本型多见,恶性程度最高。
(2)蕈伞型:多呈圆形或卵圆形,向食管腔内突起,边缘外翻如蕈伞状,边缘与正常
黏膜境界清楚,表面常有溃疡,属高分化癌,预后较好。
(3)溃疡型:表面常有较深的溃疡,边缘稍隆起,出血和转移较早,而发生梗阻较晚。
(4)缩窄型:呈环形生长,质硬,涉及食管全周,出现梗阻较早。
3.组织学分类我国约占90%为鳞状细胞癌。
少数为腺癌(与Barrett食管恶变有关)。
欧美腺癌发生率已超过鳞癌。
贲门部腺癌可向上延伸累及食管下段。
4.食管癌的扩散和转移方式
(1)直接扩散:早中期食管癌主要为壁内扩散,因食管无浆膜层,容易直接侵犯其邻近器官。
(2)淋巴转移:是食管癌转移的主要方式。
(3)晚期血行转移:至肝、肺、骨、肾、肾上腺、脑等处。
每日
一题
食管癌病理分型,哪项是错误的
A.缩窄型B.蕈伞型C.梗阻型D.髓质型E.溃疡型。


IPCL分型在判断早期食管癌及癌前病变浸润中的应用谢招飞;江艳;陈素玉;施宏【摘要】目的评价IPCL分型在判断早期食管癌及癌前病变浸润深度中的应用价值.方法在白光和窄带成像技术(NBI)模式下观察食管黏膜病变的大小、范围,应用放大胃镜观察病变部位上皮乳头内毛细血管袢(IPCL)形态,采用日本AB分型法进行IPCL分型,判断病变的浸润深度,对符合内镜下切除适应证的早期食管癌及癌前病变行内镜下黏膜下剥离术(ESD),完整切除病变后标本送病理检查,以病理结果作为金标准,将IPCL分型的结果与术后标本病理结果进行对照.结果共55例食管病变实行内镜下切除,术前IPCL分型判断的病变浸润深度与术后病理符合者共40例,符合率为72.0%.结论 IPCL分型在判断早期食管癌及癌前病变浸润深度中符合率较高,操作简便,有较高的临床应用价值.【期刊名称】《微创医学》【年(卷),期】2017(012)006【总页数】3页(P772-774)【关键词】上皮内乳头内毛细血管袢;窄带成像技术;放大胃镜;早期食管癌;AB分型【作者】谢招飞;江艳;陈素玉;施宏【作者单位】福建省肿瘤医院暨福建医科大学附属肿瘤医院内镜科,福州市350014;福建省肿瘤医院暨福建医科大学附属肿瘤医院内镜科,福州市350014;福建省肿瘤医院暨福建医科大学附属肿瘤医院内镜科,福州市350014;福建省肿瘤医院暨福建医科大学附属肿瘤医院内镜科,福州市350014【正文语种】中文【中图分类】R753.1食管癌在我国的发病率和死亡率一直高居不下,进展期食管癌总体生存率低,但早期食管癌的5年生存率较高,为90%左右[1]。
因此加强早期食管癌及癌前病变的检出率是提高食管癌生存率的关键。
随着内镜检查设备的进步,使早期食管癌及癌前病变的检出率大大提高,其中食管鳞状上皮重度异型增生和原位癌为癌前病变,黏膜内癌和黏膜下癌且无淋巴结转移者为早期食管癌。
我科应用窄带成像技术(narrow-band imaging,NBI)结合放大胃镜对早期食管癌及癌前病变病例进行检查,根据日本AB分型法进行上皮乳头内毛细血管袢(intrapapillary capillary loop,IPCL)分型,结合其他相关检查(如超声内镜、CT等)结果,对符合内镜下治疗适应证的病例进行内镜下黏膜下剥离的切除治疗,对照术前术后对病变浸润深度的判断结果,探讨IPCL分型在判断早期食管癌及癌前病变浸润深度中的应用价值。

食管早期鳞癌(早癌系列一曲卫总结)一、基础知识:■□★☆▲△◆◇※◆上皮内瘤变:指细胞大小、形态及结构出现异常,包括多形态大小不等细胞、深染的细胞核分裂象,细胞极性消失。
根据细胞异型增生程度及上皮累及深度分低级别上皮内瘤变(对应轻度、中度异型增生)和高级别上皮内瘤变(对应重度异型增生和原位癌)。
低级别指异型细胞局限在上皮下1/2以内,高级别指异型细胞局限在上皮下1/2以上。
◆早期食管鳞癌:指局限于食管粘膜层的鳞状细胞癌,不论有无淋巴结转移。
◆浅表食管鳞癌巴黎分型(与早癌定义不同):见图1◆食管鳞癌高风险人群:符合以下任意1条,一般风险人群指无上述任意1条。
1、不良生活习惯:长期抽烟史、长期饮酒史,进食快、热、高盐(腌菜)。
2、本人曾患过癌症或者既往有食管病变史,如食管上皮内瘤变。
3、一级亲属有食管癌史。
4、长期居住于食管鳞癌高发区。
二、诊断知识:早期食管鳞癌患者临床上多无任何症状和体征,上消化道内镜检查结合组织病理学是食管鳞癌诊断的金标准。
困难病变依靠色素内镜和电子染色放大内镜(NBI)发现,然后靶向活检,通过组织病理学进行诊断。
需要对病变性质、浸润范围和浸润深度进行诊断。
推荐巴黎分型作为内镜下分型依据(隆起型、平坦型和凹陷型)。
诊断方法包括内镜和病理(内镜有普通内镜、色素内镜、电子染色内镜、放大内镜、超声内镜、共聚焦内镜)。
1、早期食管鳞癌分型◆早期食管鳞癌内镜下巴黎分型:分为隆起型、平坦型和凹陷型3种类型,见图2。
2、早期食管鳞癌及癌前病变内镜下表现⑴、普通内镜:⑵、色素内镜:主要是利用碘染色对食管病变进行诊断。
◆内镜下特点:碘染后出现粉红色征及NBI观察粉红色症出现银色征,食管炎症、低高级别内瘤变和癌变部位都可出现碘溶液不染区,借助粉红色征和银色征可以把高级别内瘤变、早癌和其他病变区分开来。
◆操作方法:卢戈氏碘配方?链蛋白酶冲洗食管去掉粘液,自贲门至口侧喷洒之食管上段,西甲硅油冲洗食管去掉多余的粘液和碘液,吸出胃腔内的碘液,硫代硫酸钠可中和碘液引起的不适感。
早期食管癌、胃癌内镜下表现及分型1、早期食管癌内镜下分型。
根据食管上皮乳头内毛细血管袢(IPCL)进行分型,IPCL 形态可反映组织的不典型增生和肿瘤浸润的深度。
AB 分型:Type A(7-10μm)血管形态没有变化或变化轻微正常;Type B 血管形态高度变化 SCC;B1(20-30μm)扩张、蛇行、直径不同、形状不均一的环状血管,浸润深度EP、LPM;B2 难以形成环状的异常血管,浸润深度 MM、SM1;B3(>60μm)高度扩张形态不整的血管(周围B2的约3倍),浸润深度SM2;Avascular area(AVA)type B 包围的无血管区域AVA-small <0.5mm浸润深度EP、LPM;AVA-middle 0.5mm-3.0mm浸润深度MM、SM1;AVA-large>3.0mm浸润深度SM2。
2、早期胃癌内镜下分型。
根据2002年巴黎分型,早期胃癌即type-0型胃癌,根据病变的形态特征可分为息肉状及非息肉状两大类。
息肉状病变在内镜中表现为形态隆起高于其周围黏膜,手术标本显示其隆起高度超过周围黏膜厚度的两倍(>2.5mm)。
此型尚可分为有蒂及无蒂两类,通常以0-Ⅰp及0-Ⅰs表示。
非息肉状病变可分为平坦型和凹陷型两大类,分别以0-Ⅱ和0-Ⅲ 表示,根据病变与周围黏膜的高低差异0-Ⅱ型可进一步区分为:0-Ⅱa,平坦隆起型;0-Ⅱb,平坦型;0-Ⅱc,平坦凹陷型。
此外,还有混合型,如 0-Ⅱa+Ⅱc 等。
根据日本国立癌症中心数据,临床常见的早期胃癌多表现为0-Ⅱ型,而0-Ⅱ型中又以0-Ⅱc及0-Ⅱc为主的混合型最为多见(78%),0-Ⅱa与0-Ⅱb少见(17%),0-Ⅰ型与0-Ⅲ型最少见(分别占3%与5%)。
0-Ⅰ型与 0-Ⅱa 型的区别在于病变隆起的高度不同,大致可以根据活检钳闭合时的厚度进行判断。
0-Ⅱc型与0-Ⅲ型的区别需要根据手术标本进行病理诊断才能准确判断,但内镜下可根据病变的凹陷状态进行大致判断,当上皮层出现明显的断裂时,可判断病变已浸透黏膜肌层即为0-Ⅲ型早期胃癌。
“BLI及LCI激光内镜在消化道病早癌诊断中的应用”学习笔记华人消化内镜论坛第二十五期—2017.01.04 20:00-22:00,上海长海医院王东教授、北京大学国际医院林香春教授做客华人消化内镜论坛QQ群,就“BLI及LCI激光内镜在消化道病早癌诊断中的应用”进行授课及回答全国网友提问,子敬(广东省连州市人民医院潘新智)记录下部分语音摘要分享如下:华人消化内镜论坛吴梓雷主任:全国消化内镜同道,大家晚上好,今天我们继续华人消化论第二十五期论坛的讲座,今天请来的中上海长海医院王东教授、北京大学国际医院林香春教授就BLI及LCI激光内镜在消化道病早癌诊断中的应用及相关问题进行学习和探讨。
下面把时间交给北京大学国际医院林香春教授主持。
主持嘉宾北京大学国际医院林香春教授:大家晚上好,很荣幸第二次到华人消化论坛来主持讲座,感谢吴梓雷主任团队提供了这么好的一个网上交流平台。
下面请出今晚的主讲王东教授。
上海长海医院王东教授:感谢林主任的介绍,我也是第二次来华人消化论坛授课,今天是应吴梓雷主任的邀请讲这个课题:“BLI及LCI激光内镜在消化道病早癌诊断中的应用”。
一、我国胃癌的早期诊断现状:1、我国内镜治疗技术水平飞速发展:内镜治疗范围逐渐扩大,中国医生的内镜治疗水平现在并不比外国差,但我国胃癌的早期诊断现状还是今人担忧:我国每年胃癌新发病例约40万例,死亡35万例,新发和死亡均占全世界胃癌病例的40%。
这是一个不光彩的数字,因此,降低我国胃癌的发病率和死亡率是亟待解决的重大公共卫生问题,我们是任重而道远。
2、上海市胃癌现状:每天新发癌症129人,15个是胃癌,每天死于癌症82人,11个是胃癌。
3、我国消化道肿瘤的早期诊断现状:与日韩比较,数据显示2005年日本是60%,韩国是55%,中国是15%。
在这方面我们确实是做得比较差。
4、今天要问我们会不会做内镜,大家肯定会不屑:谁不会做胃镜?!但做一例合格的胃镜却并非每个内镜医生都会。
怎么判断食管癌早期还是中期,治疗方法食管癌是一种具有高度恶性化倾向的消化系统恶性肿瘤,早期发现和治疗对患者生存率的提高至关重要。
如何判断食管癌早期还是中期、制定科学的治疗方案以及注意事项是治疗该病的重要内容。
本文将从以上三个方面进行探讨。
一、如何判断食管癌早期还是中期1. 病史和体征:食管癌早期症状不典型,可表现为咽部异物感,吞咽、胸痛或胃灼热等消化道不适,以及体重不易增加等。
体检时触及颈部、锁骨下可扪及颈部淋巴结,以及腹部触及肝、脾、肾等脏器异常肿大等。
2. 影像学检查:食管癌的影像学检查是诊断食管癌的重要方法,可以精确定位病变部位,判断病变范围、深度和有无远处转移等。
早期食管癌根据形态和大小不同,可分为四型:I型为圆形隆起型;II型为浅表溃疡型;III型为缩窄型;IV型为向外突出型。
3. 细胞学检查:可通过胃镜、纤维镜等手段对食管黏膜进行刷拭、活检、细胞学检查,确定病变是否为癌变,判断癌细胞的分化度、浸润深度等。
4. 肿瘤标志物检测:如CEA、CA19-9等,临床检查过程中可以检测体液和血浆中的肿瘤标志物,对判断病变的性质及其活动程度有一定的临床意义。
二、治疗方法对于早期食管癌,手术治疗仍然是首选,可采用开放手术或腔镜微创手术。
对于无法手术的患者可以选择介入治疗,如食管支架、内镜下切除和射频消融等。
对于进展期食管癌,治疗方式主要是化学放疗、手术及其联合治疗。
化疗的方式有单药或联合化疗,可提高手术切除率,减轻癌症的恶病质症状。
放疗通常与化学放疗联合使用,旨在控制肿瘤的进展,缩小肿瘤范围,同时减轻癌症病人的病症。
对于晚期食管癌,化疗联合放疗是主要治疗手段,可延长患者生命,并减轻恶病质症状。
抗PD-1单抗是近年来用于晚期食管癌治疗的新药,可在延长患者生命的同时改善患者的生活质量和良好的安全性。
三、注意事项1. 术后康复:食管癌手术后的康复非常重要,要注意减轻创伤引起的并发症,饮食要特别注意,早期应以液体为主,慢慢逐渐适应软食、半流食和正常饮食。
[收稿日期]2018-06-30 [修回日期] 2019-04-30[基金项目]广东省东莞市社会科技发展一般项目(201750715001287)[作者单位]广东省东莞市人民医院消化内科,523059[作者简介]李伊敏(1983-),女,主治医师.[文章编号]1000⁃2200(2019)06⁃0742⁃03㊃临床医学㊃IPCL 分类对食管早期肿瘤诊断价值的应用李伊敏,程树红,张世豪[摘要]目的:探讨食管上皮乳头内毛细血管袢(IPCL)分型对食管早期肿瘤的诊断价值㊂方法:选择接受食管胃镜检查发现疑似食管早期肿瘤的病人100例,随机分为IPCL 组和Lugol′s 组,各50例㊂所有病人先行普通白光内镜检查食管后,Lugol′s 组病人采用常规的碘染色检查;IPCL 组病人采用内镜窄带成像技术结合放大内镜检查;评价2种检查方法对病变组织观察的清晰度,并由操作对病变组织进行IPCL 进行分型与病理组织学检查结果进行比较,评价IPCL 分类对食管早期肿瘤的敏感度㊁特异度㊂结果:2组病人病变位置观察清晰度差异无统计学意义(P >0.05)㊂2组病人的诊断符合率㊁对早期食管癌的敏感性㊁阳性预测值差异均有统计学意义(P <0.05~P <0.01),2组病人的特异性差异无统计学意义(P >0.05);IPCL 分类对早期食管癌浸润深度的判断准确率为70.83%㊂结论:IPCL 分类可准确判断病变性质及浸润深度,有助于提高食管早期肿瘤的诊断率,对临床治疗具有重要的指导意义㊂[关键词]食管肿瘤;食管上皮乳头内毛细血管袢;内镜窄带成像技术[中图法分类号]R 735.1 [文献标志码]A DOI :10.13898/ki.issn.1000⁃2200.2019.06.012Application value of IPCL classification in the diagnosis of early esophageal cancerLI Yi⁃min,CHENG Shu⁃hong,ZHANG Shi⁃hao(Department of Gastroenterology ,Dongguan People′s Hospital ,Dongguan Guangdong 523059,China )[Abstract ]Objective :To investigate the diagnostic value of intrapapillary capillary loop (IPCL)classification in early esophageal cancer.Methods :One hundred patients suspected by early esophageal tumors under esophagogastroscopy were randomly divided into the IPCL group and Lugol′s group (50cases each group).After the esophagus in all patients were detected using routine white⁃lightendoscopy,the Lugol′s group was detected using the routine iodine staining,and the IPCL group was detected using the endoscopic narrow band imaying combined with magnifying endoscopy.The clarity of lesion tissue in two groups was evaluated,the IPCL classification of lesion tissue was compared with the results of histopathological examination,and the sensitivity and specificity of IPCL classification to early esophageal tumor were evaluated.Results :The difference of the clarity of lesion tissue between two groups was not statistically significant(P >0.05),and the differences of the diagnostic coincidence rate,sensitivity to early esophageal cancer and positive predictive value between two groups were statistically significant (P <0.05~P <0.01).The difference of the specificity between two groups was not statistically significant(P >0.05).The accuracy rate of the IPCL classification in the judgement of the depth of invasion of early esophageal cancer was 70.83%.Conclusions :IPCL classification can accurately judge the nature and depthof invasion of esophageal lesion,improve the diagnostic rate of early esophageal tumors,and has important guiding significance for clinical treatment.[Key words ]esophageal neoplasms;intrapapillary capillary loop;endoscopic narrow band imaging 食管癌是临床常见的恶性肿瘤之一,由于我国居民饮食习惯㊁环境污染等因素导致食管癌的发病率及死亡率居高不下[1]㊂及早发现并治疗是延长食管癌病人生命的关键,但食管癌发病隐匿,加之大部分病人缺乏防范意识,导致被发现时已经是癌症晚期,错过最佳治疗机会㊂同时检查技术的限制,也是导致食管肿瘤性病变难以被及时发现,延误治疗的重要因素,在食管肿瘤检查时准确判断病变性质和浸润深度是临床治疗的前提和基础[2]㊂近年来,随着新型内镜技术的不断发展,例如放大内镜(magnifying endoscope,ME)㊁窄带成像内镜(narrow band imaging,NBI)等技术的广泛应用,极大的提高了食管癌的早期发现率,但是对食管肿瘤的病变性质和浸润深度还存在一定的争议[3]㊂本研究采用NBI +ME 观察食管癌的食管上皮乳头内毛细血管袢(IPCL)分类与组织病理学对照,并探讨IPCL 分类对判断食管早期肿瘤的诊断价值,为临床治疗提供参考㊂现作报道㊂1 资料与方法1.1 一般资料 选择2016年6月至2018年5月247J Bengbu Med Coll ,June 2019,Vol.44,No.6在我院内镜中心接受食管胃镜检查发现疑似食管早期肿瘤的病人100例㊂纳入标准:(1)食管黏膜发生色调改变(黏膜发红或色泽浑浊);(2)食管黏膜出现树枝状血管网消失或者不清;(3)食管黏膜光泽浑浊,黏膜粗糙㊁表面轻微凹凸不平;(4)食管黏膜出现局部隆起或凹陷,或伴有糜烂;(5)食管黏膜见溃疡㊂排除标准:(1)已经明确诊断的食管息肉㊁Barrett食管㊁食管静脉曲张㊁食管憩室,确诊的食管肿瘤等;(2)对实验药剂过敏;(3)合并甲状腺功能亢进;(4)合并消化道梗阻或穿孔;(5)存在内镜操作禁忌证;(6)家属或病人不同意参与研究㊂随机将所有入组病人分为IPCL组和Lugol′s组,各50例,其中IPCL组男27例,女23例,年龄40~70岁; Lugol′s组男24例,女26例,年龄40~70岁㊂2组病人的性别㊁年龄差异均具有可比性㊂1.2 研究方法 所有病人术前禁食禁水,并在术前15min口服利多卡因胶浆以减轻内镜检查时的不适感㊂检查前,由护理人员对病人进行相关健康教育,了解检查的重要性,争取病人的配合㊂病人取左侧卧位,先进镜至十二指肠降部,然后缓慢退镜并不断打气,以充分暴露食管腔,先是在白光环境下仔细观察食管全程,期间可用清水或二甲硅油散液冲洗食管,尽可能的减少食管上的黏液及一些付着物㊂Lugol′s组:在白光环境下观察食管,发现有黏膜糜烂㊁粗糙以及黏膜的色调改变等,予0.6%Lugol′s 液染色,观察,明确病变染色级别㊁病变范围㊁病灶数目,初步判定病变可能的病理类型㊂IPCL组:进镜时白光下观察食管后,退镜切换成普通NBI模式,如发现褐色区域㊁白色调或异常部位,进一步对病人进行NBI+ME观察,识别病变界限,直接观察食管黏膜微血管的形态结构变化,根据IPCL的形态类型初步判定病变的病理组织学类型,进一步清晰显示病灶范围,鉴别癌与非癌组织,初步预测病变浸润深度㊂2组病人获取图像后,对可疑部位进行取材并进行病理检查㊂内镜检查与病理诊断均由同一位高年资医师进行操作㊂1.3 观察内容及IPCL分型 (1)观察2组病人不同检查方法下病变位置的清晰度,并参考文献对清晰度进行评分,清晰程度1~4分,分数越高表示越清晰㊂(2)IPCL Inoue分型标准:Ⅰ型,正常IPCL形态,形态规则,分布均匀;Ⅱ型:多见于食管炎,IPCL 轻度延长,但是排列分布较规整;Ⅲ型,多见于低级别上皮内瘤变,IPCL轻微变化,个别IPCL出现管径大小不一,轻度扭曲㊁扩张;Ⅳ型,多见于食管高级别上皮内瘤变和原位癌,扩张㊁扭曲㊁管径粗细不均和形态不规则4种改变中IPCL出现2~3种;V⁃1型,多见于食管鳞状细胞癌,同时具备扩张㊁扭曲㊁管径粗细不均和形态不规则4种改变,对应深度为M1;V⁃2型,多见于m2黏膜内癌,IPCL延长;浸润深入M2;V⁃3型,IPCL高度破坏,浸润深度M3㊁SM1;V⁃N 型,IPCL消失出现新的肿瘤血管;浸润深度SM2及以下㊂诊断效能采用敏感性㊁特异性㊁阳性预测值表示㊂1.4 统计学方法 采用χ2检验㊂2 结果2.1 2组病人不同检查方法下病变位置的清晰度比较 2组病人病变位置观察清晰度差异无统计学意义(P>0.05)(见表1)㊂ 表1 2组病人不同检查方法下病变位置的清晰度比较[n;百分率(%)]分组n1分2分3分4分χ2P IPCL组 500(0.00)4(8.00)9(18.00)37(74.00) Lugol′s组501(2.00)10(20.00)13(26.00)26(52.00)6.22>0.05合计100 2(2.00)14(14.00)22(22.00)63(63.00)2.2 2组病人病理检查结果 IPCL组病人病理检查结果显示低级别上皮内瘤变12例,高级别上皮内瘤变14例,食管鳞状细胞癌24例;Lugol′s组病人病理检查结果显示低级别上皮内瘤变11例,高级别上皮内瘤变12例,食管鳞状细胞癌27例㊂2.3 2组病人的诊断效能比较 IPCL组病人经检查,Ⅲ型7例,Ⅳ型12例,V⁃1型14例,V⁃2型16例,V⁃3型5例,V⁃N型4例㊂其中5例病人病理检查结果显示低级别上皮内瘤变,而IPCL分类为Ⅳ型;6例病人病理检查结果显示高级别上皮内瘤变,而IPCL分类为V⁃2型;3例V⁃2型病人,IPCL分类为V⁃1型;共14例病人与病理检查结果不符㊂24例早期食管癌病人与病理检查结果一致㊂Lugol′s 组病人经检查5例低级别上皮内瘤变被诊断为高级别上皮内瘤变,6例高级别上皮内瘤变被诊断为早期食管癌,27例早期食管癌病人中被诊断为低级别上皮内瘤变6例,高级别上皮内瘤变6例,食管鳞状细胞癌15例,共22例与病理结果一致㊂2组病人的诊断符合率㊁对早期食管癌的敏感性㊁阳性预测值差异均有统计学意义(P<0.05~P<0.01),2组病人的特异性差异无统计学意义(P>0.05)(见表2)㊂347蚌埠医学院学报2019年6月第44卷第6期表2 2组病人的诊断效能比较(%)分组n符合率敏感性特异性阳性预测值IPCL组5072.00(36/50)100.00(24/24)57.69(15/26)80.00(24/30) Lugol′s组5052.00(26/50)55.56(15/27)52.17(12/23)45.45(15/33)χ2 4.2413.950.157.95P <0.05<0.01>0.05<0.01 2.4 IPCL组对判断早期食管癌浸润深度的准确性 24例早期食管癌病人病理组织显示浸润M1层11例,M2层7例,M3层5例,SM1层1例,其中IPCL分类显示将4例M1层误判为M3层,3例SM1层误判为M3层,IPCL分类对早期食管癌浸润深度的判断准确率为70.83%(17/24)㊂3 讨论 食管癌的发病㊁发展往往需要经过上皮异型增生㊁原位癌㊁浸润癌等阶段,进展期食管癌因黏膜上皮形态和毛细血管形态结构改变典型容易被发现及诊断,但在癌组织局限于食管黏膜层或黏膜下层,尚无淋巴结转移的早期食管癌阶段,常规内镜检查时病人症状多表现为食管黏膜粗糙或糜烂,仅凭借常规内镜检查容易被漏诊或误诊,延误治疗时机[4-5]㊂因此,提高早期食管癌的诊断率对病人及时治疗,延长病人生命具有重要作用㊂准确观察和判断黏膜上皮形态和毛细血管形态结构改变是诊断早期食管癌的观念,随着内镜技术的不断发展,NBI很好的弥补了常规内镜的不足㊂NBI是通过特殊滤光器将白光环境中波长较长的红光过滤,仅留下蓝㊁绿㊁红色窄带光波,而这些窄带光波可提高黏膜上皮和黏膜下血管模式的清晰度㊂而早期食管癌常伴有上皮内毛细血管壁扩张和增生等症状,且血液中的血红蛋白能够大量吸收蓝光,因此NBI更容易观察到早期病变的形态改变[6-7]㊂而普通的白光内镜检查由于未经光学处理,其对病变部位观察的清晰度不如NBI 与放大内镜联合检查,本研究结果表明,NBI+ME 的清晰度4分病人例数明显多于白光检查㊂NBI+ ME检查更能够清晰的观察到食管黏膜IPCL的微小结构变化,通过对IPCL的分类便可进一步判断癌组织的浸润深入,因此,NE⁃NBI检查能对食管癌早期病变进行靶向活检,以指导临床治疗[7]㊂本研究对碘染色与IPCL分类诊断早期食管癌的结果进行了比较,结果表明IPCL分类诊断的诊断符合率,对早期食管癌的敏感性㊁特异性均较明显高于碘染色检查㊂这主要是由于NBI+ME观察更为清晰,很多微小的病灶也能够清晰显现,避免了经验性误差及因技术原因造成的漏诊,极大的提高了活检的准确率㊂而碘染色检查不仅操作时间较长,而且检查后还易出现胸骨后疼痛㊁烧心㊁呕吐等不良反应,对病人造成二次伤害[8];NBI+ME操作下进行IPCL分类,操作简单,诊断准确率高,无不良反应,受到医师和病人的认可㊂研究结果表明,当肿瘤局限于黏膜层时发生转移的风险较小,但是一旦侵犯到黏膜下层后,极大的增加了转移风险,因此对病变浸润深度的诊断也是影响治疗的重要因素[10]㊂IPCL分类能够对肿瘤浸润深度进行评估,以期为进一步治疗提供参考,在本研究中IPCL分类对浸润深度诊断的准确率为70.83%,准确率较高㊂另有3例病人浸润深度判断失误,其原因可能包括病变组织表明出血或覆盖白色斑块,为晚期清除表面黏液影响观察,操作不严密等因素造成的㊂综上所述,IPCL分类可准确判断病变性质及浸润深度,有助于提高食管早期肿瘤的诊断率,对临床治疗具有重要的指导意义㊂[参考文献][1] 谢招飞,江艳,陈素玉,等.IPCL分型在判断早期食管癌及癌前病变浸润中的应用[J].微创医学,2017,12(6):772. [2] KIM SJ,KIM GH,LEE MW,et al.New magnifying endoscopicclassification for superficial esophageal squamous cell carcinoma[J].World J Gastroenterol,2017,23(24):4416.[3] 冯业,李晓波,周颖,等.放大内镜结合窄带成像技术对早期食管癌及其浸润深度的诊断价值[J].胃肠病学,2016,21(10):602.[4] 杨小乔,张刚庆,梁彪,等.内镜窄带成像技术结合染色内镜在早期食管癌诊断中的临床应用[J].内科急危重症杂志,2015,21(1):26.[5] 滕晓琨,王国品.内镜窄带成像技术在食管癌前病变诊断中的应用价值[J].中国临床研究,2016,29(11):1493. [6] 陈晓琼,陈雅华,郑晓玲,等.日本食管协会分型中AB分型在早期食管鳞癌T分期的应用价值[J].中华消化内镜杂志,2016,33(9):621.[7] FUJIYOSHI T,TAJIKA M,TANAKA T,et parative eval⁃uation of new and conventional classifications of magnifyingendoscopy with narrow band imaging for invasion depth ofsuperficial esophageal squamous cell carcinoma[J].DisESophagus.2017,30(11):1.[8] 黄新香,黄朝忠,林海凤,等.上皮乳头内毛细血管袢分型对预测食管癌前病变及浅表癌浸润深度的价值[J].中外医疗,2017(36):47.[9] 江婷婷,王亚雷.窄带成像技术联合放大内镜靶向活检在早期胃癌诊断中的价值[J].安徽医科大学学报,2016,51(11):1693.[10] 程树红,张志坚,詹磊磊,等.早期胃癌与高级别上皮内瘤变内镜漏诊原因分析[J].中国内镜杂志,2015,21(9):919.(本文编辑 刘畅)447J Bengbu Med Coll,June2019,Vol.44,No.6。
INTRODUCTIONIn this session, the impact of a new magnification endoscopy in the diagnosis of esophageal and gastric lesions is discussed.Development of a new magnification endoscopy So far, many studies utilizing magnification endoscopy have been reported, but some limitations have existed to the routine use of it. Older magnifying endoscopes had a larger diameter, and were relatively difficult for insertion through the pharynx, and therefore magnifying endoscopy actually became an additional study to the routine endoscopic ex-amination. A new magnifying endoscope (Q240Z, Olympus Optical Co., Tokyo, Japan) keeps the same size in scope diameter approximately to a screening endoscope (Q240,Olympus). It also mounts a high resolution CCD tip same to a routine endoscope and it also has a 80¥magnifying power. In other words, an endoscopist can use a new magni-fying endoscope as a routine screening endoscopy if a magni-fying observation of the lesion is not necessary.Magnification endoscopic findings in the esophageal lesion In the esophagus, magnification endoscopy facilitates well, both to the diagnosis of the negatively stained lesion with iodine and to the evaluation of infiltration depth of squamous cell carcinoma. In squamous epithelium magnifi-cation, endoscopy reveals changes of fine vascular network pattern on the mucosa and submucosa. Regularly arranged intrapapillary capillary loops (IPCL) are normally observed by utilizing magnification endoscopy (Fig.1). IPCL shows characteristic changes in carcinoma in situ . Those include weaving, dilatation, irregular caliber and a different shape in each IPCL. According to the grade of IPCL changes, target epithelium can be diagnosed from normal mucosa (T ype I) to carcinoma (Type V) (Fig.2). By the evaluation of IPCL changes, infiltration depth of the cancerous lesion can also be assessed. In the m 1lesion, characteristic changes in are observed (Fig.2). In the m 2lesion the elongation of affected IPCL is observed, and in the m 3lesion destruction of IPCL becomes much more obvious. In the sm cancer, almost total IPCL has been destructed and a novel tumor vessel often appears (Fig.3). In the esophagus, the usefulness of magnify-ing endoscopy is gradually but steadily recognized.Digestive Endoscopy (2001) 13(Suppl.), S40–S41SESSION 2: MODERATOR’S COMMENTMAGNIFICATION ENDOSCOPY IN THE ESOPHAGUS AND STOMACHHaruhiro InoueShowa University, Northern Yokohama Hospital, Yokohama, JapanCorrespondence: Haruhiro Inoue, Assistant Professor Chief of Upper Gastrointestinal Endoscopy and Surgery, Showa University,Northern Yokohama Hospital, Chuo 35-1, Tsuzuki-ku, Yokohama 224-2503, Japan. Email: haru.inoue@med.showa-u.ac.jpFig.1. A schematic representation of the vascular network of esophageal mucosa. (a) Submucosal drainage vein; (b) arborescentvessel; (c) intrapapillary capilary loop.Fig.2.Classification of intrapapillary capillary loop (IPCL )pattern. Type I, positively stained with iodine; IPCL no different from normal pattern. Type II, positively stained with iodine;IPCL have one or two out of four characteristic changes, and elongation and/or dilatation is commonly seen. often. Type III, negatively stained with iodine; IPCL have no changes or minimal changes. Type IV , negatively stained with iodine; IPCL have three out of four characteristic changes described in Type V . Type V; negatively stained with iodine; IPCL have all four characteristic changes indicating carcinoma-in-situ: dilatation,torturous running, caliber changes and different shapes in each IPCL.Magnification endoscopy in the stomachYao and Oishi 1first presented a basic histologic aspect of magnifying endoscopy in the stomach, and then clarifiedMAGNIFICATION ENDOSCOPY IN THE ESOPHAGUS AND STOMACH S41a well-demarcated area with loss of superficial capillary network and disappearance of normal pits structure.Undifferentiated adenocarcinomaIn the mucosal lesion with no ulceration (por, sig), magnifica-tion endoscopy showed a reduced density of subepithelial capillary network depending on the thickness of the carci-noma cells in the lamina propria mucosa. Undifferentiated type cancer cells often invade the deeper layer with no destruction of the surface epithelium.Yagi 2presented his recent data regarding to Helicobacter pylori (HP) infection and magnifiction endoscopic findings.Magnification endoscopic findings in the gastric body are classified into Z-0 to Z-3. Z-0 means a regular arrangement of collecting venules, which corresponds well to the helicobacter negative mucosa with more than 90% accuracy. These findings are valuable advancements in the diagnosis of HP infection.In the stomach, magnifying findings are generally more complicated than those in the esophagus. The stomach displays many characteristic features. There are three different types of glands, gastritis, mucosal atrophy, HP infection, intestinal metaplasia, benign ulceration, ulcer scar, differentiated or undifferentiated type adenocarcinoma, and others. All those themes will be clarified in the near future.REFERENCES1.Yao K, Oishi T. Microgastroscopic findings of mucosal microvascular architecture as visualized by magnifying endo-scopy. Dig. Endosc . 2001; 13 (Suppl.): S27–33.2.Yagi K. Endoscopic features and magnified views of the corpus in the Helicobacter pylori-negative stomach. Dig.Endosc . 2001; 13(Suppl.): S34–5.Fig.3.Changes in an intrapapillary capillary loop (IPCL ),according to the infiltration depth of T1 esophageal cancer. m 1,Characteristic IPCL changes to intraepithelial carcinoma (Type V changes) only affect the top of IPCL. m 2, Type V changes affect the middle part of the IPCL, and are observed as an elon-gation of the affected IPCL. m 3, Type V changes affect the total length of IPCL and the original shape of the IPCL has been destroyed. sm, Abnormal tumor vessels with large diameters have appeared.the following findings mainly based on the microvascular structures.Differentiated type adenocarcinomaDye enhancement is useful in the diagnosis of a differentiated adenocarcinoma. Differntiated adnocarcinoma often has。