化学药剂诱导植物多倍体研究进展
- 格式:pdf
- 大小:174.97 KB
- 文档页数:3

植物多倍体诱导育种研究进展据统计,自然界大约有30%~35%的被子植物,其中70%的禾本科植物属于多倍体,它们在植物进化中起了重要的作用。
由于许多重要作物均是多倍体,因而,育种学家自30年代开始就热衷于多倍体诱导育种的研究。
随着对多倍体产生途径、特征、特性及鉴定方法等方面更为深入的研究,使多倍体诱导育种在育种领域显示出日益广阔的应用和发展前景。
本文就近年来在此领域所取得的成就做一概述。
1 多倍体产生途径自然界的多倍体在无性和有性阶段均可产生,无性阶段是体细胞分裂过程中偶然发生染色体加倍而造成,而有性阶段则是由于小孢子母细胞或大孢子母细胞在减数分裂过程中不减数产生了2n配子。
因此,人为地诱导体细胞不分裂和性细胞不减数是产生多倍体的有效途径。
1.1 无性阶段的诱导无性阶段的诱导可分为物理和化学诱导。
最早的物理诱导方式是在番茄上通过打顶而实现,后来人们利用高温或低温处理授粉后的幼胚,以及采用射线、中子、激光等辐照也实现了染色体的加倍。
但这些方法由于效率低等缺陷而未能普及,化学药品中的秋水仙素则克服了前述各种方法的缺陷,受到大多数育种学家的青睐。
秋水仙素诱导植物无性阶段产生多倍体,普遍采用浸种和滴涂生长点的方法。
早在1939年约翰斯通(Johnstone)就曾用0.15%和0.5%的秋水仙素浸泡马铃薯种子得到少量加倍植株,有效诱导率仅为0.1%~1%。
郭清泉等(1997)在研究莲时指出:莲种子长期浸泡易烂种;用注射器注秋水仙素入莲胚的方法由于难以找到生长点,针头刺伤胚易造成霉烂;点滴法则由于药液易滑落难于浸入生长点等造成多倍体诱导率低,而用溶有秋水仙素的琼脂凝胶包埋胚芽,使其诱导频率达46%,这是解决诱导频率低的一个重大突破。
但是,人们在研究中发现,这种在整体水平上染色体加倍的诱导,受环境干扰大,易产生嵌合体,并可能发生回复突变。
随着组织培养技术的发展,很多物种通过组培再生植株已经不存在障碍,这使秋水仙素在离体组织水平上诱导单个细胞内染色体加倍成为可能。

《利用秋水仙素诱导黑果枸杞多倍体研究》一、引言随着生物学领域中植物遗传和育种技术的发展,多倍体植物的生成及其潜在的应用价值已经得到了广泛的研究。
黑果枸杞作为一种富含营养和具有多种药理活性的植物,其多倍体的诱导研究具有十分重要的意义。
秋水仙素作为一种有效的染色体加倍剂,在植物育种中有着广泛的应用。
本文旨在探讨利用秋水仙素诱导黑果枸杞多倍体的方法及效果,为黑果枸杞的遗传育种和品种改良提供理论依据和实践指导。
二、材料与方法1. 材料本实验选用的材料为黑果枸杞的种子或幼苗。
秋水仙素作为诱导剂,其浓度和诱导时间将根据实验条件进行优化。
2. 方法(1)种子处理:将黑果枸杞的种子浸泡在秋水仙素溶液中,进行不同时间和浓度的处理。
(2)幼苗处理:选取健康的黑果枸杞幼苗,对其施加不同浓度和时间的秋水仙素处理。
(3)多倍体检测:通过显微镜观察染色体的数量和形态变化,确认多倍体的生成。
三、实验结果1. 种子处理结果通过不同浓度和时间处理的种子,我们发现秋水仙素能够有效地诱导黑果枸杞种子产生多倍体。
在一定的浓度和时间范围内,随着秋水仙素浓度的增加和时间的延长,多倍体的生成率逐渐提高。
但当浓度过高或时间过长时,可能会对种子产生负面影响,导致生长受阻或死亡。
2. 幼苗处理结果对于黑果枸杞幼苗的秋水仙素处理,我们发现幼苗对秋水仙素的反应更为敏感。
适当的秋水仙素处理可以显著提高多倍体的生成率。
然而,过高的浓度或过长的处理时间同样会对幼苗造成伤害,影响其正常生长。
3. 多倍体检测结果通过显微镜观察染色体的数量和形态变化,我们确认了黑果枸杞多倍体的生成。
多倍体的染色体数目明显增多,且染色体形态正常,没有明显的异常变化。
这表明秋水仙素的处理没有对黑果枸杞的基因组造成损伤,反而成功诱导了其染色体加倍。
四、讨论秋水仙素作为一种有效的染色体加倍剂,在黑果枸杞的多倍体诱导中发挥了重要作用。
实验结果表明,通过适当的秋水仙素处理,可以有效地诱导黑果枸杞产生多倍体。

一、实验目的1. 掌握化学诱导植物多倍体的原理和方法。
2. 学习利用秋水仙素诱导豌豆产生多倍体的实验操作。
3. 通过细胞学方法观察鉴定多倍体的特点,以及诱导染色体加倍后的细胞学表现。
二、实验原理1. 多倍体是指细胞中具有三个或三个以上染色体组的生物体。
在植物育种中,多倍体可以提高作物的经济性状,克服远缘杂交障碍等。
2. 秋水仙素是一种常用的化学诱导剂,能够抑制纺锤体的形成,导致染色体数目加倍,从而诱导植物产生多倍体。
三、实验材料与仪器1. 实验材料:豌豆种子、秋水仙素、蒸馏水、培养皿、镊子、剪刀、显微镜等。
2. 实验仪器:电子天平、高压蒸汽灭菌器、恒温培养箱、显微镜等。
四、实验步骤1. 种子处理:将豌豆种子浸泡在1%的氢氧化钠溶液中,室温下浸泡24小时,然后用蒸馏水冲洗干净。
2. 秋水仙素处理:将浸泡好的豌豆种子放入培养皿中,加入适量的秋水仙素溶液,使种子充分浸泡。
根据实验要求,调整秋水仙素浓度和浸泡时间。
3. 培养与观察:将处理过的豌豆种子放入恒温培养箱中,培养条件为温度25℃、光照12小时/天。
每隔一定时间观察种子发芽情况,记录数据。
4. 细胞学观察:选取长出的幼苗,用蒸馏水冲洗干净,取根尖分生组织区,制成临时装片。
5. 显微镜观察:在显微镜下观察细胞染色体的形态、数目等特征,分析多倍体诱导效果。
五、实验结果与分析1. 发芽情况:经过秋水仙素处理的豌豆种子,发芽率明显低于对照组。
随着秋水仙素浓度和浸泡时间的增加,发芽率逐渐降低。
2. 细胞学观察:在显微镜下观察发现,经秋水仙素处理的豌豆幼苗根尖分生组织区细胞染色体数目明显增多,部分细胞染色体数目为4倍体(二倍体细胞染色体数目为2倍)。
3. 多倍体诱导效果:秋水仙素处理对豌豆多倍体诱导效果明显,诱导出多倍体细胞。
六、实验结论1. 秋水仙素能够有效诱导豌豆产生多倍体。
2. 通过调整秋水仙素浓度和浸泡时间,可以控制豌豆多倍体诱导效果。
3. 细胞学观察结果表明,秋水仙素处理可以导致豌豆细胞染色体数目加倍,形成多倍体。



一、实验目的1. 掌握化学诱导植物多倍体的原理和方法。
2. 学习利用秋水仙素诱导植物多倍体的一般方法及多倍体诱导在植物育种上的意义。
3. 学习利用细胞学方法观察鉴定多倍体的特点及诱导染色体加倍后的细胞学表现。
4. 利用染色体分析的方法对多倍体的细胞做出准确判断。
二、实验原理生物体的细胞核中都有相对稳定的染色体数目,这是物种的基本特征之一。
多倍体是指细胞中具有3个或3个以上的染色体组的生物体。
在植物育种上,利用多倍体可以改良作物的经济性状,同时还可以利用多倍体克服远缘杂交过程中的障碍。
秋水仙素是一种常用的化学诱导剂,可以抑制细胞有丝分裂过程中纺锤体的形成,使子染色体不能移向两极,从而诱导植物产生多倍体。
在适宜浓度的秋水仙素作用下,细胞经一定时期后仍可恢复正常,继续分裂,只是染色体数目加倍成为多倍性细胞。
三、实验材料与仪器1. 实验材料:大蒜根尖分生组织区2. 试剂:0.2%秋水仙素溶液、卡诺氏液、改良苯酚品红染液、盐酸酒精溶液3. 仪器:显微镜、载玻片、盖玻片、吸管、滴管、酒精灯、烧杯、剪刀、镊子、培养皿四、实验步骤1. 将大蒜根尖分生组织区剪取约0.5cm,放入装有0.2%秋水仙素溶液的培养皿中,处理48小时。
2. 将处理后的根尖用蒸馏水清洗3次,放入装有卡诺氏液的培养皿中固定30分钟。
3. 将固定后的根尖用蒸馏水清洗3次,放入装有盐酸酒精溶液的培养皿中解离10分钟。
4. 将解离后的根尖用蒸馏水清洗3次,放入装有改良苯酚品红染液的培养皿中染色10分钟。
5. 将染色后的根尖用蒸馏水清洗3次,制成临时装片。
6. 在显微镜下观察染色体的形态和数目,记录观察结果。
7. 将观察结果进行统计分析,判断多倍体诱导率。
五、实验结果与分析1. 实验结果在显微镜下观察,部分大蒜根尖细胞染色体数目加倍,形成多倍体细胞。
染色体数目加倍现象主要出现在有丝分裂中期。
2. 分析通过实验,我们成功利用秋水仙素诱导了大蒜根尖分生组织区的多倍体。

2021近十年秋水仙素离体诱导植物多倍体的研究进展范文 多倍体植物在自然界中普遍存在,目前在农业生产中,主要农作物都是多倍体,如小麦为异源六倍体、棉花和油菜为异源四倍体、甘薯为同源六倍体,而水稻和玉米为二倍体化的古多倍体。
多倍化研究已经成为当前进化生物学、遗传学和基因组学领域的研究热点[1]. 多倍体通过自然加倍获得,但数量稀少,频率低,甚至在自然条件下不能正常生长而死亡,难以应用于生产实践中[2],因此,20世纪初育种家们开始对人工诱导多倍体进行探索。
起初,人工加倍的方法是通过物理的手段获得多倍体,如高温、辐射,但诱变率低下,常发生嵌合体[3].1937 年,Blakeslee 等[4]用秋水仙碱加倍曼陀罗等植物的染色体数获得了成功。
秋水仙素被广泛应用于培育植物新品种。
秋水仙素,即秋水仙碱,纯秋水仙碱呈黄色针状结晶,熔点157℃,易溶于水、乙醇和氯仿,味苦,有毒。
秋水仙素通过作用于有丝分裂中期使染色体加倍。
其原理是秋水仙素可以与α - 微管蛋白和β - 微管蛋白形成的二聚体特异性结合,减少了微管二聚体装配在微管上的数量,结果使微管拆卸的速度大于装配的速度,最终使形成的微管解聚,染色体加倍但细胞质不分裂,因此染色体数目加倍。
最初秋水仙素诱导多倍体是活体进行。
通过适当的操作,如点滴、注射、涂抹等诱导植株的顶芽、腋芽等位置,但活体操作时细胞的分裂不能同步,活体诱导较难得到纯合四倍体植株,大多为嵌合体,诱导率低。
随着生物技术的发展,离体诱导多倍体的条件已经十分成熟。
离体诱变育种有诸多优势:诱导率高;试验易于重复进行;嵌合体发生率低,方便纯化;时效快、操作方便;节省空间、人力物力;便于控制室温、光照等条件等。
张蜀宁等[5]利用秋水仙素离体诱导青花菜,得到变异植株 20 株,其中纯合植株有 19 株。
秋水仙素离体诱导同源多倍体在种质创新和新品种选育上发挥了重要作用,诱导产生的同源多倍体常伴随植物形态、解剖、生理、栽培特性等方面而改变,如叶片变厚变大、叶色加深、叶绿素含量增加;花器官、果实变大;维管束变大、抗逆性增强、生物量或生物有效成分增加等[6]. 同源多倍化引起的表型变化及其机理研究亦成为研究热点[7-8]. 本文总结了近十年秋水仙素离体诱导植物多倍体的研究进展,对影响诱导效率的因素如外植体类型、处理方法及其他因素进行了综述,并探讨了倍性嵌合体的分离方法、同源多倍化效应及其分子机理研究,旨在为从事植物多倍体研究的育种工作者提供参考。

植物多倍体育种研究进展【摘要】多倍体的研究一直是育种工作者热衷的方向,多倍体研究也越来越深入,本文概括了植物在多倍体育种的方法、倍性鉴定方法和发展趋势等方面的最新进展。
【关键词】多倍体,育种多倍体(polyploid)现象在植物界中早已存在,特别是在有花植物中最为普遍。
据报道,自然界中大约30%~35%的被子植物,70%的禾本科植物属于多倍体,多倍体在植物的进化和新物种的形成过程中起着十分重要的作用。
多倍体果树一般具有生长健壮、枝粗、叶厚、果大、少籽或无籽、产量高、适应性强和抗逆性强等优点,这些优点可用无性繁殖使其保持稳定而不出现分离,因此,多倍体育种倍受果树育种学家青睐。
一、诱导植物多倍体的方法(一)物理方法诱导多倍体自从1890~1901年间俄国学者格拉西莫夫用人工方法获得多倍体后,许多科学工作者都进行了人工诱导多倍体有效方法的探讨。
可以诱导多倍体的物理方法有温度的激变、机械创伤、离心力、紫外线、X射线和渗透压的改变,这些方法的普遍缺陷就是诱导率低,化学药剂的使用完全取代了利用物理手段来获得多倍体,这些方法已不再使用。
(二)化学药剂诱导多倍体可以诱导多倍体的化学药剂很多,如:秋水仙素、吲哚乙酸、苯及其衍生物、有机砷制剂、、磺胺剂及其它植物碱、麻醉剂和生长素等数百种,但使用最多,最有效的为秋水仙素。
秋水仙素阻碍纺缍丝的形成,使中期染色体不能分裂到两个细胞中。
从而导致了细胞中染色体数目的加倍。
利用秋水仙素处理分裂旺盛的组织就可以获得理想的多倍体,萌发的种子和生长点是最好的处理材料,常用的方法有:浸种法、滴苗法、涂抹法。
(三)利用组织培养技术诱导多倍体利用组织培养诱导多倍体的方法是最近十几年科研工作者采用较多的方法,该方法诱导率高,并可以克服同源多倍体孕性低的缺陷,有较大的发展潜力。
使用的前题必须是该植物的组织培养技术已经成熟。
组织培养中使细胞染色体加倍的因素很多,如叶片、茎段、根系等。
二、多倍体的鉴定(一)形态学鉴定染色体数目的变化导致了植株外部形态发生很大的变化。

植物多倍体育种研究进展随着人类不断发展和探索,植物多倍体育种这一课题也越来越受到关注和研究。
多倍体植物是指其细胞核染色体数目是正常二倍数的两倍或两倍以上,常见的有三倍体、四倍体、六倍体、八倍体等。
相对于单倍体或二倍体植物,多倍体植物具有更大的细胞和器官、更高的光合效率、更高的次生代谢产物含量等独特的特点。
在生产和育种上,多倍体植物也表现出了许多优势。
植物多倍体育种的研究可以追溯到20世纪初,最初主要是利用自然或人工诱导多倍体植物进行育种。
然而,这种方法效果不稳定、效率低且操作困难,限制了其在实际生产中的应用。
随着分子生物学和基因工程的发展,植物多倍体育种研究取得了许多进展。
接下来,我们将从以下三个方面来探讨植物多倍体育种的研究进展:多倍体植物的应用、多倍体植物的产生方式、多倍体植物的基因调控机制。
一、多倍体植物的应用多倍体植物具有更高的次生代谢产物含量,对于生物药物、香料、色素及其它次生代谢产物的生产具有广泛的应用前景。
例如,利用八倍体油菜籽中芥酸的含量高于二倍体的特点,可以制备出高品质的油菜籽油和脂肪酸。
此外,多倍体植物的营养更加丰富,对于育种中改良农作物品质有一定的作用。
比如,多倍体小麦不仅重量更大、单株籽粒数增多,而且蛋白质含量也更高。
二、多倍体植物的产生方式1. 自然多倍体植物产生:自然多倍体植物的产生一般是由于染色体分离不完全而引起的,或由于雄配子多倍化的缘故。
不过,自然多倍体植物的产生率很低,而且不能预测和控制,因此其在实际育种中的应用受到了较大的限制。
2. 化学方法诱导多倍体植物产生:另一种诱导植物多倍体的方法是化学方法。
通过处理植株根系的化学物质,使得植物的细胞分裂出现染色体不分离的现象,从而形成多倍体植株。
这种方法操作简便,但产生的多倍体植株繁殖能力有限,只有性繁殖,用于育种的耗时较长。
3. 细胞培养诱导多倍体植物产生:植物多倍体育种中,细胞培养诱导多倍体植物是最为常用、也是最有效的方法。

植物多倍体的诱导及其鉴定一、实验目的1、通过实验,掌握化学诱导植物多倍体的原理以及方法,学习利用秋水仙素诱导植物多倍体的一般方法及多倍体诱导在植物育种上的意义。
2.学习利用细胞学方法观察鉴定多倍体的特点以及诱导染色体加倍后的细胞学表现,利用染色体分析的方法对多倍体的细胞做出准确判断。
二、实验原理生物体的细胞核中都有相对稳定的染色体数目,这是物种的基本特征之一。
多倍体是细胞中具有3个或3个以上的染色体组的生物体。
在植物育种上,利用多倍体可以改良作物的经济性状,同时还可以利用多倍体克服远缘杂交过程中的障碍。
利用一些化学因素诱导植物产生多倍体,秋水仙素是诱导多倍体形成最有效和常用的药品之一,利用秋水仙素处理正在进行有丝分裂的细胞,可以抑制纺锤丝的形成,使细胞有丝分裂中期纺锤丝断裂或纺锤体形成受抑制,有丝分裂后期,复制的染色体无法移向两级,细胞内的染色体加倍,形成多倍体。
因此在适宜浓度的秋水仙素作用下,它既可以有效的阻止纺锤体的形成,又不至于对细胞发生较大的毒害,因此,细胞经一定时期后仍可恢复正常,继续分裂,只是染色体数目加倍成为多倍性细胞,并在此基础上进一步发育成为多倍体植物。
将秋水仙素处理的植物根尖,制成临时装片,利用显微镜观察根尖分生区细胞中的染色体数目而确定是否形成染色体。
三、实验材料、器具及试剂1、实验材料:发芽的蚕豆,蚕豆幼苗2、实验器具:显微镜、解剖针、小试管、刀片、镊子、载玻片、盖玻片、吸水纸、试管、培养皿、烧杯。
3、实验试剂:秋水仙素: 0.1%浓度。
卡诺固定液:3份95%酒精与1份冰醋酸配制而成。
1mol/l盐酸,45%醋酸,改良苯酚品红,70%酒精。
四、实验步骤1、取材:将种子消毒,并于无菌水中浸泡24小时后,将蚕豆种子(2n=16)培养在培养皿内的湿滤纸上,室温或28℃发芽,待胚根长达1~2cm时,取出萌发的种子,用自来水洗2~3次,备用。
2、预处理:将胚根长到1~2cm的蚕豆种子移到盛有0.1%秋水仙素的润湿的的吸水纸的培养皿内,室温下处理48h,待观察到根部有膨大时取出固定,与在水中进行培养的蚕豆种子(一般植物生长周期为17~18h)做对照。
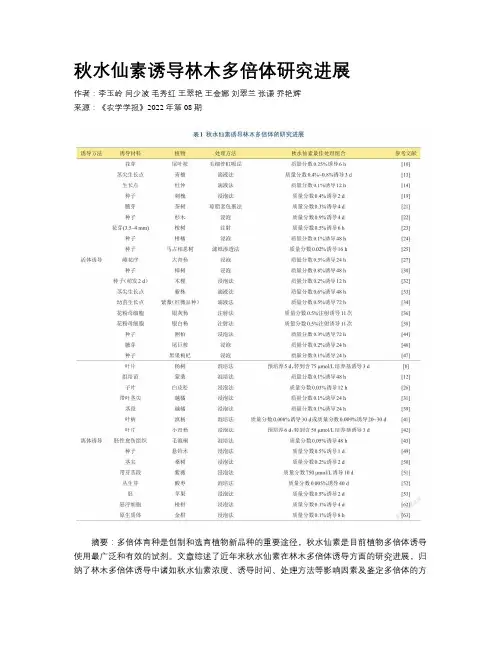
秋水仙素诱导林木多倍体研究进展作者:李玉岭闫少波毛秀红王翠艳王金娜刘翠兰张谦乔艳辉来源:《农学学报》2022年第08期摘要:多倍体育种是创制和选育植物新品种的重要途径,秋水仙素是目前植物多倍体诱导使用最广泛和有效的试剂。
文章综述了近年来秋水仙素在林木多倍体诱导方面的研究进展,归纳了林木多倍体诱导中诸如秋水仙素浓度、诱导时间、处理方法等影响因素及鉴定多倍体的方法。
指出林木多倍体存在嵌合体分离纯化繁琐缓慢、新诱导剂亟需开发、林木多倍体评价周期长、同源多倍体分子机理研究不足等问题,进而对上述问题给出相应的解决策略和建议。
该综述旨在为林木多倍体育种提供理论参考。
关键词:林木;多倍体;秋水仙素;研究进展;存在问题中图分类号:S722.5文献标志码:A论文编号:cjas2021-0077Polyploidy Induction by Colchicine in Forest Trees: Research ProgressLI Yuling1, YAN Shaobo2, MAO Xiuhong1, WANG Cuiyan3, WANG Jinna4, LIU Cuilan1, ZHANG Qian1, QIAO Yanhui1(1Shandong Academy of Forestry, Jinan 250014, Shandong, China;2Ludan (Shandong) Urban and Rural Cold Chain Industry and Finance Co., Ltd., Jinan 250010,Shandong, China;3Lancun Sub-district Office, Jimo District, Qingdao 266231, Shandong,China; 4Longkou City Garden construction and maintenance center, Yantai 265701,Shandong, China)Abstract: Polyploid breeding is an important way to create and select new varieties of plants. Colchicine is the most widely used and effective reagent for plant polyploidy induction at present. In this paper, the research progress of colchicine in forest polyploidy induction in recent years is reviewed, and the influencing factors such as colchicine concentration, induction time, treatment methods and the methods for identifying polyploidy are summarized. It is pointed out that there are some problems in forest polyploidy, such as tedious and slow separation and purification of chimeras, urgent development requirement of new inducers, long evaluation period of forest polyploidy, and insufficient research on molecular mechanism of autopolyploid. Then,corresponding solutions and suggestions are given. The purpose of this review is to provide theoretical reference for forest polyploidy breeding.Keywords: forest tree; polyploidy; colchicine; research progress; existing problems0引言多倍體在生物界中普遍存在,是指体细胞内含有3套及3套以上染色体组的个体,尤其在高等植物中较常见,根据染色体组来源不同,分为同源、异源多倍体[1]。
牧草育种中多倍体诱导方法研究进展刘芳1,侯建华1,*(1.内蒙古农业大学,内蒙古呼和浩特010010;2.中国农业科学院草原研究所,内蒙古呼和浩特010010)摘要:主要介绍了牧草育种中化学和组织培养方法诱导染色体加倍的研究进展,并提出其发展趋势。
关键词:牧草育种;染色体加倍;秋水仙素;除草剂;组织培养中图分类号:文献标识码:A多倍体是高等植物染色体进化的显著特征。
多倍体多个染色体组所产生的累积效应使其生物量、矿物质及营养成分增加,在性状上表现为叶大、花大、茎粗、色深、细胞内某些物质含量较高以及植株的生态适应力和抗逆性增强[1]。
多年来,人工诱导多倍体的研究一直吸引着广大植物育种工作者。
在众多的多倍体诱导方法中,秋水仙素诱导法效果理想、操作简单、成本也相对较低。
秋水仙素被认为是使用最广泛的植物加倍化学药剂[2]。
氨磺乐灵(Oryzalin)、甲酰胺草磷(Amiprophose methyl,APM)和氟乐灵(Trifluralin)等除草剂对一些植物中的离体多倍体诱导程度比秋水仙素高,药害程度比秋水仙素轻微,其应用范围正在扩大。
而随着植物组织培养技术的发展,化学药剂可以在离体条件下诱导单个细胞染色体加倍,获得多倍体再生,克服常规人工加倍处理方法的缺陷。
1 化学方法,1.1 秋水仙素在化学加倍法中的应用江西省畜牧技术推广站从伯克(Birca)多花黑麦草中优选单株,用秋水仙素使染色体加倍后,又经60Co射线辐射种子,选育出四倍体赣选1号多花黑麦草[3]。
冰草中同源多倍体比较普遍,将二倍体诱导成四倍体是易于成功的,再把诱导成的四倍体与天然四倍体杂交,是冰草中最有前途的远缘杂交策略。
冰草杂交品种Hycrest就是由诱导的四倍体冰草与天然的四倍体沙生冰草杂交获得[4]。
羊茅黑麦草种群的染色体加倍通常也采用秋水仙素的加倍方法[5]。
这一工作既可在杂交前进行,也可在杂交后进行。
通过种间杂交辅之以染色体加倍,人们现已从羊茅黑麦草种群中获得如下3 个模式品种:(1) 黑麦草杂种品种。
Botanical Research 植物学研究, 2021, 10(3), 313-318Published Online May 2021 in Hans. /journal/brhttps:///10.12677/br.2021.103042植物多倍体诱导方法研究进展汤迪霏1,2*,袁晓伟1,2#,郭仰东2#,李兴盛11山东省华盛农业股份有限公司,山东青州2中国农业大学园艺学院,北京收稿日期:2021年3月15日;录用日期:2021年5月13日;发布日期:2021年5月24日摘要植物染色体多倍化在育种、生产中有非常重要的意义。
本文综述了诱导植物多倍体的主要方法,有物理诱导法、化学诱导法以及其他方法。
有望为今后多倍体技术的研究及应用提供理论依据。
关键词植物多倍体,诱导,研究进展Advances in Plant Polyploid InductionDifei Tang1,2*, Xiaowei Yuan1,2#, Yangdong Guo2#, Xingsheng Li11Shandong Huasheng Agriculture Co., Ltd., Qingzhou Shandong2College of Horticulture, China Agricultural University, BeijingReceived: Mar. 15th, 2021; accepted: May 13th, 2021; published: May 24th, 2021AbstractPlant polyploidy is of great significance in breeding and production. In this paper, the main me-thods of inducing plant polyploids are reviewed, including physical induction, chemical induction and other methods. It is expected to provide theoretical basis for the research and application of polyploid technology in the future.KeywordsPlant Polyploidy, Induction, Research Progress*第一作者。
秋水仙素在诱导我国果树多倍体的应用研究进展张美华,李慧敏*,莫干辉,谭奕为,苏文潘,李伟强,李菊馨,黄倩盈,吴耿寰,莫德原(广西壮族自治区亚热带作物研究所,广西南宁530001)摘要:多倍体育种是创造和选育果树新品种的重要途径,秋水仙素是目前果树多倍体诱导使用最广泛和有效的试剂。
对近年来我国果树在秋水仙素多倍体诱导方面的应用进行了概述。
包括利用秋水仙素诱变已经获得多倍体的果树种类及其品种,诱导多倍体的途径及倍性鉴定方法,指出目前果树存在获得新品种较少及嵌合体问题,并对上述问题给出相应的解决策略及建议。
关键词:秋水仙素;果树;多倍体;研究进展中图分类号:S66文献标志码:AColchicine Application in Polyploid Induction ofFruit Trees in China:A ReviewZHANG Meihua,LI Huimin *,MO Ganhui,TAN Yiwei,SU Wenpan,LI Wei-qiang,LI Juxin,HUANG Qianying,WU Genghuan,MO Deyuan(Guangxi Subtropical Crops Research Institute Nanning,Guangxi 530001,China)Abstract:Polyploid breeding is an important way to create and select new cultivars of fruit trees.At present,colchicine is the most widely used and effective reagent for fruit trees polyploid in ‐duction.This paper reviewed research progress on polyploid induction of fruit trees using colchicine in recent years,including achievements of polyploid species and varieties,induction pathways and identification methods and figured out problems of lack of new cultivars and chimera.Then,corre ‐sponding solutions and suggestions were given.Key words:Colchicine;fruit trees;polyploid;research progress基金项目:广西农业科学院科技发展基金项目(桂农科2022JM94)。
植物多倍体诱发和鉴定实验报告一,试验目的1.通过试验掌握植物多倍体化学诱导的原理和方法研究用秋水仙素进行植物多倍体诱导的常用方法和多倍体诱导对植物育种的重要性。
2、学会用细胞学方法来观察和识别多倍体特征及诱导染色体加倍的细胞学表现并通过染色体分析对多倍体细胞作出精确判断。
二,实验原理生物体内细胞核内均存在着比较稳定的染色体数量,这也是最基本的物种特征。
多倍体指细胞内有三个或更多染色体组存在的生物体。
在植物育种中,用多倍体可使作物经济性状得到改善,但也能用多倍体来克服远缘杂交时遇到的阻碍。
用某些化学因素来诱导植物多倍体的发生,其中秋水仙素对诱导多倍体的发生作用最大,也是目前使用频率最高的药物,用秋水仙素来处理进行有丝分裂过程中的细胞能抑制纺锤丝发生,从而在细胞有丝分裂过程中期纺锤丝被打断或者纺锤体的发生受到抑制,而在有丝分裂过程后期复制染色体不能移动到2个水平上,在细胞中染色体发生倍增而发生多倍体。
所以当秋水仙素浓度合适时,既能有效地阻断纺锤体生成,也不会对细胞产生很大毒害,所以细胞经过一段时间之后仍然能恢复正常而持续分裂,只需染色体数量倍增为多倍性细胞就能以此为基础进一步发展成多倍体植物。
用秋水仙素加工植物根尖制作临时装片并在显微镜下观察根尖分生区细胞内染色体的数量来判断染色体形成与否。
三,实验的材料,用具和试剂1.试材:萌发蚕豆及蚕豆幼苗2.实验器具,显微镜,解剖针,小试管,刀片,镊子,载玻片,盖玻片,吸水纸,试管,培养皿,烧杯等。
3.实验试剂为秋水仙素,浓度为1度。
卡诺固定液:由三种95%酒精和一种冰醋酸混合制成。
1mol·l-1盐酸、1mol·L-1醋酸、改良苯酚品红、1mol-1酒精。
四,试验步骤1.取材:种子经消毒后在无菌水中浸泡24 h,取蚕豆种子(2n=16)置于培养皿中湿滤纸中,常温或28℃条件下催芽,胚根长1~2cm,取催芽种子用自来水冲洗2~3遍待用。
2.预处理:取胚根长1~2cm蚕豆种子,移入装有蚕豆种子秋水仙素湿润吸水纸培养皿中,常温处理48h后,观察根部膨大情况后取出固定不动,并以水中培养蚕豆种子(通常植物生长周期17~18h)作对照。