单脱氢抗坏血酸还原酶(MDHAR)活性测定试剂盒说明书
- 格式:doc
- 大小:56.50 KB
- 文档页数:2
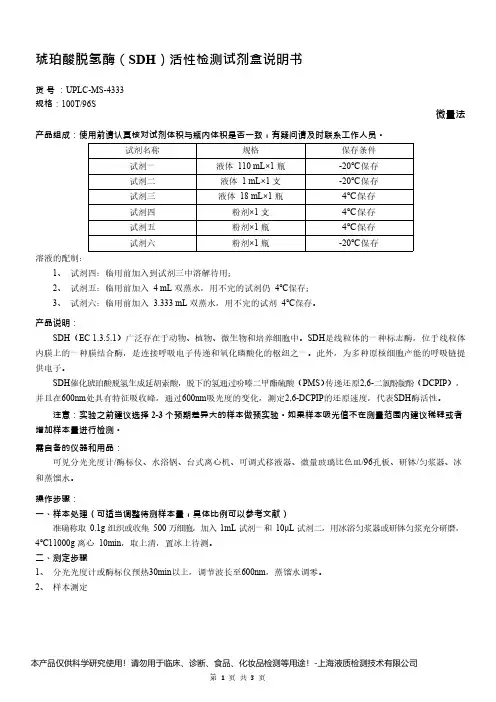
琥珀酸脱氢酶(SDH)活性检测试剂盒说明书货号:UPLC-MS-4333规格:100T/96S微量法产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件试剂一液体110mL×1瓶-20℃保存试剂二液体1mL×1支-20℃保存试剂三液体18mL×1瓶4℃保存试剂四粉剂×1支4℃保存试剂五粉剂×1瓶4℃保存试剂六粉剂×1瓶-20℃保存溶液的配制:1、试剂四:临用前加入到试剂三中溶解待用;2、试剂五:临用前加入4mL双蒸水,用不完的试剂仍4℃保存;3、试剂六:临用前加入3.333mL双蒸水,用不完的试剂4℃保存。
产品说明:SDH(EC1.3.5.1)广泛存在于动物、植物、微生物和培养细胞中。
SDH是线粒体的一种标志酶,位于线粒体内膜上的一种膜结合酶,是连接呼吸电子传递和氧化磷酸化的枢纽之一。
此外,为多种原核细胞产能的呼吸链提供电子。
SDH催化琥珀酸脱氢生成延胡索酸,脱下的氢通过吩嗪二甲酯硫酸(PMS)传递还原2,6-二氯酚靛酚(DCPIP),并且在600nm处具有特征吸收峰,通过600nm吸光度的变化,测定2,6-DCPIP的还原速度,代表SDH酶活性。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计/酶标仪、水浴锅、台式离心机、可调式移液器、微量玻璃比色皿/96孔板、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)准确称取0.1g组织或收集500万细胞,加入1mL试剂一和10μL试剂二,用冰浴匀浆器或研钵匀浆充分研磨,4℃11000g离心10min,取上清,置冰上待测。
二、测定步骤1、分光光度计或酶标仪预热30min以上,调节波长至600nm,蒸馏水调零。
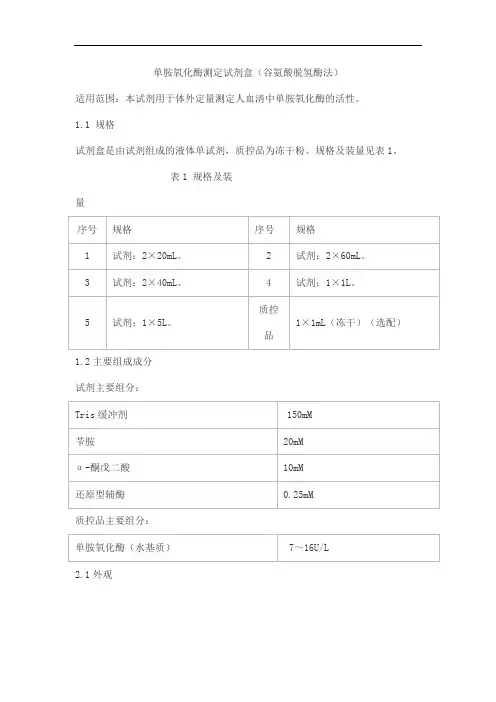
单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:本试剂用于体外定量测定人血清中单胺氧化酶的活性。
1.1 规格试剂盒是由试剂组成的液体单试剂,质控品为冻干粉。
规格及装量见表1。
表1 规格及装量1.2主要组成成分试剂主要组分:质控品主要组分:2.1外观试剂为无色透明澄清液体,液体试剂不得有沉淀和絮状物;质控品为白色至浅黄色冻干粉,复溶后为无色至浅黄色透明液体。
试剂盒外观应整洁,文字符号标识清晰。
2.2装量试剂瓶内液体装量不应低于规定规格的标准体积。
2.3 空白吸光度当用纯化水作样本分析时,波长340nm(副波长405nm), 比色光径1cm, 反应温度37℃检测,吸光度大于1.0。
2.4分析灵敏度测定浓度为20U/L的样品时吸光度差值:△A≥0.005。
2.5线性2.5.1在(1,98]U/L区间内,线性回归的相关系数r应不低于0.990;2.5.2(1,45)U/L区间内绝对偏差不超过±6.75U/L;[45,98]U/L区间内相对偏差不超过±15%。
2.6重复性重复测试控制血清,变异系数(CV)应<10%。
2.7 准确度参照EP9-A2的方法,用比对试剂盒同时测试40例线性区间内的不同浓度的血清样本。
其相关系数(r)不小于0.990。
每个浓度点在(1,45)U/L区间内绝对偏差不超过±6.75U/L;[45,98]U/L区间内相对偏差不超过±15%。
2.8批间差试剂(盒)批间相对极差应<15%。
2.9 质控品批内瓶间差变异系数(CV)应≤10%。
2.10质控品赋值有效性质控品测值应在靶值范围内。
2.11 稳定性2.11.1效期稳定性原包装的试剂盒在2℃~8℃条件下贮存达到18个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7、2.10之规定。
2.11.2复溶稳定性质控品复溶后在2℃~8℃密闭避光保存,稳定期为7天,稳定期满后1天内,性能应符合2.10的要求。

单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:用于体外定量测定人血清中单胺氧化酶的活性。
1.1 产品型号/规格1×32 ml;2×25 ml;1×45 ml;2×45 ml;4×45 ml ;1×50 ml ;2×50 ml;4×50 ml;8×50 ml;1×60 ml;2×60 ml;2×70 ml;6×70 ml;2×100 ml;4×100 ml;2×16 ml;4×24 ml;8×24 ml;1×25 ml;4×60 ml;8×60 ml。
1.2 主要组成成分Tris缓冲液 150 mmol/Lα-酮戊二酸10 mmol/L 乙二胺四乙酸(ETDA) 2 mmol/L谷氨酸脱氢酶 1 KU/L苄胺20 mmol/L烟酰胺腺嘌呤二核苷酸(NADH)0.25 mmol/LProclin-300 0.1%2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 试剂应为无色至浅黄色澄清液体。
2.2 净含量不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在光径1 cm、主波长340 nm下,以纯化水为检测样本时,吸光度应不小于0.800。
2.3.2 试剂空白吸光度变化率在光径1 cm、主波长340 nm下,以纯化水为检测样本时,吸光度变化率(△A/min)应小于0.01。
2.4 分析灵敏度MAO含量为6 U/L时,测定吸光度变化率(△A/min)应不小于0.001。
2.5 线性范围MAO试剂在线性范围[0.5,100] U/L内:(a)相关系数r应不小于0.990;(b)在[0.5,10]U/L范围内,线性绝对偏差应不超过±1 U/L;(c)在(10,100]U/L范围内,线性相对偏差应不超过±10 %。
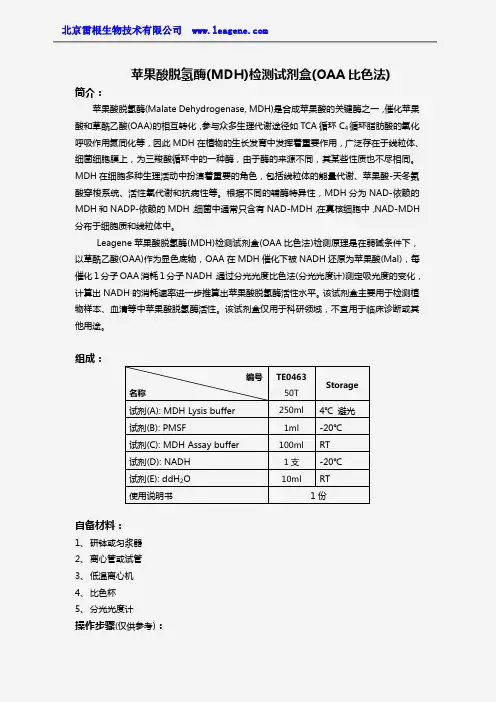
苹果酸脱氢酶(MDH)检测试剂盒(OAA比色法)简介:苹果酸脱氢酶(Malate Dehydrogenase,MDH)是合成苹果酸的关键酶之一,催化苹果酸和草酰乙酸(OAA)的相互转化,参与众多生理代谢途径如TCA循环C4循环脂肪酸的氧化呼吸作用氮同化等,因此MDH在植物的生长发育中发挥着重要作用,广泛存在于线粒体、细菌细胞膜上,为三羧酸循环中的一种酶,由于酶的来源不同,其某些性质也不尽相同。
MDH在细胞多种生理活动中扮演着重要的角色,包括线粒体的能量代谢、苹果酸-天冬氨酸穿梭系统、活性氧代谢和抗病性等。
根据不同的辅酶特异性,MDH分为NAD-依赖的MDH和NADP-依赖的MDH,细菌中通常只含有NAD-MDH,在真核细胞中,NAD-MDH 分布于细胞质和线粒体中。
Leagene苹果酸脱氢酶(MDH)检测试剂盒(OAA比色法)检测原理是在弱碱条件下,以草酰乙酸(OAA)作为显色底物,OAA在MDH催化下被NADH还原为苹果酸(Mal),每催化1分子OAA消耗1分子NADH,通过分光光度比色法(分光光度计)测定吸光度的变化,计算出NADH的消耗速率进一步推算出苹果酸脱氢酶活性水平。
该试剂盒主要用于检测植物样本、血清等中苹果酸脱氢酶活性。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、研钵或匀浆器2、离心管或试管3、低温离心机4、比色杯5、分光光度计操作步骤(仅供参考):编号名称TE046350TStorage试剂(A):MDH Lysis buffer250ml4℃避光试剂(B):PMSF1ml-20℃试剂(C):MDH Assay buffer100ml RT试剂(D):NADH1支-20℃试剂(E):ddH2O10ml RT使用说明书1份1、配制MDH Lysis buffer工作液:取出MDH Lysis buffer和PMSF,恢复至室温,MDHLysis buffer:PMSF按一定比例混合,混匀,即配即用,不易久置,否则白酶抑制剂PMSF的效率会有所下降。

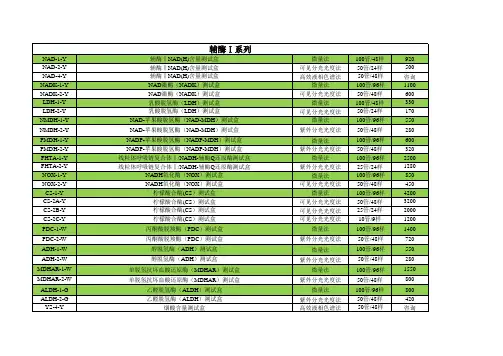
硝酸还原酶(NR )活性检测试剂盒(Griess 显色法)说明书微量法货号:BC4965规格:100T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件诱导剂储备液液体100 mL×1瓶4℃保存提取液液体60 mL×1瓶4℃保存试剂一液体5 mL×1瓶-20℃保存试剂二粉剂×2支-20℃保存试剂三液体6 mL×1瓶4℃保存试剂四液体6 mL×1瓶4℃保存标准品液体1 mL×1支4℃保存溶液的配制:1、诱导液:将诱导剂储备液用蒸馏水10倍稀释后使用,即取10 mL 诱导剂储备液加90 mL 蒸馏水,充分混匀。
现配现用。
2、试剂二:加入1mL 蒸馏水,-20℃分装保存,可以-20℃保存2周。
临用前用蒸馏水将试剂二稀释50倍,备用,即取10 μL 试剂二加入490 μL 蒸馏水混匀。
3、标准品:10 μmol/mL 亚硝酸钠标准溶液。
临用前将用蒸馏水标准溶液稀释100倍得到0.1 μmol/mL 的亚硝酸钠标准液,备用。
产品说明:NR (EC 1.7.1.3)广泛存在于植物中,是植物硝态氮转化为氨态氮的关键酶,也是诱导酶,对作物的产量和品质有影响。
NR 催化硝酸盐还原为亚硝酸盐,NO 3ˉ +NADH+H +→NO 2ˉ+NAD ++H 2O 。
在酸性条件下,产生的NO 2ˉ能够参与重氮化反应生成紫红色化合物,这种紫红色化合物在540 nm 处有吸收峰,540 nm 下吸光值的变化即可表示酶活。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计/酶标仪、水浴锅、台式离心机、微量玻璃比色皿/96孔板、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1、组织前处理:(1) 取适量诱导液于烧杯中,将新鲜标本洗净,滤纸吸干,放入诱导液中(淹没即可),避光浸泡2 h ,取出样本,滤纸吸干后,-20℃冷冻30 min ,取出样本,滤纸吸干。

NAD-苹果酸脱氢酶(NAD-MDH)试剂盒使用说明货号:BC1040规格:50管/48样产品内容:试剂一、提取液60mL×1瓶,在4℃保存;试剂二、液体50mL×1瓶,在4℃保存;试剂三、粉剂×2支,-20℃保存;临用前加入300μL蒸馏水,用不完的试剂仍-20℃保存;试剂四、粉剂×2支,-20℃保存;临用前加入300μL蒸馏水,用不完的试剂仍-20℃保存。
产品说明:MDH(EC1.1.1.37)广泛存在于动物、植物、微生物和培养细胞中,线粒体中MDH是TCA循环的关键酶之一,催化苹果酸形成草酰乙酸;相反,胞浆中MDH催化草酰乙酸形成苹果酸。
草酰乙酸是重要的中间产物,连接多条重要的代谢途径。
因此,MDH在细胞多种生理活动中扮演着重要的角色,包括线粒体的能量代谢、苹果酸-天冬氨酸穿梭系统、活性氧代谢和抗病性等。
根据不同的辅酶特异性,MDH分为NAD-依赖的MDH和NADP-依赖的MDH,细菌中通常只含有NAD-MDH,在真核细胞中,NAD-MDH分布于细胞质和线粒体中。
NAD-MDH催化NADH还原草酰乙酸生成苹果酸,导致340nm处光吸收下降。
需自备的仪器和用品:紫外分光光度计、台式离心机、水浴锅、可调式移液器、1mL石英比色皿和蒸馏水。
操作步骤:一、样本测定的准备:三、NAD-MDH活力单位的计算:1、血清(浆)NAD-MDH活力的计算单位的定义:每毫升血清(浆)每分钟消耗1nmol的NADH定义为一个酶活力单位。
NAD-MDH(U/mL)=[ΔA×V反总÷(ε×d)×109]÷V样÷T=6430×ΔA2、组织、细菌或细胞中NAD-MDH活力的计算:(1)按样本蛋白浓度计算:单位的定义:每mg组织蛋白每分钟消耗1nmol的NADH定义为一个酶活力单位。
NAD-MDH(U/mg prot)=[ΔA×V反总÷(ε×d)×109]÷(V样×Cpr)÷T=6430×ΔA÷Cpr(2)按样本鲜重计算:单位的定义:每g组织每分钟消耗1nmol的NADH定义为一个酶活力单位。

单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:用于体外定量测定人血清中单胺氧化酶的活性。
1.1包装规格a) 试剂1:1×60ml,试剂2:1×15ml;b) 试剂1:2×60ml,试剂2:2×15ml;c) 试剂1:4×60ml,试剂2:1×60ml;d) 试剂1:2×40ml,试剂2:2×10ml;e) 试剂1:2×400ml,试剂2:2×100ml;f) 试剂1:2×80ml,试剂2:2×20ml;g)试剂1:6×16ml,试剂2:6×4ml;h)试剂1:1×20ml,试剂2:1×5ml。
1.2主要组成成分试剂1主要组成成分:Tris缓冲液 (PH 7.0-10.0) ≥200mmol/LNADPH ≥0.2mmol/L试剂2主要组成成分:Tris缓冲液 (PH 6.0-9.0) ≥200mmol/Lα-酮戊二酸≥10mmol/L苄胺≥30mmol/L2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1 试剂空白吸光度测定试剂空白吸光度,应≥0.5。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.1。
2.4 分析灵敏度测试180U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.003。
2.5 准确性回收率,应在80%~120% 范围内。
2.6 重复性变异系数(CV)应不超过5%。
2.7 线性2.7.1 在(1,200)U/L范围内,线性回归的相关系数应不低于0.990;2.7.2 测试浓度(30,200)U/L的样品,相对偏差≤15%;测试浓度(1,30]U/L 的样品,绝对偏差≤5U/L。

货号:QS1304 规格:50管/48样抗坏血酸过氧化物酶活性测定试剂盒(APX)说明书紫外分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:APX是植物清除活性氧的重要抗氧化酶之一,也是抗坏血酸代谢的关键酶之一。
APX具有多种同功酶,分别定位于叶绿体、胞质、线粒体、过氧化物和乙醛酸体,以及过氧化体和类囊体膜上。
APX 催化H2O2氧化AsA,是植物AsA 的主要消耗者。
APX的活性直接影响到AsA的含量,APX与AsA具有一定的负相关性。
测定原理:APX 催化催化H2O2氧化AsA,通过测定AsA氧化速率,来计算得APX活性。
自备实验用品及仪器:低温离心机、紫外分光光度计、1mL石英比色皿、移液枪、研钵、冰和蒸馏水。
试剂组成和配制:试剂一:液体90mL×1瓶,4℃保存。
试剂二:粉剂×1瓶,4℃避光保存。
临用前加5 mL蒸馏水充分溶解。
试剂三:液体5mL×1支,4℃保存。
粗酶液提取:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
13000g,4℃离心20min,取上清置冰上待测。
测定:1. 分光光度计预热30 min,调节波长到290nm,用蒸馏水调零。
2. 试剂一在25℃中预热30min。
3. 依次在1mL石英比色皿中加入100μL上清液、700μL预热的试剂一、100μL试剂二和100μL试剂三,迅速混匀后在290nm测定10 s和130 s光吸收A1和A2,△A=A1-A2。
APX活性计算公式:(1) 按样本蛋白浓度计算活性单位定义:每毫克蛋白每分钟氧化1μmol AsA 为1个酶活单位。
APX(μmol/min/mg prot) = △A÷(ε×d)×V反总×106÷(Cpr×V样)÷T=1.79×△A÷ Cpr(2)按样本质量计算活性单位定义:每g组织每分钟氧化1μmol AsA 为1个酶活单位。

货号:MS1304 规格:100管/96样抗坏血酸过氧化物酶(APX)活性测定试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:APX 是植物清除活性氧的重要抗氧化酶之一,也是抗坏血酸代谢的关键酶之一。
APX 具有多种同功酶,分别定位于叶绿体、胞质、线粒体、过氧化物和乙醛酸体,以及过氧化体和类囊体膜上。
APX 催化 H 2 O 2 氧化 AsA,是植 AsA 的主要消耗者。
APX 的活性直接影响到AsA 的含量,APX 与 AsA 具有一定的负相关性。
测定原理:APX 催化H2O2氧化AsA,通过测定AsA氧化速率,来计算得APX 活性。
自备仪器用品:低温离心机、紫外分光光度计/酶标仪、微量石英比色皿/96 孔板(UV 板)、移液枪、研钵、冰和蒸馏水。
试剂组成和配制:试剂一:液体×2 瓶,4℃保存。
试剂二:粉剂×1 瓶,4℃保存。
临用前加 3 mL 蒸馏水充分溶解。
试剂三:液体×1 支,4℃保存。
粗酶液提取:按照组织质量(g):试剂一体积(mL)为 1:5~10 的比例(建议称取约 0.1g 组织,加入1mL试剂一)进行冰浴匀浆。
13000g,4℃离心 20min,取上清置冰上待测。
测定:1.分光光度计/酶标仪预热30min以上,调节波长到290nm,用蒸馏水调零。
2.试剂一在 25℃中预热 30min。
3.依次在微量石英比色皿/96 孔板中加入 20μL 上清液、140μL 预热的试剂一 20μL 试剂二和20μL 试剂三,迅速混匀后在 290nm 测定 10s 和 130s 光吸收 A1 和 A2,△A=A1-A2。
APX 活性计算:a.使用微量石英比色皿测定的计算公式如下(1) 按样本蛋白浓度计算活性单位定义:每毫克蛋白每分钟氧化 1μmol AsA 为 1 个酶活单位。
APX(μmol/min/mg prot) = △A÷(ε×d)×V 反总×106÷(Cpr×V 样)÷T=1.79×△A÷ Cpr(2)按样本质量计算活性单位定义:每 g 组织每分钟氧化 1μmol AsA 为 1 个酶活单位。
抗坏血酸过氧化物酶(APX)活性检测试剂盒说明书紫外分光光度法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC0220规格:50T/48S 产品内容:试剂一:液体90mL×1瓶,4℃保存;试剂二:粉剂×1瓶,4℃保存。
临用前加入5mL 双蒸水充分溶解;试剂三:液体5mL×1瓶,4℃保存。
产品说明:APX 是植物清除活性氧的重要抗氧化酶之一,也是抗坏血酸代谢的关键酶之一。
APX 具有多种同功酶,分别定位于叶绿体、胞质、线粒体、过氧化物和乙醛酸体,以及过氧化体和类囊体膜上。
APX 催化H 2O 2氧化AsA,是植物AsA 的主要消耗者。
APX 的活性直接影响到AsA 的含量,在胁迫和解胁迫条件下,APX 与AsA 具有一定的负相关性。
APX 催化H 2O 2氧化AsA,通过测定AsA 的氧化速率,可计算得APX 活力。
试验中所需的仪器和试剂:低温离心机、紫外分光光度计、1mL 石英比色皿、移液枪、研钵、冰和蒸馏水。
操作步骤:一、粗酶液提取:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g 组织,加入1mL 试剂一)进行冰浴匀浆。
13000g,4℃离心20min,取上清置冰上待测。
二、测定操作表:1.分光光度计预热30min 以上,调节波长到290nm,用蒸馏水调零。
2.试剂一在25℃中预热30min 以上。
3.空白管:依次在1mL 石英比色皿中加入100μL 蒸馏水、700μL 预热的试剂一、100μL 试剂二和100μL试剂三,迅速混匀后在290nm测定10s和130s光吸收A1和A2,△A空白管=A1-A2。
4.测定管:依次在1mL石英比色皿中加入100μL上清液、700μL预热的试剂一、100μL试剂二和100μL试剂三,迅速混匀后在290nm测定10s和130s光吸收A3和A4,△A测定管=A3-A4。
三、APX活力计算:(1)按样本蛋白浓度计算活性单位定义:每毫克蛋白每分钟氧化1μmol AsA为1U。
单胺氧化酶测定试剂盒(谷氨酸脱氢酶法)适用范围:本产品用于体外定量测定人血清中单胺氧化酶的浓度。
1.1规格液体单剂型试剂(R):40mL×1;试剂(R):40mL×2;试剂(R):60mL×2;选配质控品:冻干粉型(2个水平):1mL×2。
1.2规格划分说明根据净含量、复溶体积划分规格。
1.3主要组成成分试剂盒由试剂(R)液体和选配质控品冻干粉组成。
1.3.1 试剂(R)液体:Tris缓冲液200mmol/L还原型辅酶I 0.2g/Lα-酮戊二酸≥10mmol/L苄胺≥30mmol/L谷氨酸脱氢酶≥2KU/L1.3.2 质控品冻干粉:人血清定值范围:水平1:2 U/L~15U/L;水平2:10 U/L~45U/L(每批定值)2.1 外观试剂盒中各组件的外观应满足:a)试剂(R)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b)质控品应为白色或淡黄色冻干粉,复溶后应为无色或浅黄色溶液,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度和试剂空白吸光度变化率在波长340nm(光径1cm)处,试剂空白吸光度(A)应≥0.8000;试剂空白吸光度变化率(△A/min)绝对值≤0.0100。
2.4准确度测定单胺氧化酶纯品,回收率在80%~120%范围内。
2.5 分析灵敏度对应于浓度为11.5U/L的单胺氧化酶所引起的吸光度变化率(△A/min)的绝对值应≥0.001。
2.6重复性重复测定高、低浓度样本,变异系数(CV)应≤15%。
2.7批间差测定同一样本,批间差(R)应≤15%。
2.8线性范围在[5,100] U/L范围内,线性相关系数(r)应≥0.990;在[5,25] U/L范围内,线性绝对偏差应不超过±3.75U/L;在(25,100] U/L范围内,线性相对偏差应不超过±15%。
可见分光光度法丙酮酸脱氢酶(PDH)活性检测试剂盒说明书注意:本产品试剂有所变动,请注意并严格按照该说明书操作。
货号:UPLC-MS-4318规格:50T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件试剂一液体60mL×1瓶4℃保存试剂二液体0.6mL×1支-20℃保存试剂三液体15mL×2瓶4℃保存试剂四液体25mL×1瓶4℃保存试剂五粉剂×2支-20℃保存试剂六粉剂×2支4℃保存试剂七液体8mL×1瓶4℃保存溶液的配制:1.试剂二:为易挥发试剂,用完后尽快密封,-20℃保存。
2.试剂六:每支试剂六加入1mL蒸馏水溶解备用。
3.工作液的配制:临用前把11.5mL试剂四、一支试剂五、0.9mL试剂六、3.5mL试剂七转移到一瓶试剂三中混合溶解待用;用不完的试剂-20℃分装保存,可以保存4周。
产品说明:PDH(EC4.1.1.1)广泛存在于动物、植物、微生物和培养细胞中,是丙酮酸脱氢酶复合体(PDHC)催化丙酮酸氧化脱羧的限速酶,催化丙酮酸脱梭生成羟乙基-TPP,把糖酵解和三羧酸循环连接起来。
PDH催化丙酮酸脱氢,同时还原2,6-二氯酚靛酚(2,6-DCPIP),从而导致605nm光吸收的减少。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、水浴锅、台式离心机、可调式移液器、1mL玻璃比色皿、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)组织:称取约0.1g组织,加入1mL试剂一和10μL试剂二,用冰浴匀浆器或研钵匀浆充分研磨,4℃11000g 离心10min,取上清,置冰上待测。
细胞或者细菌样本:先收集500万细胞到离心管内,离心后弃上清;之后加入1mL试剂一和10μL试剂二,冰浴超声波破碎细菌(功率20%或200W,超声3s,间隔7s,总时间5min);然后11000g,4℃,离心10 min,取上清置于冰上待测。
琥珀酸脱氢酶(SDH )活性检测试剂盒说明书可见分光光度法注意:本产品试剂有所变动,请注意并严格按照该说明书操作。
货号:BC0950 规格:50T/48S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称 规格 保存条件 试剂一 液体60 mL×1瓶 -20℃保存 试剂二 液体0.6 mL×1支 -20℃保存 试剂三 液体5 mL×1瓶 2-8℃保存 试剂四 液体4mL×1瓶 2-8℃保存 试剂五液体3mL×1瓶2-8℃保存溶液的配制:1、 试剂二:为易挥发试剂,用完后尽快密封,-20℃保存; 产品说明:SDH (EC 1.3.5.1)广泛存在于动物、植物、微生物和培养细胞中。
SDH 是线粒体的一种标志酶,位于线粒体内膜上的一种膜结合酶,是连接呼吸电子传递和氧化磷酸化的枢纽之一。
此外,为多种原核细胞产能的呼吸链提供电子。
SDH 催化琥珀酸脱氢生成延胡索酸,脱下的氢通过吩嗪二甲酯硫酸(PMS )传递还原2,6-二氯酚靛酚(DCPIP ),并且在600nm 处具有特征吸收峰,通过600nm 吸光度的变化,测定2,6-DCPIP 的还原速度,代表SDH 酶活性。
Succinic Acid + FAD Fumaric Acid + FADHFADH + PMS FAD + PMSH 2PMSH 2 + Dichlorophenolindophenol (600nm) PMS + Reduced Dichlorophenolindophenol 注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、水浴锅、台式离心机、可调式移液器、1 mL 玻璃比色皿、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1. 组织样本:称取约 0.1g 组织,加入1mL 试剂一和 10μL 试剂二,用冰浴匀浆器或研钵匀浆充分研磨,4℃11000g 离心10min ,取上清,置冰上待测。
NADPH-细胞色素C还原酶(NCR)活性检测试剂盒说明书注意:本产品试剂有所变动,请注意并严格按照该说明书操作。
可见分光光度法货号:UPLC-MS-4372规格:50T/48S产品内容:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件试剂一粉剂×2瓶4℃保存试剂二液体80mL×1瓶4℃保存试剂三粉剂×2瓶-20℃保存试剂四粉剂×2支4℃保存溶液的配制:1、试剂一:临用前取一瓶加入50mL蒸馏水,充分溶解;用不完的试剂4℃保存可保存4周;2、试剂三:临用前取一瓶加入1.3mL蒸馏水,充分溶解;用不完的试剂-20℃分装保存2周,避免反复冻融。
3、试剂四:临用前取一支加入275μL蒸馏水,充分溶解;用不完的试剂-20℃分装保存4周,避免反复冻融。
产品说明:细胞色素P450酶是一组主要存在于肝脏的同工酶,在外源物质代谢中具有重要作用,尤其是药物和毒物的代谢。
NCR作为P450酶系的重要一员,催化氧化型P450还原再生。
NCR催化NADPH还原氧化型细胞色素C,还原型细胞色素C在550nm处有特征吸收峰;通过测定550nm 吸光度的增加速率,来计算NCR活性。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、恒温培养箱/水浴锅、低温离心机、超速离心机、研钵/匀浆器、可调式移液器、1mL玻璃比色皿、冰和蒸馏水。
操作步骤:一、粗酶液提取(可适当调整待测样本量,具体比例可以参考文献)1、除去细胞核和线粒体等:称约0.5g组织,加入4℃预冷的1mL试剂一,冰上充分研磨,10000g,4℃离心30min,取上清液,转移到超速离心管中。
2、粗制微粒体:4℃,100000g,离心60min,弃上清液。
3、除血红蛋白等杂质:向步骤2的沉淀中加1mL试剂一,盖紧后充分震荡溶解,100000g离心30min,弃上清液。
货号:MS1008 规格:100管/96样单脱氢抗坏血酸还原酶(MDHAR)活性测定试剂盒说明书
微量法
注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:
MDHAR催化MDHA还原生成AsA,在抗坏血酸氧化还原代谢中具有重要作用。
测定原理:
MDHAR催化NADH还原MDHA生成AsA和NAD +,NADH在340nm有特征吸收峰,但是NAD+没有。
通过测定340nm光吸收下降速率,来计算出MDHAR活性。
实验中所需仪器及设备:
研钵、冰、台式离心机、紫外分光光度计/酶标仪、微量石英比色皿/96孔板、可调式移液枪和双蒸水
试剂组成和配置:
试剂一:液体×1 瓶,4℃保存。
试剂二:液体×1 瓶,室温保存。
试剂三:粉剂×1 瓶(棕色),4℃保存。
临用前加入3mL蒸馏水充分溶解。
试剂四:粉剂×1 瓶,4℃保存。
临用前加入2.5mL蒸馏水充分溶解。
试剂五:液体×1 瓶,4℃保存。
临用前加3mL试剂二充分溶解。
粗酶液提取:
1. 组织:按照组织质量(g):试剂一体积(mL)为 1:5~10 的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
8000g,4℃离心10min,取上清置冰上待测。
2. 细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500 万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔 7秒,总时间3min);8000g ,4℃离心20min,取上清液置冰上混匀待测。
3. 血清等液体:直接测定。
MDHAR 测定操作:
1.分光光度计/酶标仪预热30min,调节波长到340nm,蒸馏水调零。
2.试剂二在 25℃水浴锅中预热30min。
3.依次在微量石英比色皿/96孔板中加入20μL试剂三、20μL试剂四、20μL试剂五和120μL 试剂二,最后加入20μL上清液,迅速混匀后于340nm比色,记录30s和150s的吸光值30s和150s 的吸光值A1和A2,△A=A1-A2。
MDHAR 活性计算公式:
a.使用微量石英比色皿测定的计算公式如下
(1). 按蛋白浓度计算
MDHAR 活性单位定义:25℃中每毫克蛋白每分钟氧化1nmol NADH为1个酶活单位。
MDHAR (nmol/min /mg prot) = △A÷ε÷d×V 反总×109]÷(Cpr×V 样)÷T
= 804×△A ÷Cpr
第1页,共2页
(2). 按样本质量计算
MDHAR 活性单位定义:25℃中每克样本每分钟氧化1nmol NADH为1U。
MDHAR (nmol/min/g) = △A÷ε÷d×V 反总×109]÷(W×V样÷V样总)÷T
= 804×△A ÷W
(3). 按细胞数量计算
MDHAR 活性单位定义:25℃中每 104个细胞每分钟氧化1nmol NADH为1个酶活单位。
MDHAR (nmol/min/104cell) = △A÷ε÷d×V 反总×109÷(细胞数量×V样÷V样总)÷T
= 804×△A ÷细胞数量
(4). 按液体体积计算
MDHAR 活性单位定义:25℃中每毫升液体每分钟氧化 1nmol NADH 为 1 个酶活单位。
MDHAR (nmol/min /mL) = △A÷ε÷d×V 反总×10 9 ÷V 样)÷T
= 804×△A
ε:NADH 摩尔消光系数,6220 L/mol/cm;d:比色皿光径,1cm;V 反总:反应体系总体积,
0.2mL=2×10 -4 L;V 样:加入反应体系中上清液体积,20μL=0.02mL;V 样总:提取液体积,
1 mL;Cpr:上清液蛋白浓度,mg/mL,蛋白质浓度需要另外测定,建议使用本公司蛋白质
含量 BCA 试剂盒;W :样品质量;T:反应时间,2min。
b.使用 96 孔板测定的计算公式如下:
(1). 按蛋白浓度计算
MDHAR 活性单位定义:25℃中每毫克蛋白每分钟氧化 1nmol NADH 为 1 个酶活单位。
MDHAR (nmol/min /mg prot) = △A÷ε÷d×V 反总×10 9 ]÷(Cpr×V 样)÷T
= 1608×△A ÷Cpr
(2). 按样本质量计算
MDHAR 活性单位定义:25℃中每克样本每分钟氧化 1nmol NADH 为 1U。
MDHAR (nmol/min /g) = △A÷ε÷d×V 反总×10 9 ]÷(W×V 样÷V 样总)÷T
= 1608×△A ÷W
(3)按细胞数量计算
MDHAR 活性单位定义:25℃中每 10 4 个细胞每分钟氧化 1nmol NADH 为 1 个酶活单位。
MDHAR (nmol/min/10 4 cell) = △A÷ε÷d×V 反总×10 9 ÷(细胞数量×V 样÷V 样总)÷T
= 1608×△A ÷细胞数量
(4)按液体体积计算
MDHAR 活性单位定义:25℃中每毫升液体每分钟氧化 1nmol NADH 为 1 个酶活单位。
MDHAR (nmol/min /mL) = △A÷ε÷d×V 反总×10 9 ÷V 样)÷T
=1608×△A
ε:NADH 摩尔消光系数,6220 L/mol/cm;d:96 孔板光径,0.5cm;V 反总:反应体系总体积,0.2mL=2×10 -4 L;V 样:加入反应体系中上清液体积,20μL=0.02mL;V 样总:提取液体积,1 mL;Cpr:上清液蛋白浓度,mg/mL,蛋白质浓度需要另外测定,建议使用本公司
蛋白质含量 BCA 试剂盒;W :样品质量;T:反应时间,2min。
注意事项:
临用前配制的试剂未使用完的 4℃保存,3 天内使用完。
第2页,共2页。