结构化学 双原子分子结构
- 格式:ppt
- 大小:487.00 KB
- 文档页数:37

共价键和双原子分子的结构化学共价键是指两个原子通过共用电子对而形成的化学键。
在化学中,一般认为共价键是原子之间电子的两者共有。
共价键的形成是由原子之间的价电子云之间的相互作用所引起的。
共价键是化学键的一种,它是通过原子之间的共用电子对而形成的。
共价键的共用电子对可以是一个单电子对,也可以是一个双电子对。
双原子分子是由两个原子共享一对电子而形成的分子。
双原子分子可以是纯元素的分子,也可以是由不同元素组成的分子。
在双原子分子中,两个原子之间的键长和键能取决于两个原子的电负性差异。
共价键的形成涉及到电子云的重叠。
当两个原子接近时,它们的电子云会重叠在一起形成一个重叠区域。
在共价键形成的过程中,每个原子上的未被重叠区域占据的电子将成为一个共价键。
共价键的形成使得原子能够通过共享电子而形成一个稳定的分子。
共价键的强度取决于两个原子之间的电负性差异。
电负性是一个衡量原子对于共享电子的吸引力的量。
当两个原子的电负性相似时,它们之间的共价键会比较强。
当两个原子的电负性差异较大时,较电负的原子会对电子更具吸引力,这将导致一个极性共价键的形成。
双原子分子的结构化学研究主要涉及到双原子分子的键长、键能和键角等属性。
键长是指两个原子之间的距离,它可以通过实验手段进行测量。
键能是指形成共价键的能量,它可以通过计算或实验测量来确定。
键角是指两个共价键之间的夹角,它在双原子分子的化学性质中起到重要作用。
双原子分子的结构化学研究对了解分子的性质和反应机制非常重要。
通过研究双原子分子的结构化学,可以揭示分子中键的强度和键能对于分子的稳定性和反应活性的影响。
双原子分子的结构化学也为设计和合成新的化合物提供了理论基础。
总结起来,共价键是由原子之间共用电子对形成的化学键。
双原子分子的结构化学研究主要涉及到双原子分子的键长、键能和键角等属性。
共价键和双原子分子的结构化学研究对于揭示化学反应和设计新化合物具有重要意义。


结构化学双原子分子结构双原子分子结构是指由两个原子构成的分子。
这种分子结构是化学中最简单的一种,但也是最基础的一种。
在双原子分子结构中,两个原子之间的化学键通常是共价键。
这种共享电子对形成了原子之间的化学键,使得分子能够保持稳定状态。
双原子分子结构的研究对于了解化学键和分子结构的性质具有重要意义。
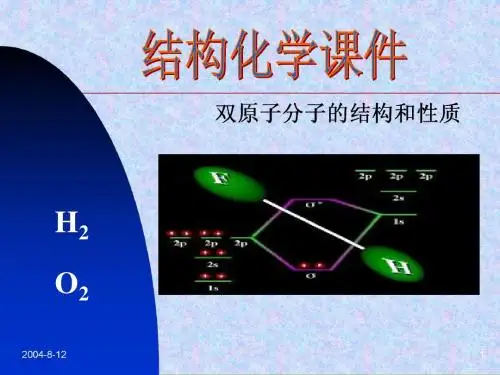
最常见的双原子分子结构是氢分子(H2),由两个氢原子共享一个电子对形成共价键。
氢分子是最简单的分子,也是宇宙中最常见的分子之一、它的分子式为H2,由两个氢原子通过共价键连接在一起。
氢分子的形成是通过两个氢原子中的一个原子的一个电子迁移到另一个原子的空轨道上,形成一个共享的电子对。
这个共享的电子对使得氢分子能够保持稳定状态。
另一个重要的双原子分子结构是氧分子(O2),由两个氧原子共享两个电子对形成共价键。
氧分子是地球大气中的主要成分之一,也是生命的关键分子之一、它的分子式为O2,由两个氧原子通过共价键连接在一起。
氧分子的形成是通过两个氧原子中的每个原子的两个电子迁移到另一个原子的空轨道上,形成两个共享的电子对。
这两个共享的电子对使得氧分子能够保持稳定状态。
除了氢分子和氧分子,还有许多其他双原子分子结构,如氮分子(N2),氟分子(F2),氯分子(Cl2)等。
这些分子的形成原理与氢分子和氧分子类似,都是通过共享电子对形成稳定的化学键。
在双原子分子结构中,化学键的强度和键长是两个重要的性质。
化学键的强度取决于原子之间共享的电子对的数量和电子云的交互作用。
一般来说,共享电子对的数量越多,化学键越强。
键长是指两个原子之间的距离,它的长度取决于原子半径和化学键的强度。
一般来说,化学键越强,键长越短。
双原子分子结构在化学中有着广泛的应用。
它们在化学反应中起着关键的作用,能够通过键的形成和断裂改变分子的性质。
通过研究双原子分子结构,可以了解化学键的性质和分子的结构,从而为其他复杂分子的研究提供基础。
此外,双原子分子结构在材料科学、化学工程和生物化学等领域也有着重要的应用。

第三章 双原子分子结构3.1 +2H 的结构及共价键的本质基本内容—、定核近似和+2H 的薛定谔方程A BRe r e r e m H b a 02020*******ˆπεπεπε+--∇-= 我们常采用原子单位:单位长度:Pm e m h a e 9177.524422200==ππε(玻尔半径)单位质量:me=9.1095×10-31Kg (电子质量) 单位电荷:e=1.60219×10-19C (电子电量) 单位能量:024a e πε=27.2116eV单位角动量: =1.0546×10-34 J.S 单位介电常数:04πε=1采用原子单位、+2H 的哈密顿算符为:Rr r Hba 11121ˆ2+--∇-=其薛定谔方程为:ψψE Rr r b a =+--∇-)11121(2,式中E 、ψ分别为+2H 的波函数和能量。
二、变分原理及性线变分法 1. 变分原理对于任意一个品优波函数ψ,用体系的Hˆ算符求得的能量平均值将大于或接近等于体系基态的能量E 0即:*ˆ*E d d H E ≥>=<⎰⎰τψψτψψ 据此原理,利用求极值方法调节参数,找出能量最低时对应的波函数,即为和体系基态相近似的波函数。
2. 线性变分法在量化计算中,广泛采用的是线性变分函数,它是满足体系边界条件的 个线性无关的函数m φφφ,,,21 的线性组合:m m C C C φφφψ+++= 2211采用线性变分函数的变分法叫线性变分法。
根据变分原理求得使E 最低的一组组合系数Ci⎰⎰++++++++++++=τφφφφφφτφφφφφφd C C C C C C d C C C H C C C E m m mm m m m m ))(()(ˆ)(2211***2*2*1*12211***2*2*1*1mC EC E C E ∂∂==∂∂=∂∂ 21=0 由此得一组求解Ci 的m 个联立方程称为久期方程,运用线性代数法求得m 套非零解,由其中与最低E 相对应的一套解C 1,C 2,……,C m 便可组成基态分子轨道波函数,所对应的E 便是基态能量近似值。



双原子分子结构、填空题(在题中空格处填上正确答案)3101、描述分子中________________ 空间运动状态的波函数称为分子轨道。
3102、在极性分子AB中的一个分子轨道上运动的电子,在A原子的A原子轨道上出现的概率为80%, B原子的B原子轨道上出现的概率为20%,则该分子轨道波函数。
3103、设A和B分别是两个不同原子A和B的原子轨道,其对应的原子轨道能量为E A和E B,如果两者满足___________ ,_______________ , _______ 原则可线性组合成分子轨道=C A A + C B B。
对于成键轨道,如果E A_________ E B,贝U C A _____C B。
(注:后二个空只需填"=",">"或”等比较符号)3104、试以Z轴为键轴,说明下列各对原子轨道间能否有效地组成分子轨道,若可能,则填写是什么类型的分子轨道。
3105、判断下列轨道间沿z轴方向能否成键。
如能成键,则在相应位置上填上分子轨道的名称。
3106、AB为异核双原子分子,若A dyz与B P可形成型分子轨道,那么分子的键轴yzy编辑版word为____ 轴。
3107、若双原子分子AB的键轴是z轴,则A的d yz与B的P y可形成_________________ 型分子轨道。
3108、以z轴为键轴,按对称性匹配原则,下列原子轨道对间能否组成分子轨道?若能,写出是什么类型分子轨道,若不能,写出”不能",空白者按未答处理。
________________ ,磁性 _________________ 。
3110、在z方向上能与d xy轨道成键的角量子数l w 2的原子轨道是 _______________ 形成的分子轨道是___________ 轨道。
3111、在x方向上能与d xy轨道成键的角量子数K 2的原子轨道是__________________ 3112、用分子轨道表示方法写出下列分子基态时价层的电子组态:N2:_______________________________ ,02: ____________________________ 。

