高中化学选修3人教版:第三章晶体结构与性质-归纳与整理
- 格式:ppt
- 大小:2.04 MB
- 文档页数:97
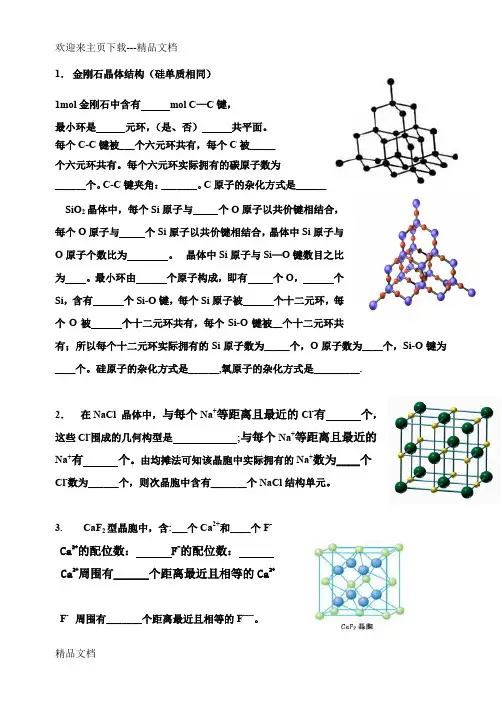
精品文档 1. 金刚石晶体结构(硅单质相同)1mol 金刚石中含有 mol C —C 键,最小环是 元环,(是、否) 共平面。
每个C-C 键被___个六元环共有,每个C 被_____个六元环共有。
每个六元环实际拥有的碳原子数为______个。
C-C 键夹角:_______。
C 原子的杂化方式是______ SiO 2晶体中,每个Si 原子与 个O 原子以共价键相结合,每个O 原子与 个Si 原子以共价键相结合,晶体中Si 原子与O 原子个数比为 。
晶体中Si 原子与Si —O 键数目之比为 。
最小环由 个原子构成,即有 个O , 个Si ,含有 个Si-O 键,每个Si 原子被 个十二元环,每个O 被 个十二元环共有,每个Si-O 键被__个十二元环共有;所以每个十二元环实际拥有的Si 原子数为_____个,O 原子数为____个,Si-O 键为____个。
硅原子的杂化方式是______,氧原子的杂化方式是_________.2. 在NaCl 晶体中,与每个Na +等距离且最近的Cl-有 个,这些Cl -围成的几何构型是 ;与每个Na +等距离且最近的Na +有 个。
由均摊法可知该晶胞中实际拥有的Na +数为____个Cl -数为______个,则次晶胞中含有_______个NaCl 结构单元。
3. CaF 2型晶胞中,含:___个Ca 2+和____个F -Ca 2+的配位数: F -的配位数:Ca 2+周围有______个距离最近且相等的Ca 2+F - 周围有_______个距离最近且相等的F——。
精品文档4.如图为干冰晶胞(面心立方堆积),CO 2分子在晶胞中的位置为 ;每个晶胞含二氧化碳分子的个数为 ;与每个二氧化碳分子等距离且最近的二氧化碳分子有个。
5.如图为石墨晶体结构示意图,每层内C 原子以 键与周围的 个C 原子结合,层间作用力为 ; 层内最小环有_____个C 原子组成;每个C 原子被 个最小环所共用;每个最小环含有 个C 原子, 个C —C键;所以C 原子数和C-C 键数之比是_________。

【人教版】高中化学选修3知识点总结:第三章晶体构造与特性
1. 晶体的基本概念
- 晶体是由原子、离子或分子以一定的方式排列形成的固体物质。
- 晶体的结构由晶格和基元组成。
晶格是由离子或原子排列所形成的三维重复结构,基元是晶格中最小的具有完整晶体结构的部分。
2. 晶体的分类
- 按照构成晶体的粒子种类可分为离子晶体、原子晶体和分子晶体。
- 按照晶体的组成方式可分为金属晶体、离子晶体、共价晶体和导电晶体等。
3. 晶体的结构与性质
- 晶体的结构决定了其性质。
晶体的结构可以通过X射线衍射实验来确定。
- 晶体的性质包括硬度、熔点、热胀冷缩性、电导率、光学性质等。
4. 离子晶体的结构与性质
- 离子晶体的结构是由正、负离子按一定比例排列形成的。
- 离子晶体具有高熔点、脆性、电解质导电性等特点。
5. 共价晶体的结构与性质
- 共价晶体是由原子通过共价键相互连接而成的。
- 共价晶体具有较高的熔点、硬度和脆性,不导电。
6. 金属晶体的结构与性质
- 金属晶体是由金属原子通过金属键相互连接而成的。
- 金属晶体具有良好的导电性、导热性和延展性。
7. 晶体缺陷
- 晶体缺陷是指晶体中原子或离子的位置发生偏离或缺失的现象。
- 晶体缺陷包括点缺陷、面缺陷和体缺陷。
以上是第三章晶体构造与特性的知识点总结,希望对你的学习有所帮助。

第三章晶体结构与性质课标要求1•了解化学键和分子间作用力的区别。
2•理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
3•了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
4•理解金属键的含义,能用金属键理论解释金属的一些物理性质。
5•了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
要点精讲一一.晶体常识1•晶体与非晶体比较晶体韭晶悴结梅徴粒周期性有序掾列红构裟粒无序拄列1性质峙性有目范性、固定熔点、对称性、各冋异性没有自葩性、固定焙点“揃佗■&向异性2.获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)③溶质从溶液中析出。
3.晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”4.晶胞中微粒数的计算方法一一均摊法如某个粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学中常见的晶胞为立方晶胞「厂-4同为慎个霜肿.所比右■[碎Fw I •俊歸咆同为2个忌胞所几好• £粒TI 询上一 4.U F滾品咆望于内部-*1®个锂子都翼于議骷盹立方晶胞中微粒数的计算方法如下:注意:在使用均摊法”计算晶胞中粒子个数时要注意晶胞的形状二•四种晶体的比较2 •晶体熔、沸点高低的比较方法(1)不同类型晶体的熔、沸点高低一般规律:原子晶体〉离子晶体〉分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高•如熔点:金刚石〉碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
(4)分子晶体①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。



【人教版】高中化学选修3知识点总结:第三章晶体排列与特性
本文档总结了高中化学选修3课程中第三章晶体排列与特性的主要知识点。
一、晶体的定义和特点
- 晶体是具有规则的、有序的三维排列的固体结构。
- 晶体呈现出明显的平面、直线和点的等级性。
- 晶体有着明确的晶体结构和晶体缺陷。
二、晶体排列
- 晶体的排列方式主要有原子堆积和离子堆积两种。
- 原子堆积有3种典型的结构类型:简单立方堆积、面心立方堆积和密堆积。
- 离子堆积有3种典型的排列方式:简单立方堆积、体心立方堆积和面心立方堆积。
三、晶体的类型
- 晶体分为金属晶体、离子晶体、共价晶体和分子晶体四种类型。
- 金属晶体由金属原子组成,具有良好的导电性和热导性。
- 离子晶体由阳离子和阴离子组成,具有高熔点和良好的溶解性。
- 共价晶体由共价键连接的原子组成,具有高硬度和高熔点。
- 分子晶体由分子间的弱力相互作用连接的组成,具有低熔点和易溶性。
四、晶体的缺陷
- 晶体的缺陷分为点缺陷、线缺陷和面缺陷。
- 点缺陷包括空位、间隙原子和杂质原子等。
- 线缺陷包括位错和螺旋位错。
- 面缺陷包括阴极空位和阳极不完整等。
以上是高中化学选修3课程中第三章晶体排列与特性的知识点总结。
以上信息仅供参考,如有需要请自行查阅教材或参考其他可靠资料确认。

常见晶胞中微粒间最近距离一、教学目标【知识与技能】1掌握各类代表晶体的晶胞结构2能计算常见晶胞中微粒间最近距离【过程与方法】1探究晶体结构中培养学生观察能力和空间想象能力。
2化学知识与数学知识相结合分析晶胞结构,提高学生分析问题、解决问题能力3由金刚石晶胞结构演变出其它晶胞结构,让学生掌握几种典型晶胞的区别与联系,培养学生归纳推理能力【情感态度与价值观】1学生通过自己动手制作晶胞模型,及课上播放晶体图片,激发学生学习化学的兴趣。
2学生通过观察模型,解决问题,培养学生勤于思考,积极实践的科学态度。
二、学情分析在知识方面,学生已学习了分子晶体、原子晶体、金属晶体、离子晶体的相关内容,已经了解各类代表晶体的结构。
在能力方面,学生空间想象能力不够,在教师的引导下,由金刚石的晶胞结构演变出CaF2晶胞,Cu晶胞,CO2晶胞等,通过学生亲手制作模型和小组合作学习的方法,促使学生动眼看,动手做,动口说,动脑想,变被动学习为主动探索。
三、重点难点重点:晶胞的结构难点:晶胞中微粒间距离的比较。
四、教学过程【导入】播放一组图片多媒体展示晶体世界的美丽,用以调动学生的学习热情【提问】它们是我们化学上学习的哪类物质?回顾所学内容,根据构成微粒和作用力的不同,晶体分哪几类?【板书】求晶胞中的最近距离活动1、展示一些晶胞图片,让学生结合书上的图,判断是什么晶体。
学生看书后,集体回答。
活动2、学生动手用所给的乒乓球做一个体心细胞。
【思考】微粒在晶胞什么位置?微粒间距离一样吗?哪两个最近?结合教学知识,对比判断。
由一个小组代表展示成果,并回答分析结果,然后动画展示。
【提问】所学的晶胞中,体心晶胞有哪些?归纳:播放投影【板书】体心:最近距离等于体对角线的一半根据题图推测,CuCl晶体中两距离最近的Cu+间距离为a,则每个Cu+与Cu+周围距离相等且次近的距离为________,每个Cu+周围距离相等且第三近的距离为________,两距离最近的Cu+间距离为a的数目为________,Cu+周围紧邻且等距的Cl-数目为________。


【人教版】高中化学选修3知识点总结:
第三章晶体构造与属性
晶体构造与属性是高中化学选修3课程中的重要内容。
本章主
要讲解了晶体的特点、晶体的拓扑结构、晶体的点阵和晶体的性质
等知识点。
1. 晶体的特点
- 晶体是由一定规律排列的原子、离子或分子组成的固体物质。
- 晶体具有规则的几何外形,有明确的晶面和晶点。
- 晶体中离子、原子或分子按照一定规律排列形成周期性结构,具有长程有序性。
2. 晶体的拓扑结构
- 晶体的拓扑结构是指晶体中原子、离子或分子之间的连接关
系和排列方式。
- 晶体可分为离子晶体、共价晶体和金属晶体等不同类型。
3. 晶体的点阵
- 晶体的点阵是晶体中最小的周期结构单元,在三维空间中重复排列形成整个晶体结构。
- 常见的晶体点阵有立方晶系、正交晶系、单斜晶系、正六角晶系等。
4. 晶体的性质
- 晶体的物理性质:晶体具有明确的熔点、硬度和透明度等特性。
- 晶体的光学性质:晶体对光具有不同的折射、吸收、散射和偏振等特性。
- 晶体的磁性性质:晶体中的离子或原子在外磁场作用下表现出不同的磁性行为。
以上是关于【人教版】高中化学选修3知识点总结中第三章晶体构造与属性的内容概述。
详细内容请参考教材或其他可靠资料。

《晶体结构与性质》总结一、分子晶体:1.间以(,)相结合的晶体叫分子晶体(1)构成分子晶体的粒子是。
(2)粒子间的相互作用是。
(3)分子间作用力(范德华力<氢键)远化学键的作用;(4)分子晶体熔化破坏的是。
2.典型的分子晶体:(1)非金属氢化物:例(2)酸:例(3)部分非金属单质::例(4)部分非金属氧化物: 例(5)大多数有机物:例3.分子晶体结构:(1)只有范德华力,无分子间氢键的——分子密集堆积,如:C60、干冰、O2每个分子周围有个紧邻的分子,面心立方构型(2)有分子间氢键的——不具有分子密集堆积特征,如:HF 、冰、NH3冰中1个水分子周围有个水分子,1mol冰周围有mol氢键。
4.分子晶体熔沸点判断:的物质,越大,分子间作用力越大;分子量相等或相近,性分子的范德华力大,物质熔化和汽化时需要的能量就越多,物质的熔、沸点就越。
含有分子间氢键的,熔沸点较。
在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越。
二、原子晶体:1.所有的相邻间都以相结合而形成空间立体网状结构的晶体。
(1)构成原子晶体的粒子是,(2)原子间以较强的相结合。
(3)整块晶体是一个三维的共价键网状结构,(4)原子晶体熔化破坏的是。
2.常见的原子晶体(1)某些非金属单质:硼(B)(2)某些非金属化合物:碳化硅(SiC)氮化硼(BN)(3)某些氧化物:Al2O3晶体3.原子晶体结构:金刚石晶体中:每个碳原子以与周围个碳原子结合,成为正四面体结构,碳以杂化轨道形成键。
向空间发展,彼此联结的立体网状结构,其中形成的最小环中含个碳原子。
每个碳原子被12个环共用。
1mol金刚石中含有的C-C共价键数mol。
在SiO2晶体中:①每个Si原子以个共价键结合个O原子;同时,每个O原子结合个Si原子。
SiO2晶体是由Si原子和O原子按的比例所组成的立体网状的晶体。
②最小的环是由个Si原子和个O原子组成的元环。
③1mol SiO2中含mol Si—O键。
【人教版】高中化学选修3知识点总结:第三章晶体形态与特征
本文档总结了高中化学选修3教材中第三章晶体形态与特征的知识点。
1. 晶体的概念和结构特点
- 晶体是由具有一定空间有序性的原子、离子或分子组成的凝聚态物质。
- 晶体的结构特点包括周期性、长程有序性和层状结构。
2. 晶体的晶体系和晶体面
- 晶体系根据对称性可分为三类:立方晶系、四方晶系和六角晶系。
- 晶体面是晶体表面的平坦部分。
3. 晶体的晶胞和晶格
- 晶胞是最小重复单元,包含了晶体的全部结构信息。
- 晶格是晶胞在空间中无限重复所形成的排列。
4. 晶体的晶体缺陷
- 晶体缺陷是指晶体中存在的结构异常或杂质。
- 晶体缺陷包括点缺陷、线缺陷和面缺陷。
5. 晶体的晶体学性质
- 晶体的晶体学性质包括透明性、折射性和散射性等。
- 不同晶体的晶体学性质有所差异。
以上是第三章晶体形态与特征的知识点总结,希望对您有帮助。
参考资料:
- 《高中化学选修3》人教版。