2020版高中化学 专题3微型专题重点突破(五)学案 苏教版必修2
- 格式:doc
- 大小:995.00 KB
- 文档页数:13


专题3 有机化合物的获得与应用微型专题重点突破(六)一、乙醇结构与性质的应用例1如图是某有机物分子的球棍模型。
关于该物质的说法正确的是( )A.可以与醋酸发生中和反应B.能与氢氧化钠发生取代反应C.不能与金属钾反应D.能发生催化氧化反应答案 D解析分析该物质的球棍模型,推知有机物是CH3CH2OH。
A项,CH3CH2OH与CH3COOH能发生酯化反应,但CH3CH2OH 不是碱,不能与CH3COOH发生中和反应,错误;B项,CH3CH2OH不能与NaOH反应,错误;C项,CH3CH2OH能与活泼金属钾反应,生成CH3CH2OK和H2,错误;D项,CH3CH2OH能发生催化氧化反应生成CH3CHO,正确。
(1)熟悉乙醇的结构与性质,根据—OH分析其溶解性,与金属钠的反应、酯化反应等。
(2)若题目给出含有醇羟基的有机物,则可根据CH3CH2OH的性质进行推演。
变式1某有机物的结构简式为。
下列关于该有机物的叙述中,不正确的是( ) A.能与金属钠发生反应并放出氢气B.能在催化剂作用下与H2发生加成反应C.不能使酸性KMnO4溶液褪色D.在铜作催化剂条件下能发生催化氧化反应生成醛答案 C解析该有机物分子中含有、—OH两种官能团,其中—OH能和Na反应放出H2,能在铜作催化剂条件下发生催化氧化反应生成醛;能使酸性KMnO4溶液褪色,能在催化剂作用下与H2发生加成反应。
二、乙酸的结构与性质的应用例2已知丙酸跟乙酸具有相似的化学性质,丙醇跟乙醇具有相似的化学性质。
丙醇和丙酸的结构简式如下:CH3CH2CH2OH(丙醇)、CH3CH2COOH(丙酸)试回答下列问题:(1)分别写出丙醇、丙酸与Na反应的化学方程式:①丙醇+钠:_________________________________________________________,②丙酸+钠:__________________________________________________________。

亲爱的同学:这份试卷将再次记录你的自信、沉着、智慧和收获,我们一直投给你信任的目光……学习资料专题专题1 微观结构与物质的多样性微型专题重点突破(一)一、核外电子排布规律的应用例1现有部分元素的原子结构特点如表:(1)画出W原子的结构示意图:_______________________________________________。
(2)元素X与元素Z相比,非金属性较强的是_____________________________________ (填元素名称),写出一个能表示X、Z非金属性强弱关系的化学方程式:_____________________________________________________________________________________。
(3)元素X和元素Y以原子个数比1∶1化合形成化合物Q,元素W和元素Y化合形成化合物M 且Q和M的电子总数相等。
以液态M为还原剂,Q为氧化剂,发生反应最终生成无毒的、在自然界中稳定存在的物质,写出该反应的化学方程式:________________________________________________________________________________________________。
考点原子结构与核外电子排布题点核外电子排布与应用答案(1)(2)氧2H2S+O2===2H2O+2S↓(其他合理答案亦可)(3)N2H4+2H2O2===N2↑+4H2O解析X元素原子的L层电子数是K层电子数的3倍,根据核外电子排布规律,可知L层为6个电子,所以X为氧元素;Y元素原子的核外电子层数等于原子序数,Y只能是氢元素;Z元素原子的L层电子数是K层和M层电子数之和,L层有8个电子,则其M层电子数为6,所以Z是硫元素;W元素原子的最外层电子数是次外层电子数的2.5倍,其次外层只能是K层,有2个电子,所以W为氮元素。

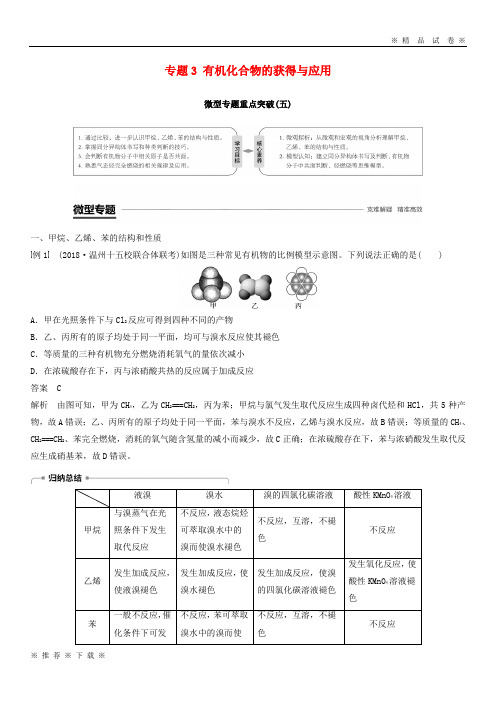
专题3 有机化合物的获得与应用微型专题重点突破(五)一、甲烷、乙烯、苯的结构和性质例1 (2018·温州十五校联合体联考)如图是三种常见有机物的比例模型示意图。
下列说法正确的是()A .甲在光照条件下与Cl 2反应可得到四种不同的产物B .乙、丙所有的原子均处于同一平面,均可与溴水反应使其褪色C .等质量的三种有机物充分燃烧消耗氧气的量依次减小D .在浓硫酸存在下,丙与浓硝酸共热的反应属于加成反应 答案 C解析 由图可知,甲为CH 4,乙为CH 2===CH 2,丙为苯;甲烷与氯气发生取代反应生成四种卤代烃和HCl ,共5种产物,故A 错误;乙、丙所有的原子均处于同一平面,苯与溴水不反应,乙烯与溴水反应,故B 错误;等质量的CH 4、CH 2===CH 2、苯完全燃烧,消耗的氧气随含氢量的减小而减少,故C 正确;在浓硫酸存在下,苯与浓硝酸发生取代反应生成硝基苯,故D 错误。
变式1(2018·商丘九校联考)下列关于甲烷、乙烯和苯的说法错误的是( )A.天然气、可燃冰作为燃料的主要成分均是甲烷B.甲烷、乙烯与苯都属于烃类有机化合物C.甲烷和甲苯都不能使酸性高锰酸钾溶液褪色D.乙烯能与溴水中的溴发生加成反应答案 C解析天然气、沼气、可燃冰中含有大量的甲烷,故A正确;甲烷、乙烯与苯都只含C、H两种元素,属于烃,故B正确;甲苯中与苯环相连的C上有H能被酸性高锰酸钾溶液氧化,使其褪色,而甲烷是饱和烷烃不能被酸性高锰酸钾溶液氧化,故C错误;乙烯分子中含碳碳双键,和溴单质发生加成反应生成1,2二溴乙烷,故D正确。
二、烃的一氯代物同分异构体数目的判断例2四联苯的一氯代物有( )A.3种 B.4种 C.5种 D.6种答案 C解析推断有机物一氯代物的种数需要找中心对称轴,四联苯是具有两条对称轴的物质,即,在其中的一部分上有几种不同的氢原子(包括对称轴上的氢原子),就有几种一氯代物,四联苯有5种不同的氢原子,故有5种一氯代物。

高中化学苏教版学案篇一:苏教版高中化学必修2全套教案 (精选)化学必修2教案蔡本松专题一:微观结构与物质的多样性第一单元:原子核外电子排布与元素周期律第一课时一、教学目标课标内容:了解原子核外电子的排布会考考纲:1.了解核外电子的排布(b)2.能画出1~18号元素的原子结构示意图(b)教学目标:(一)知识与技能原子核外电子排布规律(二)过程与方法掌握原子核外电子排布规律,通过1-20号元素的原子和离子结构示意图的学习,扩展到主族元素的电子排布规律的认识,初步体会归纳与演绎的学习方法。
(三)情感与价值观通过原子核外电子排布规律,了解物质运动的复杂性和特殊性二、教学重、难点和突破方法教学重点:了解原子的结构,能画出1~18号元素的原子结构示意图教学难点:核外电子排布规律三、教学过程:1.创设情境,引入新课下表是构成原子的各微粒的一些参数,请根据表中所提供的信息回答问题:问题解决:1.原子是由、和三部分构成的。
2.在原子中,质量集中在上,其大小是由和之和决定的。
3.在原子中:==4.原子不显电性的原因:交流与讨论:原子核带正电荷,核外电子带负电荷,正负电荷相互吸引,那为什么电子不会落入原子核内呢?2.进行新课讲解:原子核外电子并不是静止的,而是绕原子核做高速圆周运动,它们之间的引力提供了圆周运动的向心力,有摆脱原子核对电子的吸引的倾向,所以,在不受外界影响的条件下,电子既不能被原子吸入核内,也不能离开核自由运动。
过渡:那么,多电子原子的核外电子是如何绕原子核作高速运动的呢?一、原子核外电子的排布 1.核外电子运动特征科学探究:根据所给的一些数据,请你总结电子运动的特征①核外电子的质量:9.10×10-31kg②炮弹的速度2km/s,人造卫星7.8 km/s,宇宙飞船11km/s;氢核外电子2.2×108m/s ③乒乓球半径:4×10-2m;原子半径:n×10-10m结论:电子运动的特征是:电子质量,运动速度,运动空间范围。
专题2 从海水中获得的化学物质本专题重难点突破一解析氯水性质的多重性1.氯水中的反应Cl2+H2O H++Cl-+HClO2HClO===2H++2Cl-+O2↑(光照加快分解)所以,保存氯水要密闭、放在冷暗处、棕色瓶中。
但氯水不宜长期存放,最好是现用现配,因为不见光也缓慢分解。
2.氯水的成分新制氯水:分子有Cl2、HClO、H2O三种,溶质分子中以Cl2为主;离子有H+、Cl-、ClO-、OH-(少量)四种。
长期放置的氯水,由于HClO分解,Cl2全部反应,氯水最终变为稀盐酸。
3.氯水的性质(1)表现Cl2的性质氯水中含有Cl2,所以氯水呈黄绿色,由于Cl2具有强氧化性,当向氯水中加入强还原性物质,便可与Cl2发生氧化还原反应。
如:氯水能使润湿的淀粉KI试纸变蓝(用于对Cl2收集的验满),能与Na2SO3、FeBr2等发生氧化还原反应:Na2SO3+Cl2+H2O===Na2SO4+2HCl,2FeBr2+3Cl2(足量)===2FeCl3+2Br2。
(2)表现HClO的强氧化性氯水中含有HClO,HClO具有强氧化性,能杀死水里的病菌,故常用氯气给自来水杀菌、消毒。
另外HClO还可将色素氧化而使其颜色褪去,故氯水常用于漂白。
(3)表现H+的性质氯水中含有H+,所以氯水具有H+的性质,如氯水能与镁粉反应放出氢气,能与CaCO3反应放出CO2。
(4)具有Cl-的性质氯水中加入硝酸银溶液反应生成白色沉淀。
反应的离子方程式:Ag++Cl-===AgCl↓。
4.液氯与新制氯水、久置氯水的区别【典例1】下列有关化学反应过程或实验现象的叙述中,正确的是( )A .氯气的水溶液可以导电,说明氯气是电解质B .漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的C .氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气D .氯水中加入有色布条,布条褪色,说明溶液中有Cl 2存在解析 电解质必须是化合物,Cl 2是单质,既不是电解质,也不是非电解质,A 不正确;漂白粉是利用HClO 的强氧化性杀菌消毒,而明矾是利用Al 3+和水反应生成Al(OH)3胶体吸附杂质,B 不正确;D 项只能说明存在HClO ,D 不正确。
模块复习课[化学核心素养解读][核心知识回顾]一、原子结构与核外电子排布1.原子是由原子核和核外电子构成的,原子核中一定有质子,可能有中子。
2.原子核外电子优先排布在能量低的电子层内,每层最多容纳2n2个电子,最外层电子数目不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层不超过32个。
二、元素周期律1.同周期主族元素随着原子序数的递增,最外层电子数增多,原子半径减小,元素金属性减弱,非金属性增强。
2.同主族元素最外层电子数相同,原子序数越大,电子层数越多,原子半径越大,元素金属性增强,非金属性减弱,主族元素的最高正价等于主族序数(或最外层电子数)(O、F 除外)。
3.元素金属性强弱的判断依据:金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强;最高价氧化物对应水化物的碱性越强,金属性越强。
4.元素非金属性强弱的判断依据:单质越容易与氢气化合,生成的气态氢化物越稳定,非金属性越强;最高价氧化物对应水化物的酸性越强,非金属性越强。
三、元素周期表1.元素周期表的结构:元素周期表有7个横行,称为7个周期,其中1、2、3周期为短周期,4、5、6、7为长周期。
18个纵行,分为16个族,7个主族,7个副族,1个0族,1个Ⅷ族(包括8、9、10三个纵行)。
其中副族和Ⅷ族位于ⅡA族和ⅢA族之间。
2.主族元素在周期表中的位置与原子结构的关系:周期序数=电子层数;主族序数=最外层电子数。
四、离子键与共价键1.离子键是指使阴、阳离子结合的相互作用。
离子化合物一定含有离子键,可能含有共价键,可用电子式表示离子化合物的构成,如NaOH的电子式为。
2.共价键是指原子间通过共用电子对所形成的强烈的相互作用。
共价化合物只含有共价键,可用电子式表示共价化合物的构成,如CO2的电子式为。
五、同素异形现象与同分异构现象1.同一种元素能够形成几种不同的单质,这种现象称为同素异形现象,这些单质互称为该元素的同素异形体。
专题2化学反应与能量转化微型专题重点突破(三)1.变世观急:认识反应条件对化学反应述申址阳度的 揺响.丿枝我化学些化浪育抽件的規念。
£横型认知:痕据代学反皈速餐貶化学平術知识规律, 建立相关世堆揍型、并运用模型解薜实除问.題.5,宏观辭识口撒观探析:喪分析物质化学变此和能ht 转 杞与物质殺观结拘间的关幕「克难解羅箱准嵩豉、化学反应速率的计算与比较 【例1】NH 和C 2在一定条件下发生反应:4NH(g) + 3Q(g)2^9) + 6H2O(g),现向一容积不变的2 L 密闭容器中充入 4 mol NH 3和3 mol O 2,4 min 后反应达到平衡,测得生成的 H 2O(g)占混合气体总体积的 40%则下列表示的此段时间内该反应的平均速率不正确的是V (NH 3)= 0.25 mol •L -1 • min — 1答案 Cn (始)/mol A . B . C. V (N 2)= 0.125 mol •L -1 • min -1 V (H 2O) = 0.375 mol •L -1 • min -1 v (O 2)= 0.225 mol •L -1 • min -1 1 ;?遊行化学反应邇率的计算与比较" 2.理解外界黑件时化呼反应速率的母响= J.負判斷化学平衡的状态■:J.会井听忙学反应遠半和化学平衡图像-5.学会吸热反应•fli 块対反应的判断方祛,也能恭写駅化学方程式井la 行圖甲计薛、D. 解析 设转化的NH 的物质的量为x mol ,则4NH 3(g) + 302(g)2N 2(g) + 6HaO(g)n (变)/mol 0.750.5 x1.5 x n (平)/mol—0.75 x 0.5 x1.5 x1.5 x___ ------------- 2 mol 则有 X 100%= 40% 解得 x= 2, V (NH 3)(4 — x + 3-0.75 x + 0.5X + 1.5x )2 L X 4 min=0.25 mol •L -1 • min - 贝U v (O 2)= 0.187 5 mol •L -1 • min -1, v (N 2)= 0.125 mol •L -1 • min -1, V (H 2O) = 0.375 mol •L -1 • min -1根据题意, L 归纳总结•化学反应速率的计算及比较(1)根据已知数据,找出某一时间段内指定物质的浓度的改变值,然后根据△ c 和△ t 的比值计算得出反应速率。
专题3 有机化合物的获得与应用微型专题重点突破(五)一、甲烷、乙烯、苯的结构和性质例1(2018·温州十五校联合体联考)如图是三种常见有机物的比例模型示意图。
下列说法正确的是( )A.甲在光照条件下与Cl2反应可得到四种不同的产物B.乙、丙所有的原子均处于同一平面,均可与溴水反应使其褪色C.等质量的三种有机物充分燃烧消耗氧气的量依次减小D.在浓硫酸存在下,丙与浓硝酸共热的反应属于加成反应答案 C解析由图可知,甲为CH4,乙为CH2===CH2,丙为苯;甲烷与氯气发生取代反应生成四种卤代烃和HCl,共5种产物,故A错误;乙、丙所有的原子均处于同一平面,苯与溴水不反应,乙烯与溴水反应,故B错误;等质量的CH4、CH2===CH2、苯完全燃烧,消耗的氧气随含氢量的减小而减少,故C正确;在浓硫酸存在下,苯与浓硝酸发生取代反应生成硝基苯,故D错误。
液溴溴水溴的四氯化碳溶液酸性KMnO4溶液甲烷与溴蒸气在光照条件下发生取代反应不反应,液态烷烃可萃取溴水中的溴而使溴水褪色不反应,互溶,不褪色不反应乙烯发生加成反应,使液溴褪色发生加成反应,使溴水褪色发生加成反应,使溴的四氯化碳溶液褪色发生氧化反应,使酸性KMnO4溶液褪色苯一般不反应,催化条件下可发生取代反应不反应,苯可萃取溴水中的溴而使溴水褪色不反应,互溶,不褪色不反应变式1(2018·商丘九校联考)下列关于甲烷、乙烯和苯的说法错误的是( )A.天然气、可燃冰作为燃料的主要成分均是甲烷B.甲烷、乙烯与苯都属于烃类有机化合物C.甲烷和甲苯都不能使酸性高锰酸钾溶液褪色D.乙烯能与溴水中的溴发生加成反应答案 C解析天然气、沼气、可燃冰中含有大量的甲烷,故A正确;甲烷、乙烯与苯都只含C、H两种元素,属于烃,故B正确;甲苯中与苯环相连的C上有H能被酸性高锰酸钾溶液氧化,使其褪色,而甲烷是饱和烷烃不能被酸性高锰酸钾溶液氧化,故C错误;乙烯分子中含碳碳双键,和溴单质发生加成反应生成1,2二溴乙烷,故D正确。
二、烃的一氯代物同分异构体数目的判断例2四联苯的一氯代物有( )A.3种 B.4种 C.5种 D.6种答案 C解析推断有机物一氯代物的种数需要找中心对称轴,四联苯是具有两条对称轴的物质,即,在其中的一部分上有几种不同的氢原子(包括对称轴上的氢原子),就有几种一氯代物,四联苯有5种不同的氢原子,故有5种一氯代物。
若烃有n种不同的等效氢,其一元取代物就有n种。
(1)同一碳原子上的氢为等效氢;(2)同一碳原子上所连甲基(—CH3)上的氢为等效氢;(3)处于对称位置的碳原子上的氢为等效氢。
变式2下列烷烃在光照下与氯气反应,生成的一氯代烃种类最多是( )答案 B解析根据等效氢法分析可知,A有1种,B有3种,C有2种,D有2种。
三、烃的二氯代物同分异构体数目的判断例3分子式为C4H8Cl2的有机物有(不含立体异构)( )A.7种 B.8种 C.9种 D.10种解析丁烷(C4H10)具有2种碳骨架结构,先固定一个氯原子的取代位置,则另一个氯原子的位置如下所示:,共9种结构,C正确。
(1)先写出烃的同分异构体。
(2)然后再利用“定一移一”法,即先固定一个氯原子的位置,再移动另一个氯原子,以确定同分异构体的数目,同时要仔细考虑是否出现重复的情况。
变式3(2017·四川四市联考)分子式为C3H6Cl2的有机物共有(不考虑立体异构)( )A.2种 B.3种 C.4种 D.5种答案 C解析分子式为C3H6Cl2的有机物有CHCl2CH2CH3、CH3CCl2CH3、CH2ClCHClCH3、CH2ClCH2CH2Cl,共4种,选C。
四、有机物分子中原子能否共平面的判断例4已知HCN是直线形结构,下列有机分子中,所有的原子不可能处于同一平面的是( )A.CH2===CH—CN B.CH2===CH—CH===CH2C.D.答案 D解析A选项中的7个原子处于一个平面;B项分子中,M1和M2两个平面相交于一条直线C—C单键,由于单键可转动,因而可将M2平面转至与M1平面重合,所以该分子中所有原子可能处于同一平面;C项通过碳碳单键相连的两个平面,有可能重合在一起;D项分子中“—CH3”中的H原子和与它相连的C原子形成四面体结构,不在同一平面上。
变式4(2017·滨州高一检测)某有机物的结构简式为,其分子结构中处在同一平面内的原子最多有( )A.15个 B.16个 C.17个 D.18个解析 与苯环直接相连的原子和苯环上的原子共面,共有12个,—CH 3上有一个H 与苯环共面,根据乙烯的结构知—CH===CH 2中所有原子共面,都可与苯环共面,所以处于同一平面的原子最多有17个。
五、气态烃完全燃烧体积变化的规律例5 120 ℃时,1体积某烃和4体积O 2混合,完全燃烧后,恢复到原来的温度和压强,测得反应前后气体的体积不变。
该烃分子中所含的碳原子数不可能是( ) A .1 B .2 C .3 D .4 答案 D解析 烃燃烧通式为C x H y +(x +y 4)O 2――→点燃x CO 2+y 2H 2O(g),由燃烧前后体积不变,得1+(x +y 4)=x +y2(120 ℃),解得y =4。
依题意,4体积O 2为适量或过量,故x +y4≤4,因为y =4,故x ≤3。
气态烃完全燃烧体积变化的规律C x H y +(x +y 4)O 2――→点燃x CO 2+y2H 2O ΔV =V 后-V 前1 x +y 4 x y2 (1)若反应后水为气态,ΔV =y4-1。
当y >4,ΔV >0,气体总体积变大;当y =4,ΔV =0,气体总体积不变,CH 4、C 2H 4、C 3H 4符合; 当y <4,ΔV <0,气体总体积变小,只有C 2H 2符合。
(2)若反应后水为液态,ΔV =-(1+y4),反应后气体体积始终减小,且减小量只与氢原子数有关。
变式5 a mL 三种气态烃组成的混合物与足量氧气混合,点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2a mL 。
则三种烃可能是( ) A .CH 4、C 2H 4、C 3H 4 B .C 2H 6、C 3H 6、C 4H 6 C .CH 4、C 2H 6、C 3H 8 D .C 2H 4、C 2H 2、CH 4答案 A解析 设三种气态烃的平均分子组成为C n H mC n H m +(n +m 4)O 2――→点燃n CO 2+m2H 2O(l) 体积减少1 n +m 4 n 1+m4a 2a1a =1+m42a,m =4。
六、烃完全燃烧其耗氧量与产物量的判断 例6 有CH 4、C 2H 6、C 2H 4、C 3H 8、C 2H 2五种气态烃。
(1)若取相同质量的上述各烃完全燃烧,消耗氧气最多的是______,生成CO 2体积(相同状况)最大的是______。
(2)若取相同体积(相同状况)的上述各烃完全燃烧,消耗O 2最多的是________,生成H 2O 最少的是________。
答案 (1)CH 4 C 2H 2 (2)C 3H 8 C 2H 2解析 (1)等质量的各烃,含氢量最大的耗氧最多,即甲烷;含碳量最大的生成的二氧化碳最多,即C 2H 2。
(2)根据阿伏加德罗定律,相同体积(相同状况)的题述各烃物质的量相等,各取1 mol 以便于计算,则CH 4、C 2H 6、C 2H 4、C 3H 8、C 2H 2五种气态烃分别耗氧:1+44、2+64、2+44、3+84、2+24。
故耗氧量最多的是C 3H 8。
根据氢原子守恒,生成水最少的是C 2H 2。
等量不同烃完全燃烧时的耗氧量与产物量的关系等质量等物质的量耗氧量yx越大,耗氧量越多 x +y4越大,耗氧量越多产物量yx 越大,生成的CO 2越少而水越多 x 值越大,生成的CO 2越多;y 越大,生成的水越多变式6 等物质的量的下列有机物,分别在氧气中完全燃烧,耗氧量最多的是( ) A .CH 4 B .C 2H 6 C .C 4H 8 D .C 4H 6O 2 答案 C解析 CH 4的“耗氧数”为1+1=2;C 2H 6的“耗氧数”为2+1.5=3.5;C 4H 8的“耗氧数”为4+2=6;C 4H 6O 2的“耗氧数”为4+1.5-1=4.5。
看清是“等物质的量”还是“等质量”,“C 4H 6O 2”可以变形为“C 4H 2(H 2O)2”或“C 3H 6·CO 2”,则其耗氧量与C 3H 6或C 4H 2相等。
1.(2018·北京西城区校级期末)下列反应属于取代反应的是( ) A .乙烯通入酸性高锰酸钾溶液中 B .乙烯通入溴水中C .在镍作催化剂的条件下,苯与氢气反应D .苯与液溴混合后撒入铁粉 答案 D解析 乙烯通入酸性高锰酸钾溶液中发生氧化反应;乙烯通入溴水中发生加成反应;在镍作催化剂的条件下,苯与氢气发生加成反应;苯与液溴混合后撒入铁粉,发生取代反应生成溴苯和HBr。
2.(2018·浙江安吉学考模拟)下列各组物质不能使酸性高锰酸钾溶液褪色的是( )A.二氧化硫B.乙炔C.苯D.乙烯答案 C解析二氧化硫具有还原性,能使酸性高锰酸钾溶液褪色,故A错误;乙炔分子中含有碳碳叁键,能够被酸性高锰酸钾溶液氧化,从而使酸性高锰酸钾溶液褪色,故B错误;苯性质稳定,不能够被酸性高锰酸钾溶液氧化,故C正确;乙烯含碳碳双键,能与酸性高锰酸钾溶液反应,所以能使酸性高锰酸钾溶液褪色,故D错误。
3.(2018·西安市长安区期末)下列变化过程与化学反应无关的是( )A.苯与溴水混合振荡后,溴水层接近无色B.酸性高锰酸钾溶液中通入乙烯,溶液紫红色褪去C.光照条件下甲烷与氯气混合气体的颜色变浅D.苯乙烯使溴的四氯化碳溶液褪色答案 A解析苯与溴水不反应,发生萃取,则振荡后水层接近无色,为物理变化,故A选;乙烯含碳碳双键,能被酸性高锰酸钾氧化,则酸性KMnO4溶液褪色,为氧化反应,故B不选;甲烷与氯气在光照下发生取代反应,则一段时间后黄绿色消失,为取代反应,故C不选;苯乙烯含碳碳双键,与溴发生加成反应,则溴的四氯化碳溶液褪色,为加成反应,故D不选。
4.(2018·宁波诺丁汉附中高一期末)下列说法正确的是( )A.光照下,1 mol CH4最多能与4 mol Cl2发生取代反应,产物中物质的量最多的是CCl4B.苯与液溴在一定条件下能发生取代反应C.甲烷与乙烯混合物可通过溴的四氯化碳溶液分离D.乙烯和苯分子中均含独立的碳碳双键,都能与H2发生加成反应答案 B解析甲烷和氯气发生取代反应生成多种氯代烃,同时生成氯化氢,产物中物质的量最多的是氯化氢,A错误;苯与液溴在一定条件下可发生取代反应,生成溴苯,B正确;乙烯与溴的四氯化碳溶液发生加成反应,被除去,但不能实现分离,C错误;苯不含碳碳双键,但可与氢气发生加成反应,D错误。