细胞转染技术-宋晓萍
- 格式:ppt
- 大小:1.87 MB
- 文档页数:36

转染详细步骤大攻略范例----真核重组表达质粒pDsRed-N1-NS1在A549细胞中表达按上海索莱宝生物科技有限公司去内毒素质粒小提试剂盒说明书方法进行质粒抽提,测得质粒浓度为410.32ng/µl。
将培养的A549细胞铺板,待细胞密度长到90%左右时,按lipo2000说明书转染A549细胞,36h后于荧光显微镜下观察DsRed-NS1融合蛋白的表达情况。
具体操作步骤如下:1)质粒准备按上海索莱宝生物科技有限公司去内毒素质粒小提试剂盒说明书方法进行质粒抽提,具体步骤如下:(1) 取1-5ml细菌培养物,12000rpm离心1 min,尽量吸除上清(菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。
(2) 向留有菌体沉淀的离心管中加入200µl溶液P1(请先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌细胞沉淀。
(注:如果菌块未彻底混匀,会影响裂解导致质粒提取量和纯度偏低)(3)向离心管中加入200µl溶液P2,温和地上下翻转6-8次使菌体充分裂解。
(注:混匀一定要温和,以免污染基因组DNA,此时菌液应变得清亮粘稠,所用时间不应超过5min,以免质粒受到破坏)(4)向离心管中加入250µl溶液P3,立即温和地上下翻转6-8次,充分混匀,此时会出现白色絮状沉淀。
12000rpm 离心10min,用移液器小心地将上清转移到另一个干净的离心管中,尽量不要吸出沉淀。
(注:溶液P3加入后应立即混合,避免产生局部沉淀。
如果上清中还有微小白色沉淀,可再次离心后取上清)(5)加入1/5体积冰预冷的去内毒素清除剂,振荡混匀,溶液变浑浊,冰浴2min 至溶液变清亮。
(6)37℃水浴5 min,不时振荡,溶液又变浑浊。
12000rpm室温离心5min,溶液应分为两相,上层水相含质粒DNA,下层油状相含内毒素。
(7)将质粒DNA上层水相转移至新管,弃下层油状相,注意不要吸入油状相,重复抽提三次,即重复步骤5-7三次。

PEI法瞬时转染HEK-293F悬浮培养物细胞于37℃,150rpm下,CO2恒温箱中的振荡器平台上悬浮生长。
在进行转染之前,请保持5-7代的培养物,以确保稳定的生长模式。
HEK293悬浮细胞(Freestyle™293-F细胞,Life Technologies,目录号R790-07)于Freestyle™293表达培养基(Life Technologies,货号12338026)中培养。
细胞量应维持在4 x 105和3 x 106细胞/ml之间,体积不超过培养瓶总体积的20%。
最佳旋转速率由每种培养瓶类型和培养量确定。
Life Technologies的Freestyle™293-F细胞在更高的密度和体积下容易结块。
聚乙烯亚胺(PEI)(25 kDa线性PEI,Polysciences,Inc.,目录号23966)在含有25mM HEPES和150mM NaCl(pH 7.5)的缓冲液中以1 mg/ml的浓度制备成母液。
PEI添加到缓冲液,并涡旋振荡,直至完全溶解(这可能需要花费数分钟的涡旋时间)。
一旦完全溶解的PEI可以使用0.22 µM注射器过滤器进行无菌过滤,分装后在-20℃冷冻直至需要。
为了获得最佳的转染效率,细胞在转染时应具有> 95%的活力。
转染前24小时,使细胞分裂增殖至约1 x 106细胞/ml的密度,并在37°C CO2培养箱中振荡过夜。
转染时细胞密度应为约2 x 106细胞/ml。
转染应以2.5 x 106至3.0 x 106细胞/ml的细胞密度进行。
使用血球计数器对细胞计数,并调低足够的体积,以2.5 x 106细胞/ml的密度将细胞重悬在新鲜的293F Freestyle Media中,并以所需的体积进行转染。
转染前将细胞重悬于新鲜培养基至关重要。
条件培养基含有抑制转染的代谢产物。
细胞应在室温下以1200 rpm旋转10分钟。
转染24小时后,将转染产物以1:1稀释,即转染的初始体积是所需最终体积的一半。

Lipo2000 瞬时转染细胞步骤Stealth? RNAi or siRNA Transfection以24孔板为例,其余规格的转染见表11 中板,细胞密度为30-50%适宜。
注意:根据转染后细胞检测时间长短决定细胞中板密度,如果转染后需要长时间后检测,则细胞中板密度适当降低,已避免细胞过度生长导致存活降低。
C 将A B两管混合,放置20min。
转染期间,将24孔板培养基换成无血清培养基,每孔400ul。
将C管mix加入24孔板对应孔中,4-6小时候换成有血清培养基。
Table 1. Culture Shared reagents DNA transfection RNAi transfection像293T细胞,因为半贴壁,换液容易导致细胞飘起来,所以中间不换液。
转染步骤及经验(精华)一、基础理论转染是将外源性基因导入细胞内的一种专门技术。
分类:物理介导方法:电穿孔法、显微注射和基因枪;化学介导方法:如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法:有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。
理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。
病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。
生素可以进入细胞。
这降低了细胞的活性,导致转染效率低。
所以,在转染培养基中不能使用抗生素,甚至在准备转染前进行细胞铺板时也要避免使用抗生素。
这样,在转染前也不必润洗细胞。
对于稳定转染,不要在选择性培养基中使用青霉素和链霉素,因为这些抗生素是GENETICIN选择性抗生素的竞争性抑制剂。
另外,为了保证无血清培养基中细胞的健康生长,使用比含血清培养基更少的抗生素量。
3.细胞状态这点非常重要,不要急于求成,一定要让细胞处于最佳的生长状态再做。
有文献说传代不要超过17代。
细胞复苏后的3代左右时细胞状态最好,不要用传了很多代的细胞去做,细胞的形态都会发生变化。

L i p o2000瞬时转染细胞步骤Stealth?RNAiorsiRNATransfection以24孔板为例,其余规格的转染见表11中板,细胞密度为30-50%适宜。
注意:根据转染后细胞检测时间长短决定细胞中板密度,如果转染后需要长时间后检测,则细胞中板密度适当降低,已避免细胞过度生长导致存活降低。
2第二天(24-36小时后)每个孔转染方式如下:A将20pmolsiRNA溶于50ulOpti-mem无血清培养基中。
B将1ullipo2000溶于50ulOpti-mem无血清培养基中,混匀室温放置5min。
C将AB两管混合,放置20min。
3转染期间,将24孔板培养基换成无血清培养基,每孔400ul。
将C管mix加入24孔板对应孔中,4-6小时候换成有血清培养基。
PlasmidDNATransfectionDNA(ug):lipo2000(ul)=1:2-3转染时细胞密度越高,转染效率,表达效率也越高,并且可以降低细胞毒性。
1中板。
贴壁细胞:0.5-2X105cells/well,第二天待细胞密度达到70-80%时转染悬浮细胞:4-8X105cells/well,中板后随即转染。
2转染。
A将0.8ugDNA溶于50ulOpti-mem无血清培养基中。
B将2ullipo2000溶于50ulOpti-mem无血清培养基中,混匀室温放置5min。
C将AB两管混合,放置20min。
转染期间,将24孔板培养基换成无血清培养基,每孔400ul。
将C管mix加入24孔板对应孔中,4-6小时候换成有血清培养基。
Table1.CultureSharedreagentsDNAtransfectionRNAitransfection*:中板密度根据不同细胞不同实验有所不同,这里仅提的数据仅供参考**:6孔板细胞质粒转染量1-2ug足以。
***:6cmdish细胞质粒转染量4-6ug足以。
Opti-MEM?I减血清培养基是EMEM的改良型,其中使用了HEPES和碳酸氢钠进行缓冲,并添加次黄嘌呤、胸苷、丙酮酸钠、L-谷氨酰胺、痕量元素和生长因子.常用其作为无血清培养基与质粒和lip2000分别混合。

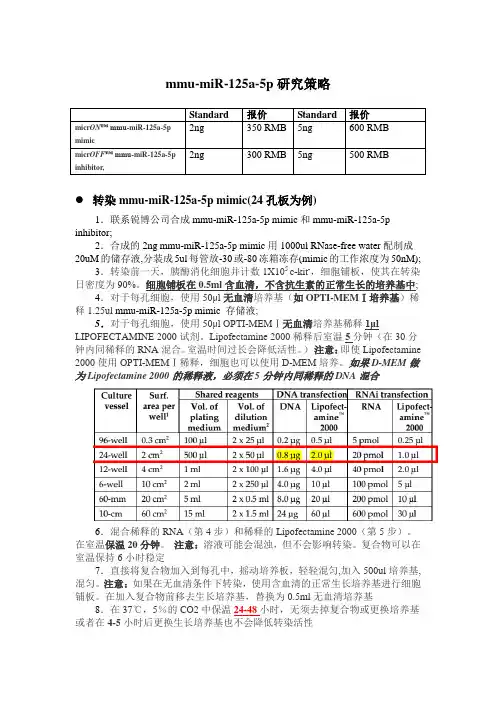
mmu-miR-125a-5p研究策略Standard 报价Standard 报价2ng 350 RMB 5ng 600 RMBmicr ON™ mmu-miR-125a-5pmimic2ng 300 RMB 5ng 500 RMBmicr OFF™ mmu-miR-125a-5pinhibitor,转染mmu-miR-125a-5p mimic(24孔板为例)1.联系锐博公司合成mmu-miR-125a-5p mimic和mmu-miR-125a-5p inhibitor;2.合成的2ng mmu-miR-125a-5p mimic用1000ul RNase-free water配制成20uM的储存液,分装成5ul每管放-30或-80冻箱冻存(mimic的工作浓度为50nM);3.转染前一天,胰酶消化细胞并计数1X105 c-kit-,细胞铺板,使其在转染日密度为90%。
细胞铺板在0.5ml含血清,不含抗生素的正常生长的培养基中;4.对于每孔细胞,使用50μl无血清培养基(如OPTI-MEMⅠ培养基)稀释1.25ul mmu-miR-125a-5p mimic 存储液;5.对于每孔细胞,使用50μl OPTI-MEMⅠ无血清培养基稀释1μl LIPOFECTAMINE 2000试剂。
Lipofectamine 2000稀释后室温5分钟(在30分钟内同稀释的RNA混合。
室温时间过长会降低活性。
)注意:即使Lipofectamine 2000使用OPTI-MEMⅠ稀释,细胞也可以使用D-MEM培养。
如果D-MEM做为Lipofectamine 2000的稀释液,必须在5分钟内同稀释的DNA混合6.混合稀释的RNA(第4步)和稀释的Lipofectamine 2000(第5步)。
在室温保温20分钟。
注意:溶液可能会混浊,但不会影响转染。
复合物可以在室温保持6小时稳定7.直接将复合物加入到每孔中,摇动培养板,轻轻混匀,加入500ul培养基,混匀。