甲烷乙烯
- 格式:ppt
- 大小:1.44 MB
- 文档页数:80
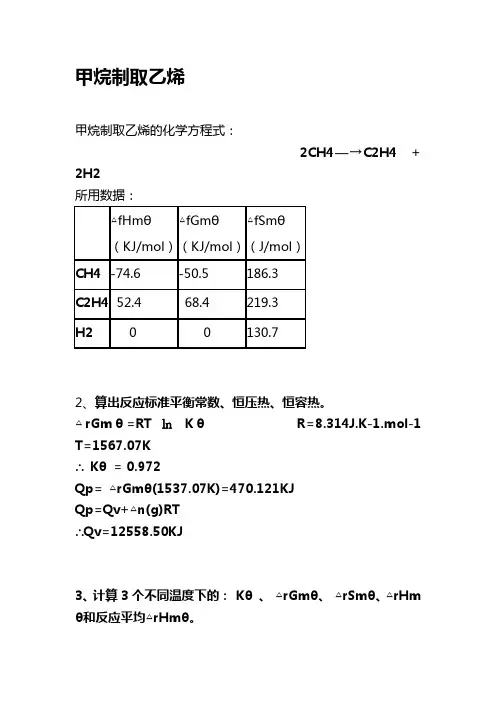
甲烷制取乙烯甲烷制取乙烯的化学方程式:2CH4—→C2H4 + 2H2所用数据:2、算出反应标准平衡常数、恒压热、恒容热。
△rGmθ=RT㏑KθR=8.314J.K-1.mol-1 T=1567.07K∴ Kθ = 0.972Qp= △rGmθ(1537.07K)=470.121KJQp=Qv+△n(g)RT∴Qv=12558.50KJ3、计算3个不同温度下的: Kθ、△rGmθ、△rSmθ、△rHmθ和反应平均△rHmθ。
所用温度:T1=298K、T2=1298K、T3=3298KT1: Kθ=1.071△rGmθ=169.4(KJ/mol)△rSmθ=0.1081(KJ/mol)△rHmθ=ΣVB △fHmθ=(-74.6)*(-2)+52.4+0=201.6(KJ/mol)反应平均△rHmθ=288.0207根据基希霍夫公式得:T2: Kθ=0.9814.分析在什么条件下有利于此反应?(温度、压力、惰性气体)由于此反应在标准情况下不能进行,根据基希霍夫公式可知,高温高压下有利于此反应进行;5工业上是如何实现此反应的。
(1)由石油分离生产乙烯是由石油化工裂解而成。
在这个过程中,气态或轻液态烃是加热到750-950 ℃,诱使许多自由基反应,然后立即淬火冻结的反应。
这个过程中,把大型碳氢化合物转换到较小型的碳氢化合物,并反应出不饱和烃。
(2)由煤合成方法煤合成烯烃(MTO):煤基制烯烃技术,它是C1化工新工艺,是指以煤气化的合成气合成的甲醇为原料,借助类似催化裂化装置的流化床反应形式,生产低碳烯烃的化工技术。
6.此合成物还有哪些工业制法?(发展历史、反应条件等)发展历史:乙烯,被称为“石化工业之母”,其生产能力被看作是一个国家经济实力的体现。
乙烯产品直接繁衍和带动发展塑料深加工、橡胶制品、纺织、包装材料、化工机械制造、运输、餐饮服务等配套产业。
大到航空航天、小到吃饭穿衣,乙烯与国民经济、人民生活息息相关。

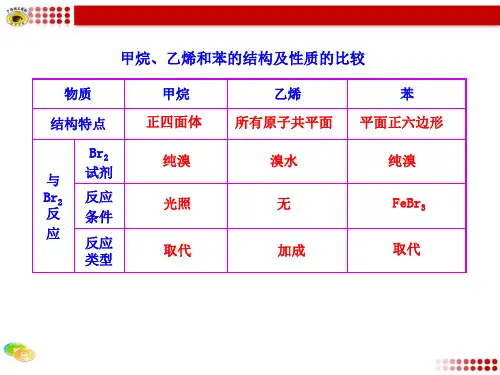


【同步实验课】甲烷、乙烯的化学性质【实验目的】1.探究甲烷与氯气的取代反应。
2.了解并掌握乙烯的氧化反应和加成反应。
【实验原理】室温、无光照时;甲烷与氯气不发生反应;光照时,甲烷与氯气发生反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢。
CH4+Cl2−−−→光照CH3Cl+HClCH3Cl+Cl2−−−→光照CH2Cl2+HClCH2Cl2+Cl2−−−→光照CHCl3+HClCHCl3+Cl2−−−→光照CCl4+HCl乙烯与溴发生加成反应,能与酸性高锰酸钾溶液、氧气发生氧化反应【实验试剂】乙烯、氯气、溴的四氯化碳溶液、石灰水、饱和食盐水、酸性高锰酸钾溶液【实验仪器】量筒(50ml)、试管、玻璃导管、铁架台(带铁夹)、酒精灯、胶皮管、集气瓶【实验一】甲烷与氯气发生取代反应实验操作图解操作实验现象实验结论1.取2支50mL的量筒,通过排饱和食盐水的方法先后各收集约10mL甲烷和40mL氯气。
其中1支量筒用预先准备好的黑色纸套套上,另1支量筒放在光亮处(不要放在日光直射的地方,以免引起爆炸)。
片刻后,比较2支量筒中的现象。
1.50mL甲烷和氯气混合气。
2.反应中液面上升3.出现油状液体1.甲烷氯气混合气2.黑纸套住3.液面未上升试管内气体黄绿色逐渐变浅,试管内壁有油状液体出现,且试管内液面上升。
在光照的条件下,甲烷与氯气发生了取代反应,生成气态一氯甲烷及油状液态的二氯甲烷、三氯甲烷、四氯甲烷。
01实验梳理02实验点拨03典例分析04对点训练05真题感悟4.量筒内未出现明显现象试管内无明显变化。
【实验二】乙烯的化学性质实验操作图解操作实验现象实验结论1.点燃纯净的乙烯,观察燃烧时的现象。
在燃烧后的集气瓶中倒入少量澄清石灰水,观察现象。
2.将乙烯通入到盛有酸性高锰酸钾溶液的试管中,观察现象。
3.将乙烯通入盛有溴的四氯化碳溶液的试管中,观察现象。
1.点燃集气瓶中的甲烷2.甲烷燃烧3.倒入少量石灰水4.石灰水变浑浊1.乙烯通入酸性高锰酸钾溶液甲烷在空气中燃烧,发出明亮的火焰,并有黑烟出现。

除甲烷中的乙烯的方法
除去甲烷中的乙烯方法如下:
通入溴水即可,溴水和乙烯加成生成的1,2二溴乙烷是液态,甲烷与溴水不反应,从而达到去除乙烯的效果。
方程式为CH2=CH2+Br2==CH2Br—CH2Br
乙烯:
乙烯是由两个碳原子和四个氢原子组成的化合物。
两个碳原子之间以双键连接。
乙烯存在于植物的某些组织、器官中,是由蛋氨酸在供氧充足的条件下转化而成的。
乙烯是合成纤维、合成橡胶、合成塑料(聚乙烯及聚氯乙烯)、合成乙醇(酒精)的基本化工原料,也用于制造氯乙烯、苯乙烯、环氧乙烷、醋酸、乙醛、乙醇和炸药等,尚可用作水果和蔬菜的催熟剂,是一种已证实的植物激素。
通常情况下,乙烯是一种无色稍有气味的气体,密度为1.256g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。

区分乙烯和甲烷的方法
识别乙烯和甲烷的方法主要有以下几种。
一、利用乙烯的不饱和性进行区分。
乙烯是一种不饱和烃,其分子之中含有一个双键,可以进行加成反应。
而甲烷是饱和烃,其分子之中只含有单键,不能进行加成反应。
利用这个特性,我们可以将待测物质与卤素(如溴)反应,如果反应产生颜色变化,说明待测物质中含有双键,即判断为乙烯。
二、通过酸性高锰酸钾溶液进行检测。
将待测物质加入酸性高锰酸钾溶液中,如果溶液颜色变为无色,说明待测物质可能为乙烯;如果溶液颜色无明显变化,则可能为甲烷。
三、借助红外光谱进行识别。
在红外光谱中,乙烯和甲烷的吸收峰位置有明显区别。
乙烯在911cm-1处有一个强烈的吸收峰,而甲烷在1300~1350cm-1和
2900~3000cm-1处有吸收峰,通过这种差异可以区分乙烯和甲烷。
四、通过燃烧特性进行区分。
乙烯燃烧时会产生黄色火焰,并放出明亮的光,而甲烷燃烧时产生的火焰为蓝色,光亮程度较低。
通过比较燃烧后的火焰颜色和亮度,可以进一步区分乙烯和甲烷。
以上就是区分乙烯和甲烷的主要方法,实际应用中可以根据实验条件的不同选择合适的方法。


区分CH2、C2H4和C2H2是化学实验和工业生产中常常遇到的任务。
这三种化合物在结构和性质上都有着明显的差异,因此需要采用不同的方法来进行区分。
本文将介绍区分这三种化合物的简易方法,帮助读者更好地理解它们之间的区别。
一、基本概念1. CH2CH2是甲烷分子,由一个碳原子和两个氢原子组成。
它是一种简单的饱和烃,具有着无色、无味、易燃的特点。
甲烷在自然界中广泛存在,是天然气的主要成分之一。
在化学实验中,甲烷通常以气体的形式存在。
2. C2H4C2H4是乙烯分子,由两个碳原子和四个氢原子组成。
它是一种不饱和烃,具有着较强的化学活性。
乙烯是一种重要的工业原料,可用于生产乙烯基聚合物、溶剂和化肥等产品。
3. C2H2C2H2是乙炔分子,由两个碳原子和两个氢原子组成。
它是一种不饱和碳氢化合物,具有着高燃烧性和高热值。
乙炔在工业生产中被广泛应用,可用于金属切割和焊接等领域。
二、区分方法1. 燃烧实验将待检测的气体与氧气混合后进行燃烧,观察燃烧时产生的火焰颜色和特点。
甲烷燃烧时火焰呈蓝色,乙烯燃烧时火焰呈明亮的橘红色,乙炔燃烧时火焰呈亮白色,并伴有明亮的爆裂声。
2. 化学反应利用氢化钠试剂和氯铵试剂进行化学反应,观察生成的沉淀物。
甲烷不与氢化钠和氯铵发生反应,乙烯在氢化钠和氯铵的反应中生成白色沉淀,乙炔在氢化钠和氯铵的反应中生成红褐色的沉淀。
3. 水合反应利用盐酸进行氢气化反应,观察生成的沉淀物。
甲烷在盐酸中不发生水合反应,乙烯在盐酸中生成轻微的水合反应,乙炔在盐酸中发生明显的水合反应,并伴有放热现象。
4. 物理性质通过测定待检测气体的密度、熔点和沸点等物理性质,进一步验证其种类。
甲烷的密度为0.656 g/L,熔点为-182.5℃,沸点为-161.5℃;乙烯的密度为1.1785 g/L,熔点为-169℃,沸点为-103.7℃;乙炔的密度为1.1702 g/L,熔点为-80.8℃,沸点为-84℃。
三、实例分析根据上述的区分方法,我们可以结合实验数据进行具体分析。

最简单的有机化合物——甲烷来自石油和煤的两种基本化工原料[考纲要求] 1.了解有机物中碳的成键特征。
2.了解有机化合物的同分异构现象。
3.了解甲烷等烷烃的主要性质。
4.了解乙烯、苯等有机化合物的主要性质。
5.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
知识点一甲烷1.甲烷的结构分子式:________,电子式:____________,结构式:____________,结构简式:________。
2.甲烷的性质(1)物理性质颜色:________,气味:________,密度:______________,比空气____。
溶解性:__________,状态:________。
(2)化学性质问题思考1.实验室收集甲烷时可采用什么方法?为什么?2.能否用甲烷与氯气反应制取纯净的一氯甲烷?3.取代反应与置换反应有何不同?知识点二烷烃1.结构特点碳原子间以________结合,其余价键均与________结合,使每个碳原子的化合价均达到________,因此烷烃又称饱和烃。
2.物理性质(1)均____溶于水且密度比水____。
(2)随碳原子数的增加,熔、沸点逐渐________,密度逐渐________。
(3)碳原子数为1~4时,烷烃为____态,当碳原子数≥5时,烷烃为________态。
3.化学性质烷烃的化学性质与甲烷类似,通常较________,在空气中能________,光照下能与氯气发生__________。
问题思考已知甲烷是正四面体结构,根据烷烃的碳原子连接情况分析,碳原子是否处于一条直线知识点三同系物与同分异构体1.同系物________相似,在分子组成上相差一个或若干个________原子团的物质互称为同系物。
2.同分异构现象化合物具有相同________,但具有不同________的现象。
3.同分异构体具有________现象的化合物互称为同分异构体,如C4H10的两种同分异构体为:知识点四乙烯1.烯烃分子中含有______________的烃叫做烯烃。

区别ch4 c2h4 c2h2的最简单方法摘要:一、区分CH4、C2H4、C2H2的必要性二、CH4、C2H4、C2H2的结构与性质特点三、最简单的区分方法四、实际应用与注意事项正文:区别CH4、C2H4、C2H2的最简单方法在化学领域,区分CH4、C2H4、C2H2这三种有机化合物具有一定的实际意义。
它们分别代表着不同的烃类化合物,具有不同的结构与性质。
下面我们将详细介绍这三种化合物的特点以及最简单的区分方法。
一、区分CH4、C2H4、C2H2的必要性CH4、C2H4、C2H2分别是甲烷、乙烯和乙炔,它们都属于烃类化合物。
在实际应用中,了解它们的区别有助于我们更好地掌握化学反应的规律,确保实验和生产过程的顺利进行。
二、CH4、C2H4、C2H2的结构与性质特点1.CH4(甲烷):分子式为CH4,结构为正四面体,碳原子与四个氢原子形成共价键。
甲烷是一种无色、无臭、不溶于水的气体,化学性质相对稳定,不易发生氧化反应。
2.C2H4(乙烯):分子式为C2H4,结构为平面型,碳原子之间形成一个双键。
乙烯是一种无色气体,具有刺激性气味。
乙烯的化学性质较活泼,容易发生加成反应,是重要的有机合成原料。
3.C2H2(乙炔):分子式为C2H2,结构为直线型,碳原子之间形成一个三键。
乙炔是一种无色、有毒、易燃的气体。
乙炔的化学性质非常活泼,容易发生加成反应,广泛应用于焊接和照明等领域。
三、最简单的区分方法1.观察燃烧现象:甲烷、乙烯、乙炔在燃烧时,火焰颜色有所不同。
甲烷燃烧时火焰呈蓝色,乙烯燃烧时火焰较明亮,伴有黑烟,乙炔燃烧时火焰明亮,伴有浓烟。
2.观察化学反应:乙烯和乙炔在空气中容易发生燃烧,而甲烷燃烧速度较慢。
在实验中,可以通过加入溴水或酸性高锰酸钾溶液观察反应情况。
乙烯和乙炔会使溴水褪色,而甲烷无明显反应。
四、实际应用与注意事项1.在工业生产中,了解CH4、C2H4、C2H2的区别有助于正确选择原料和优化生产过程。
甲烷和乙烯的方程式
甲烷和乙烯都是碳氢化合物,它们的化学式分别是CH4和C2H4。
首先,让我们来看看甲烷的化学方程式。
甲烷是最简单的烷烃,也就是最简单的碳氢化合物。
它的化学方程式可以表示为:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)。
这个方程式表示甲烷在氧气的存在下燃烧,产生二氧化碳和水。
这是一个常见的燃烧反应,也是甲烷在自然气和其他燃气中燃烧时
发生的反应。
接下来,让我们看看乙烯的化学方程式。
乙烯是一种烯烃,也
就是含有双键的碳氢化合物。
它的化学方程式可以表示为:
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g)。
这个方程式表示乙烯在氧气的存在下燃烧,同样产生二氧化碳
和水。
和甲烷不同的是,乙烯由于含有双键,在燃烧时会产生更高
的燃烧温度和能量。
总的来说,甲烷和乙烯都是重要的碳氢化合物,在工业生产和生活中都有广泛的应用。
它们的化学方程式可以帮助我们理解它们在不同条件下的化学性质和反应过程。
鉴别乙烯和甲烷的方法乙烯和甲烷是两种常见的有机化合物,它们的分子式分别为C2H4和CH4。
虽然它们都是碳氢化合物,但由于它们的结构不同,因此它们的性质也有很大的区别。
下面将介绍一些鉴别乙烯和甲烷的方法。
1. 燃烧实验乙烯和甲烷都可以进行燃烧反应,但由于它们的结构不同,因此在燃烧时产生的产物也不同。
乙烯在空气中完全燃烧时会生成CO2和H2O,而甲烷则会生成CO2和H2O以及少量的CO。
因此,在进行鉴别时可以将样品加入到火焰中观察火焰颜色以及火焰中是否有明显的黄色火苗。
2. 溶解性实验乙烯是一种不极性分子,而甲烷则是一种极性分子。
因此,在进行溶解实验时可以通过观察其溶解度来判断其类型。
通常情况下,乙烯只能在非极性溶剂中溶解(如正己烷、苯等),而甲烷则可以在任何溶剂中溶解。
3. 化学反应实验乙烯和甲烷还可以通过一些特殊的化学反应来进行鉴别。
例如,当乙烯与溴水反应时,会产生无色溶液变为橙黄色。
而甲烷与溴水反应时,则不会发生颜色变化。
此外,乙烯还可以和氢气进行加氢反应生成乙烷,而甲烷则不能进行这种反应。
4. 红外光谱分析红外光谱分析是一种非常常用的有机化合物鉴定方法。
在红外光谱图上,乙烯和甲烷都有比较明显的吸收峰。
对于乙烯来说,其吸收峰通常出现在3000 cm-1左右(C-H伸缩振动)、1650 cm-1左右(C=C伸缩振动)以及650 cm-1左右(C-H弯曲振动)。
而对于甲烷来说,则主要表现为一个宽峰出现在3000 cm-1左右(C-H伸缩振动)以及一个小峰出现在1400 cm-1左右(C-H弯曲振动)。
综上所述,通过燃烧实验、溶解性实验、化学反应实验以及红外光谱分析等方法,可以比较准确地鉴别乙烯和甲烷。
在实际的化学实验中,我们可以根据需要选择其中的一种或多种方法进行鉴别。
鉴别甲烷和乙烯的方法甲烷和乙烯都是常见的碳氢化合物,它们在结构上有一定的差异。
下面我将从物理性质、化学性质和实验方法等几个方面详细介绍甲烷和乙烯的鉴别方法。
一、甲烷和乙烯的物理性质鉴别方法:1. 熔点和沸点:甲烷的熔点为-182.5摄氏度,沸点为-161.5摄氏度;乙烯的熔点为-169摄氏度,沸点为-103.7摄氏度。
通过测量样品的熔点和沸点,可以初步判断其是否为甲烷或乙烯。
2. 密度:甲烷的密度为0.7164 g/cm³,乙烯的密度为0.5678 g/cm³。
通过测量样品的密度,可以进一步鉴别甲烷和乙烯。
二、甲烷和乙烯的化学性质鉴别方法:1. 燃烧反应:甲烷与氧气发生燃烧反应生成二氧化碳和水,乙烯也能与氧气发生燃烧反应生成二氧化碳和水。
但是由于甲烷的热效应更高,因此甲烷的燃烧反应更为剧烈,火焰明亮耀眼。
2. 与卤素的反应:乙烯能与卤素发生加成反应,生成醋酸乙烯。
而甲烷由于缺乏双键,无法与卤素发生加成反应。
3. 与溴水的反应:溴水是检验烯烃的试剂之一。
乙烯与溴水反应,溴在乙烯上发生加成反应,生成无色液体溴化乙烷。
而甲烷由于无双键,无法与溴水发生反应,溴水仍为黄色。
4. 氢化反应:乙烯能与氢气发生加氢反应,生成乙烷。
而甲烷已经是最高度饱和的烃,无法发生氢化反应。
三、甲烷和乙烯的实验鉴别方法:1. 使用气体色谱仪(GC):气体色谱仪是一种常见的用于鉴别和分离化合物的仪器。
乙烯和甲烷在气体色谱上会有不同的保留时间或峰值,通过检测样品在气相色谱上产生的色谱图,可以鉴别甲烷和乙烯。
2. 使用红外光谱仪(IR):红外光谱主要用于分析和鉴别化合物的官能团。
甲烷和乙烯在红外光谱上会有不同的吸收峰,可以通过检测样品在红外光谱上的吸收峰来鉴别甲烷和乙烯。
3. 使用质谱仪(MS):质谱仪主要用于分析和鉴别化合物的分子结构和分子量。
甲烷和乙烯在质谱上会有不同的质谱图,可以通过检测样品在质谱上产生的质谱图来鉴别甲烷和乙烯。