《药品销售证明》审批程序
- 格式:doc
- 大小:58.59 KB
- 文档页数:4

国家药品监督管理局关于印发药品出口销售证明管理规定的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】2018.11.09•【文号】国药监药管〔2018〕43号•【施行日期】2018.11.09•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文关于印发药品出口销售证明管理规定的通知国药监药管〔2018〕43号各省、自治区、直辖市食品药品监督管理局,新疆生产建设兵团食品药品监督管理局:为进一步规范《药品出口销售证明》的办理,为我国药品出口提供便利和服务,国家药品监督管理局制定了《药品出口销售证明管理规定》,现予发布,请遵照执行。
有关事项通知如下:一、请各省(区、市)局按照《国务院办公厅关于印发进一步深化“互联网+政务服务”推进政务服务“一网、一门、一次”改革实施方案的通知》(国办发〔2018〕45号)和本通知要求,完善内部申请办事流程,压缩办理时限,积极推行网上受理和出证,为出口企业提供便利。
信息化条件成熟的,可视情况逐步以电子提交代替纸质复印件申报。
二、国家局将建设统一的药品出口销售证明信息管理系统。
在该系统正式上线运行前,各省(区、市)局通过药品生产和监管信息直报系统上传出证数据信息,包含证明文件原件(pdf文件格式)。
信息管理系统上线后,按系统要求传送出证数据信息。
三、关于本规定第四条中“与我国有相关协议的国际组织提供的相关品种证明文件”,由国家局提出审核意见。
各省(区、市)局可依据国家局审核意见予以办理。
四、请各地对出口药品生产企业加强监管,按照药品生产质量管理规范,严格把握检查标准和尺度,重点关注企业执行供应商审计和落实数据可靠性要求的情况。
各地为企业提供出证服务的同时,督促企业持续合规生产;发现不符合要求的,及时采取措施。
五、本规定自发布之日起施行,原国家药品监督管理局《关于印发〈出具“药品销售证明书”若干管理规定〉的通知》(国药监安〔2001〕225号)同时废止。

《药品经营许可证》(零售)审批程序一、审批依据《中华人民共和国药品管理法》《中华人民共和国药品管理法条例》《药品经营许可证管理办法》《江西省开办药品经营企业暂行办法》二、审批机关市食品药品监督管理局药品流通监管科承办。
申办人按程序要求向市食品药品监督管理局提出申请,由市局对申报材料进行形式审查,符合要求的开具《受理通知书》,予以受理,申请材料存在可以当场更正错误的,允许当场更正,申请材料不齐全或者不符合法定形式的,应当当场或者在5个工作日内向申请人发出《补正材料通知书》,一次性告知需要补正的全部内容。
三、《药品经营许可证》(零售)申办程序(一)申办条件1、人员条件(1)申办人应具有中专(含高中)以上文化程度,并具有与经营规模相适应的一定数量依法经过资格认定的药学技术人员,负责企业药品质量管理、验收、养护、处方药销售审核和用药指导等药学服务工作,上述人员应熟悉并遵守国家的有关法律,无生产、销售假劣药品的行为。
(2)经营处方药、甲类非处方药的县以上城区药品零售企业,必须配备至少两名有一年以上药品经营质量管理或药品调剂工作经验,并具有药师以上技术职称的人员,其中必须至少有一名执业药师。
上述人员中应有能熟练使用计算机软件管理所经营药品质量的人员;(3)经营处方药、甲类非处方药的农村乡镇药品零售企业,必须配备有一年以上药品经营质量管理或药品调剂工作经验,能熟练使用计算机软件管理所经营药品质量,并具有药师以上技术职称的人员;(4)经营乙类非处方药的药品零售企业和农村村级药品零售企业,应当配备具有药士以上技术职称,或具有高中以上学历并经设区市级以上食品药品监督管理部门考核合格的业务人员;(5)经营中药饮片的药品零售企业,在县以上城区的,必须配备中药师以上技术职称的人员;在农村乡镇(含)以下地区的,必须配备中药士以上技术职称的人员或具有中药专业中专以上学历的人员。
以上药学技术人员,应身体健康,年龄一般不超过65周岁,在企业营业时间均必须在职在岗,不得在其他单位兼职;2、营业场所及设施设备条件(1)具有一定规模的经营场所。

医药公司药品销售管理规定1.目的:为加强药品销售质量管理,规范销售工作,确保将合格药品销售给具有合法资质的购货单位,特制定本管理规定。
2.范围:适用于本企业药品销售的全过程管理。
3.1购货单位:本制度所表示购货单位就是所指从本企业供货药品的中国境内的医疗机构、药品经营企业以及药品生产企业即为:销售客户。
4.1购货单位合法资质审核4.1.1药品销售必须对购货单位的合法资质展开审查证实,销售部门严禁将药品销售给未经审查证实的购货单位。
4.1.2销售部门负责向购货单位索取下列资质证明材料并进行初审,建立销售客户档案。
(1)《药品经营许可证》、《医疗机构执业许可证》复印件;(2)企业《营业执照》(副本)复印件;(3)gsp证书证书复印件:(4)购货单位的开户户名、开户银行及账号等开票信息。
(5)其他国家法律法规规定的须要索要的资料文件。
4.1.3由购货单位提供的上述材料均需加盖企业原印章,所有材料应完整、清晰、有效。
不符合以上要求的应重新索取。
4.1.4购货单位为医疗机构的,须索要《医疗机构执业许可证》复印件,复印件上须要盖章该医疗机构原印章。
4.1.5购货单位为其他性质医疗单位的,须索取其合法资质证明文件复印件,复印件上需加盖该单位原印章。
4.1.6质量管理部门对销售部门递交的购货单位资质证明材料展开质量审查。
(1)审核购货单位提供材料的完整性、真实性和有效性:(2)审查与否远远超过有效率证照所规定的生产(经营)范围和经营方式:4.1.7购货单位合法资质审核程序,按公司有关程序执行。
对未通过审核确认的购货单位,公司任何人不得与其建立业务关系。
4.1.8对尚无正常业务关系的销售客户,应当特别注意审查证实其资质文件的有效性、与否存有项目更改,例如少于有效期限或存有项目更改,质量管理部门应当通告销售部门及时索要有关资质证明材料展开审查证实,并更新销售客户档案。
4.1.10质量管理部门负责计算机管理信息系统中销售客户基础信息的维护和控制,并按期审核、更新相关内容。


江苏省食品药品管理局关于委托出具药品销售证明书的通知
【法规类别】药品管理
【发文字号】苏食药监药生[2015]269号
【发布部门】江苏省食品药品监督管理局
【发布日期】2015.10.21
【实施日期】2015.10.21
【时效性】现行有效
【效力级别】地方规范性文件
江苏省食品药品管理局关于委托出具药品销售证明书的通知
(苏食药监药生〔2015〕269号)
各市食品药品监管局,昆山、泰兴、沭阳县(市)市场监管局(食品药品监管局):为进一步深化行政审批制度改革要求,贯彻落实转变政府职能、简政放权和放管结合的要求,达到简化手续、缩短流程、提高效率的目的,经研究,自2015年12月1日起,将出具《药品销售证明书》事项委托各市食品药品监管局办理,现就有关事项通知如下:
一、《药品销售证明书》是关于药品生产企业和上市药品合法性的涉外证明文件,是监管公信力和权威性的体现,各市局要高度重视该项工作的重要内涵,把受托出具《药品销售证明书》纳入本局行政审查业务管理范畴,严格按照国家总局和省局相关文件要
求,完善工作程序,明确工作责任,细化工作标准,指定熟悉英语和监管业务的人员专门负责该项工作,确保出具证明的合法性和规范性。

医疗药品审批程序医疗药品的审批程序是一个严谨而复杂的过程,它涉及到人们的健康和生命安全。
为了确保药品的质量、安全性和有效性,各国都制定了相应的审批程序。
下面将为您详细介绍医疗药品审批的步骤和要求。
一、临床试验阶段医疗药品的审批流程通常从临床试验阶段开始。
在临床试验期间,药品的研发者会选择一定数量的受试者进行测试,评估药品的安全性和有效性。
临床试验需要在正式开始前提交相关申请并获得批准。
在试验期间,研发者需要准确记录试验结果,并且保证受试者的权益和安全。
二、提交申请材料在临床试验结束后,医药企业需要提交一系列的申请材料,包括药物的化学和物理特性、质量控制方法、生产工艺等。
此外,还需要提交药物的临床试验数据和药物的药理学和毒理学研究结果。
这些材料的准确完整是药品审批顺利进行的前提。
三、药物审查及评估进入这个阶段后,相关药品审查部门会对申请材料进行仔细审查,确保药品符合国家的法规和标准。
审查的内容主要包括:药物的质量、安全性和有效性;生产工厂的合规性和质量控制措施;临床试验数据的可靠性等。
药品审查部门还可能会对药物进行临床审查和药物的国家监管情况进行检查。
四、批准与注册如果药品顺利通过了评估和审查,药品审查部门会发出药品注册证书。
注册证书明确了药品的名称、规格、适应症、用法用量、生产者信息等。
一旦获得注册证书,药品才能正式投放市场,供医生和患者使用。
五、监管和上市药品的审批并不意味着审查工作的结束,相反,监管部门会持续对该药品进行监督,确保其质量和安全。
监管部门会定期对药品进行抽样检测,对生产工厂进行现场检查,以确保药品在市场上的质量符合要求。
同时,医药企业也需遵守相关法规,定期向监管部门上报药品的生产、销售和使用情况。
六、药品信息披露药品的审批程序还包括了药品信息的披露要求。
医药企业需要向医生、药师和患者提供详细准确的药品信息,以确保医疗人员能够正确使用和患者能够安全合理使用药品。
此外,医药企业还需向监管部门和公众公开药品的安全性和有效性。

《《药品经营许可证》(零售)核准程序》第一篇:《药品经营许可证》(零售)核准程序东莞市《药品经营许可证》(零售)核准程序一、许可内容《药品经营许可证》(零售)二、设定许可的法律依据1、《中华人民共和国药品管理法》;2、《中华人民共和国药品管理法实施条例》;3、《药品经营许可证管理办法》;4、《广东省开办药品零售企业验收实施标准(xx年修订)》。
三、许可数量按照《药品管理法》第14条规定,开办药品零售企业,除应符合《药品管理法》第15条规定的条件外,还应当遵循合理布局和方便群众购药的原则。
四、许可条件1、具有保证所经营药品质量的规章制度;2、企业、企业法定代表人或企业负责人、质量负责人无《药品管理法》第76条、第83条规定的情形;3、开办企业负责人应具有执业药师资格或药师(含中药师)以上技术职称;4、企业质量负责人应具有执业药师资格或药师(含中药师)以上技术职称,并有一年以上(含一年)药品经营质量管理工作经验;营业场所面积在200平方米(含)以上的,质量负责人应具执业药师执业资格。
5、企业质量管理机构负责人或质量管理人员应具有执业药师执业资格或药师(含中药师)以上技术职称。
营业场所面积每超出开办标准150平方米,需增加一名具有执业药师资格或药师(含)以上技术职称的药学技术人员。
6、申请经营处方药的药品零售企业必须配有2名以上处方审核人员,处方审核人员应具有执业药师资格或药师(含中药师)以上技术职称;经营中药材或中药饮片的零售药店必须配备一名中药师(含)以上技术职称或执业中药师资格的人员。
企业质量负责人、质量管理人员、处方审核人员应在职在岗,不得在其它单位兼职。
7、具有与所经营药品相适应的营业场所(商业用途,同一平面连续使用面积60m以上),营业场所应有调节和检测温、湿度的设施设备。
必须安装空调,有玻璃门、窗等与外界有效间隔的设施,并配备容积为0.15立方米以上的冷藏设备。
在超市等其他商业企业内设立零售药店的,必须具有符合规定面积的独立区域;8、具有独立的计算机管理信息系统,能覆盖企业药品购进、验收、储存、销售和质量控制的全过程,符合《药品经营质量管理规范》对药品经营各环节要求;能达到利用互联网传递接收信息,实现接受食品药品监管部门监管要求;能使用电脑开具标明药品名称、生产厂商、规格、数量、价格、批号等内容的销售凭证。

门店药品销售操作程序门店药品销售操作程序门店药品销售是一项非常重要的业务,它涉及到人们的健康和生命安全,所以门店药品销售操作程序必须要规范、严谨,遵循相关法律法规和行业规定,以确保药品销售的安全和合法性。
下面是一份门店药品销售操作程序,供参考。
一、前期准备1.药品许可证和营业执照:门店必须持有药品销售许可证,合法经营。
同时,门店还需具有营业执照,确保合法经营。
2.药品注册证书:药品需要具备药品注册证书,证明药品符合相关国家标准和法律法规要求。
3.执业药师资格:门店必须配备有执业药师,确保门店销售的药品是适合顾客使用的,符合规定。
4.药品储存条件:门店要确保药品储存条件符合规定,药品应当存放在阴凉、通风、干燥、无异味的环境中。
二、顾客咨询1.顾客接待:顾客进入门店后,应当迎接顾客。
询问顾客需要购买的药品是什么,帮助顾客选择商品。
2.询问顾客用药情况:药师应当询问顾客的用药情况,包括当前的健康状况、症状、药品过敏情况等,以确认用药的安全性。
3.说明药品功效和用法:药师应当向顾客说明药品的功效、用法、用量,以确保顾客正确使用药品。
4.其他注意事项:药师还应当向顾客说明药品的副作用、禁忌人群、注意事项等,以便顾客做出正确的选择。
三、药品销售操作1.核对药品名称和规格:药品销售时要核对药品名称和规格,避免发生错误。
2.记录销售时间和金额:销售药品时要记录销售时间和销售金额,并交由负责人审核。
3.药品包装:药品包装要无损、完整,确保药品品质。
4.开具发票:对于顾客提出开具发票的要求,门店要按规定开具发票。
五、售后服务1.咨询服务:顾客在使用药品时遇到问题,可以随时向门店咨询,药师应当尽力为顾客提供解答。
2.退货服务:若顾客购买的药品存在质量问题,可提供退货服务。
3.投诉处理:若顾客对药品的质量或服务存在不满意,可以向门店进行投诉,门店应当及时并适当地回应,解决问题。
总之,门店药品销售操作程序需要遵循相关法律法规和行业规范,确保药品销售的合法性和安全性。

药品经营许可证管理办法药品是人们常用的医学物品,因其关系到人们健康和生命安全,所以其经营也需要有一定的管理。
为了加强药品经营管理,维护人民生命健康,国家出台了《药品经营许可证管理办法》。
本文将从许可证定义、申请条件、审批程序等方面详细介绍该管理办法。
一、许可证定义药品经营许可证是中国食品药品监督管理局颁发的证明企业(个体工商户)具备从事药品经营活动的资质的证明文件。
二、申请条件1.依法设立,具备独立法人资格或具有经合法注册登记的企业。
2.具有符合规定的仓储设施和销售场所。
3.有与所经营药品种类相适应的管理人员和专业技术人员,并且制定健全的管理制度。
4.药品的来源、运输及存储符合规定的要求。
5.具有与所经营药品相适应的资金和物资保障能力。
6.有符合规定的销售记录和药品使用记录。
7.依法参加社会保险、缴纳社会保障费和税费。
三、审批程序1.申请人(企业或个体工商户)到当地药品监管部门提交《药品经营许可证申请》和相关材料。
2.药品监管部门按照申请人提交的材料进行审查,同时进行现场检查。
3.如发现申请材料不齐或不符合要求,药品监管部门应当在5个工作日内告知申请人需要补正的材料或不符合的事项。
4.申请人补正后重新提交申请材料。
5.药品监管部门对补正后的申请材料进行审核,并进行现场检查。
6.对符合资格的申请人,药品监管部门应当在20个工作日内出具药品经营许可证。
7.对不符合条件的申请人,药品监管部门应当在书面形式告知不予批准,并告知不予批准的理由。
8.申请人可以在收到不予批准的书面通知后15日内向上一级药品监督管理部门申请复查,并向原审批机关提出书面申请,同上一级药品监督管理部门共同组织复查。
四、管理办法1.许可证号码必须在销售场所醒目位置公示。
2.药品经营许可证有效期为5年,过期后需要重新办理。
3.许可证持有人不得将许可证转让、出借或借用,不得将药品销售许可证转让或出租。
4.药品经营许可证持有人有义务按照规定销售药品,不得销售假药、劣药、过期药、变质药等不合格药品。

广东省药品出口销售证明办事指南(2020)为规范广东省《药品出口销售证明》的办理,依据《国家药品监管局关于印发药品出口销售证明管理规定的通知》(国药监药管〔2018〕43号)的相关要求,特制定本指南。
一、总则出具《药品出口销售证明》是根据企业申请,为其药品出口提供便利的服务事项,广东省药品监督管理局负责广东省内《药品出口销售证明》出具办理工作。
二、申请条件广东省境内严格按照药品生产质量管理规范要求进行生产的药品上市许可持有人、药品生产企业(以下简称“申请企业”)可申请出口“已批准上市药品”“已批准上市药品的未注册规格(单位剂量)”“未在我国注册的药品(须符合与我国有相关协议的国际组织要求)”三种类型的《药品出口销售证明》,国务院及有关部门限制或者禁止出口的药品除外。
符合出口欧盟原料药申报条件的企业请申办《出口欧盟原料药证明》事项。
三、申报资料申请企业办理药品出口销售证明的,应当向所在地省级药品监督管理部门提交《药品出口销售证明申请表》(附件1),说明出口目的(需提供相关证明材料),并依情况同时提交以下资料(所有申报材料中涉及外文内容需提供第三方机构的翻译):(一)药品上市许可持有人证明文件或者药品生产企业的《药品生产许可证》正、副本;(二)已批准上市药品的药品批准证明文件(“未在我国注册的药品”类型无须提供此项);(三)与我国有相关协议的国际组织提供的相关品种证明文件(提供原件,仅“未在我国注册的药品”类型须提供此项,相关目录见附件2,申报企业先到国家局申请,省局根据国家局提出审核意见予以办理);(四)境内监管机构近3年内最近一次相关品种或生产场地接受监督检查的相关资料(无菌药品等高风险药品生产企业需提供自申报之日起近一年内药品GMP符合性检查(含GMP认证检查、飞行检查、跟踪检查、许可检查等)相关记录。
其他品种需提交近三年内接受药品GMP符合性检查及一年内接受日常检查的相关记录;如当年内接受过药品GMP符合性检查的,无需提供日常检查相关记录。
药品销售许可规章制度药品销售许可规章制度是指为了保障药品市场的安全、规范和有序,各国针对药品销售进行的一系列管理措施和规定的总称。
这一制度的实施,旨在加强对药品销售行为的监管,确保药品的质量、安全和有效性,保护公众的健康权益。
一、药品销售许可的意义药品销售许可的设立具有重要的现实意义和深远的影响。
首先,药品销售许可制度可以有效监管药品销售行为,防止非法销售、假冒伪劣药品的流通,从而保障公众的用药安全。
其次,该制度能够规范药品市场秩序,提高药品销售环境的质量,增强市场竞争力,推动行业的健康发展。
最后,药品销售许可制度有助于加强政府对药品销售过程的监管,提高行政管理水平,形成规范化、标准化的管理模式。
二、药品销售许可的法律依据药品销售许可制度是各个国家法律体系中的重要组成部分,具有明确的法律依据。
以中国为例,我国的药品销售许可依据《药品管理法》以及相关行政法规和规章制度进行统一管理。
根据法律规定,任何企业或个人在销售药品之前,都必须取得国家药品监督管理部门颁发的销售许可证书,并按照规定的程序和条件进行销售活动。
三、药品销售许可的申请与审批程序药品销售许可的申请与审批程序严格规定,一般包括以下几个环节。
首先,申请人需要向国家药品监督管理部门递交销售许可证书的申请材料,包括企业的法人资格证明、药品采购渠道的合法性证明、销售人员的相关资质证书等。
其次,国家药品监督管理部门对申请材料进行审核,并进行现场检查,核实企业的场所、设备以及销售管理情况,确保符合法律法规的要求。
最后,根据审核结果,国家药品监督管理部门会对合格的申请进行批准,并颁发销售许可证书,同时将相关信息记录在药品监管的数据库中供查询。
四、药品销售许可的期限与监管措施药品销售许可证书的有效期限一般为三年,过期后需重新申请。
在销售期间,相关企业需严格遵守相关规定,接受国家药品监管部门的监督和检查。
为了保障药品销售的质量和安全,药品销售许可制度还规定了一系列的监管措施。
药品出口销售证明管理规定第一条为进一步规范《药品出口销售证明》的办理,为我国药品出口提供便利和服务,制定本规定。
第二条《药品出口销售证明》适用于中华人民共和国境内的药品上市许可持有人、药品生产企业已批准上市药品的出口,国务院有关部门限制或者禁止出口的药品除外。
对于与已批准上市药品的未注册规格(单位剂量),药品上市许可持有人、药品生产企业按照药品生产质量管理规范要求生产的,也可适用本规定。
对于未在我国注册的药品,药品上市许可持有人、药品生产企业按照药品生产质量管理规范要求生产的,且符合与我国有相关协议的国际组织要求的,也可适用本规定。
出具《药品出口销售证明》是根据企业申请,为其药品出口提供便利的服务事项。
第三条由各省、自治区、直辖市药品监督管理部门负责本行政区域内《药品出口销售证明》出具办理工作(已批准上市的药品的式样见附件1,已批准上市药品的未注册规格的式样见附件2,未在我国注册的药品的式样见附件3)。
第四条药品上市许可持有人、药品生产企业办理药品出口销售证明的,应当向所在地省级药品监督管理部门提交《药品出口销售证明申请表》(式样见附件4)。
对于已批准上市的药品、已批准上市药品的未注册规格,应当分别提交相应的《药品出口销售证明申请表》,同时提交以下资料:(一)药品上市许可持有人证明文件或者药品生产企业的《药品生产许可证》正、副本(均为复印件);(二)已批准上市药品的药品注册证书(复印件);(三)境内监管机构近3年内最近一次相关品种接受监督检查的相关资料(均为复印件);(四)《营业执照》(复印件);(五)按照批签发管理的生物制品须提交《生物制品批签发合格证》(复印件);(六)申请者承诺书;(七)省级药品监督管理部门另行公示要求提交的其他资料。
对于未在我国注册的药品,提交《药品出口销售证明申请表》的同时,提交以下资料:(一)药品上市许可持有人证明文件或者药品生产企业的《药品生产许可证》正、副本(均为复印件);(二)与我国有相关协议的国际组织提供的相关品种证明文件(原件);(三)《营业执照》(复印件);(四)境内监管机构近3年内最近一次生产场地接受监督检查的相关资料(复印件);(五)申请者承诺书;(六)省级药品监督管理部门另行公示要求提交的其他资料。
药品经营许可(零售)办事指南一、什么是申请人承诺制?“申请人承诺制”是指信用良好的申请人对照许可机关公示的许可条件,经自查符合条件要求且书面承诺按许可的条件和标准建设,符合许可条件后方开展相关生产经营活动,并自愿依法承担相应法律责任的,许可机关经书面审核后当场发放相关许可决定的一种深化“放管服”改革措施。
许可发证后,由后续监管部门在规定的时间内对照《自查表》内容完成跟踪检查,并根据检查结果依法处理。
“申请人承诺制”改革的主要特点:一是将事前的部门监督改为申请人的自建自查,有助于落实申请人主体责任,强化申请人的自我管理约束;二是将事前的现场核查改为事后跟踪检查,既简政提速增效,又强化事中事后监管;三是将许可与申请人的信用挂钩,有利于推进社会信用建设。
二、“申请人承诺制”适用范围(一)以下事项适用“申请人承诺制”:⒈《食品生产许可证》延续、变更(新增食品类别、新增生产场所除外);⒉主体业态为食品销售经营者和经营场所面积在100㎡以下(含100㎡)的餐饮服务经营者、单位食堂的《食品经营许可证》新办{限定经营项目为:热食类食品制售、糕点类食品制售(不含裱花蛋糕)、自制饮品制售(不含自酿酒)};⒊《食品经营许可证》延续、变更;⒋《医疗器械经营许可证》(门店)延续(适用于2015年10月15日后取得《医疗器械经营许可证》的门店)、登记事项变更;⒌《药品经营许可证》(零售连锁门店)换发。
(二)以下守信者适用申请人承诺制:申请人信用良好,具有以下情形之一的,不符合申请人承诺制申办的资质条件:⒈因食品安全犯罪被判处有期徒刑以上刑罚的(《中华人民共和国食品安全法》第一百三十五条第二款规定:因食品安全犯罪被判处有期徒刑以上刑罚的,终身不得从事食品生产经营管理工作,也不得担任食品生产经营企业食品安全管理人员);2.近五年被吊销食品生产经营许可证、药品经营许可证、医疗器械经营许可证的相关生产经营者及其法定代表人、直接负责的主管人员和其他责任人员;3.近三年因以欺骗、贿赂等不正当手段取得食品生产经营、药品经营、医疗器械经营许可而被原发证的监督管理部门撤销相关许可的;4.近一年因违反食品、药品、医疗器械监督管理法律法规而被处予罚款以上(含罚款)行政处罚的;5.近一年的日常检查结果为“不符合”的(新办的不适用);6.其他的失信情形。
简述gmp认证申报与审批程序GMP认证是指药品生产企业按照国家药品GMP要求,经过认证机构的审核,获得符合GMP标准的认证证书。
在药品生产和销售过程中,GMP认证是必须的,它可以保证药品质量、安全和有效性。
下面将详细介绍GMP认证申报与审批程序。
一、申报前准备1.了解国家有关GMP认证的政策法规企业在申请GMP认证之前,需要了解国家有关GMP认证的政策法规。
这些政策法规包括《中华人民共和国药品管理法》、《药品生产质量管理规范》等。
2.组建GMP团队企业需要组建一个专门的团队来负责GMP认证工作。
这个团队应该包括各个部门的专业人员,例如生产、质量控制、仓储等。
3.制定计划和时间表企业需要制定一个详细的计划和时间表来指导申报过程。
这个计划应该包括各个阶段的工作内容、时间节点以及责任人等。
二、申报流程1.提交申请材料企业需要向当地食品药品监督管理局提交申请材料。
申请材料包括企业基本情况、生产设施和设备情况、人员素质和培训情况、产品质量控制体系等。
2.现场检查申请材料审核通过后,当地食品药品监督管理局将组织现场检查。
现场检查的内容包括生产车间、仓储条件、设备设施、人员素质等。
3.审核意见反馈现场检查结束后,当地食品药品监督管理局将向企业反馈审核意见。
如果存在不符合GMP要求的地方,企业需要进行整改。
4.再次审核企业完成整改后,当地食品药品监督管理局将再次进行审核。
如果通过审核,企业将获得GMP认证证书。
三、审批流程1.申请材料提交企业需要向当地食品药品监督管理局提交审批申请材料。
审批申请材料包括产品注册证明、生产许可证明等。
2.技术评估当地食品药品监督管理局将对申请的产品进行技术评估。
评估内容包括产品质量标准、工艺流程等。
3.临床试验如果需要进行临床试验,企业需要在当地食品药品监督管理局的指导下进行。
4.审批意见反馈当地食品药品监督管理局将向企业反馈审批意见。
如果存在不符合要求的地方,企业需要进行整改。
开办药品零售点的申报程序开办药品零售点需要遵循一定的申报程序,以确保其合法性和安全性。
下面将介绍开办药品零售点的申报程序。
一、获取相关资质证书首先,申请人需要取得《药品经营许可证》或者《营业执照》、《卫生许可证》,这些证书是开设药品零售店的必须条件。
《药品经营许可证》是指药品经营企业在经过药品监管部门的审批后,取得的经营药品的许可证书,以证明其药品的来源和药品的质量可靠;《卫生许可证》是指药品销售商取得的卫生部门颁发的许可证书,是开展药品销售业务的基本证明文件;《营业执照》是商业企业开展业务的基础文件,也是开设药品零售店的必须条件。
二、办理《药品经营许可证》申报人需要向当地食品药品监督管理部门提交申请材料,包括提供药品经营企业或个体经营者的相关证明文件和证照,如工商营业执照和法人资格证明等;药品经营企业的法人代表或主要负责人的身份证、学历证明及资格证书等个人信息;申请经营的药品名称、品种等等。
三、申请《卫生许可证》申请人需向当地卫生部门提交申请材料,包括:药品销售场所的环境卫生安排方案、卫生设施和卫生用品的安排方案、卫生工作人员的健康证和上岗证等。
四、备案审批经过药品监管部门和卫生部门的审批,并符合法律法规的相关要求,即可办理《药品经营许可证》和《卫生许可证》,顺利完成药品销售点的备案审批工作。
五、经营药品销售药品销售的流程按照申报材料进行,从药品名称、品种等的申报到药品销售点环境的管理都需要在进货、销售、验收、存放、管理和安全方面遵守国家药品监管法规的规定。
六、日常监督管理药品销售点的日常监督管理主要涉及以下方面的内容:药品采购,药品库存、销售、预警和风险管理,对卫生安全的监督,对药品价格的监管,在此基础上,加强与权威机构的沟通,了解新的科技技术、政策等。
同时,对药品库存、销售等数据进行分类、分析和评估,提高规范管理、质量管理水平。
七、禁止销售违禁药品药品销售点在经营药品销售过程中必须要遵循相关的国家法律法规规定,禁止销售违禁药品,如假药、劣药、侵权药品等。
药品销售许可证办理流程与注意事项下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!药品销售许可证办理流程及注意事项详解药品销售许可证是从事药品销售业务的企业必须具备的合法凭证,它确保了药品市场的规范运营和公众用药安全。
《药品销售证明》审批程序
许可项目名称:《药品销售证明》的审批
法定实施主体:江西省食品药品监督管理局
许可依据
1、《中华人民共和国药品管理法》
2、国家药品监督管理局关于印发《出具“药品销售证明书”若干管理规定》的通知(国药监安[2001]225号)
收费标准:不收费
总时限:自受理之日起5个工作日(不含制证、送达时限)
受理1个工作日
审核1个工作日
复核2个工作日
审定2个工作日
制作行政许可决定2个工作日(不计入审批时限)
送达3个工作日(不计入审批时限)
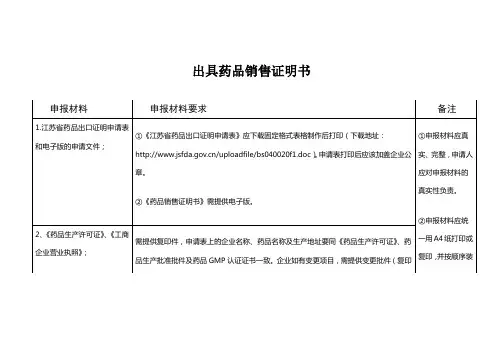
受理范围:申请出具“药品销售证明书”的申请人:省内的药品生产企业。
许可程序:
一、申请与受理
申报资料项目:
《药品出口证明申请表》2份,各药品生产企业可以在国家局网站()(1)、
下载表格。
(2)药品批准证明文件复印件
(3)《药品生产许可证》、《药品GMP证书》、《工商企业营业执照》(复印件)。
(4)国家药品监督管理局规定的国家批签发的生物制品须出示国家批签发证书。
(复印件)(5)按国家局公布《药品销售证明书》格式制作的《药品销售证明书》草样6份,,各药品生产企业可以在国家局网站()下载表格。
申报资料要求:
(1)填写、修改、保存、打印;
(2)申报资料档案袋应制作封面,封面应载明“药品销售证明书”字样、申报单位、申请日期、联系人、联系方式等内容;
(3)使用A4纸张、4号—5号宋体打印。
标准:
1、按照申报资料的要求核对申报资料种类、数量符合要求;
2、凡申报资料需提交复印件的,申请人须在复印件上注明日期,加盖单位公章。
3、申请表填写正确、规范,证明性文件齐全、有效;
4、申报资料齐全、规范,符合形式审查要求;
5、申请人和/或申报项目具备相应的申报资质;
6、申请事项依法需要经过行政许可;
7、申请事项依法属于本行政机关职权范围。
岗位责任人:省局行政受理服务中心受理人员
岗位职责及权限
1、按照标准查验申请材料。
2、对申请材料齐全、符合形式审查要求的,应及时受理,填写《受理通知书》,将《受理通知书》交与申请人作为受理凭证。
3、对申请人提交的申请材料不齐全或者不符合形式审查要求的,受理人员应当当场一次告知申请人补正有关材料,填写《补正材料通知书》,注明已具备和需要补正的内容。
4、经补正资料后符合形式审查要求的,应及时受理,填写《受理通知书》,将《受理通知书》交与申请人作为受理凭证;经补正资料后仍不符合形式审查要求的,不予受理,填写《不受理通知书》并载明其理由,将《不受理通知书》和全部申报资料一并退回申请人。
5、对申请事项不属于本部门职权范围或该申请事项不需行政许可的,不予受理,填写《不予受理通知书》,并告知所属审查机关或不予受理的理由。
6、《受理通知书》、《不予受理通知书》应当加盖省局受理专用章,注明日期。
7、对已受理的申请,应提出审查意见,并及时将《受理通知书》、审查意见和全部申报资料一并转省局注册处审核人员,双方应办理交接手续。
时限:1个工作日
二、审核
标准:各种申报资料项目、份数齐全,内容格式规范,证明文件有效。
岗位责任人:省局注册处审核人员
岗位职责及权限
(1)对证明文件的合法性和申报资料的完整性、规范性进行审查。
(2)对符合出口药品要求,《药品销售证明书》文字核对无误,提出拟办意见,签名并交复审人员审核。
时限:1个工作日
三、复审
标准:申请资料内容格式规范、证明文件齐全有效,审核过程、手续和材料符合规定。
岗位责任人:省局注册处分管处领导
岗位职责及权限:
1、按照复审标准对申报资料及审核程序的合法性进行复审。
2、同意审核人员,在有关申请表、审查意见表上签字。
3、部分同意或不同意审核人员意见的,应与审核人员沟通情况,交换意见后,提出复审意见及理由,将审核材料和申报资料一并由受理中心转交审定人员。
时限:2个工作日
四、审定
标准:申请资料的证明文件合法有效、前期审核过程、手续和材料符合规定;
岗位责任人:省局分管受理中心局领导
岗位职责及权限
按照审定标准对复审意见进行审定。
⑴同意复审意见的,在审核材料上签字。
⑵不同意复审意见的,应与复审人员沟通情况、交换意见,提出审定意见及理由,将全部资料转受理中心。
时限:2个工作日
五、制作行政可决定
标准:
⑴相关的申请表、材料内容完整、规范。
审核、复审、审定意见符合规定,审核人员、复审人员、审定人员均已签字,审定后的全部资料份数符合要求;
⑵全部审核资料均已盖章,无漏印;
⑶许可文书等符合公文要求,制作的文书内容完整、正确、有效,格式、文字和加盖的省局印章准确无误;
⑷留存归档的审批资料齐全、规范。
岗位责任人:省局行政受理服务中心制证人员
岗位职责及权限:按照核发工作标准核发有关文件,并进行归档。
⑴对审批材料编号、文印、盖章;
⑵按照审定意见,制作《药品销售证明书》,加盖省局印章;
⑶按标准规定将全部材料归档。
时限:2个工作日
六、送达
标准:
1.通知申请人审核结果及缴费等相关事宜或领取《药品销售证明书》或《不予行政许可决定书》。
2、及时通知申请人许可结果,在《送达回执》上的签字、注明日期。
岗位责任人:省局行政受理服务中心送达人员
岗位职责及权限:
1、负责通知申请人审核结果及缴费等相关事宜或领取《药品销售证明书》或《不予行政许可决定书》,在《送达回执》上签字,注明日期。
时限:3个工作日(不计入审批时限)。