晶体结构练习题
- 格式:ppt
- 大小:212.00 KB
- 文档页数:12

晶体结构习题目录一判断题;二选择题;三填空题;四回答问题一判断题(返回目录)1固体物质可以分为晶体和非晶体两类。
()2无机盐都是离子晶体。
()3晶体都存在晶格能,晶格能越大则物质的熔点越高。
()4晶体的熔点均比离子晶体的熔点高。
()5温常压下,原子晶体物质的聚集状态只可能是固体。
()6晶体的物质在任何情况下都不导电。
()7晶体的特性之一是熔点均相对较低。
()8晶体的特性之一是熔点高。
()9层状晶体均可作为润滑剂和导电体使用。
()10质可生成两种或两种以上的晶体,这种现象叫做类质多晶现象。
()11体层与层之间的主要结合力为金属键。
()12形物质都是由微小的晶粒组成的。
()13界存在的晶体或人工制备的晶体中,所有粒子都是按照一定规律有序排列的,没有任何缺陷。
()14具有相同电子层结构的单原子离子,阳离子的半径往往小于阴离子的半径。
()15离子半径是离子型化合物中相邻离子核间距的一半。
()16同种元素离子的半径随离子电荷代数值增大而减小。
()17仅依据离子晶体中正负离子半径的相对大小即可决定晶体的晶格类型。
()18NaCl晶体中配位数比是6:6,因此每个晶胞中含有6个Na+和6个Cl-。
()19NaCl晶体是由Na+和Cl-组成的面心立方晶格交错(重叠1/2)排列而成。
()20CsCl晶体是由Cs+和Cl-的简单立方交错(重叠1/8)排列而成。
()21每个CsCl晶胞中含有1个Cs+和1个Cl-。
()22每个NaCl晶胞中含有4个Na+和4个Cl-。
()23一般来说,离子晶体的晶格能越大,该晶体的热稳定性就越低。
()24离子晶体的晶格能越大,熔点越低。
()25对离子晶体而言,离子半径变大,将有利于其晶格能变小。
()26玻恩(Born)-哈柏(Haber)循环是从热力学数据计算晶格能的有效方法之一。
()27晶格能是由指定单质生成一摩尔(按化学式计)的离子化合物所释放的能量。
()28离子所带电荷越多,半径越小,则离子键就可能越强,晶格能也越大。

第二章 晶体的结构习题及答案1.晶面指数为(123)的晶面ABC 是离原点O 最近的晶面,0A ,0B 和0C 分别与基矢1a ,2a 和3a 重合,除0点外,0A ,0B ,和0C 上是否有格点?若ABC 面的指数为(234),情况又如何?[解答] 晶面家族(123)截1a ,2a ,和3a 分别为1,2,3等份,ABC 面是离原点0最近的晶面,0A 的长度等于1a 长度,0B 的长度等于2a 的长度的1/2 ,0C 的长度等于3a 的长度的1/3 ,所以只有A 点是格点。
若ABC 面的指数为(234)的晶面族,则A 、B 、和C 都不是格点。
2.在结晶学中,晶胞是按晶体的什么特性选取的?[解答] 在结晶学中,晶胞选取的原则是既要考虑晶体结构的周期性又要考虑晶体的宏观对称性。
3. 在晶体衍射中,为什么不能用可见光?[解答] 晶体中原子间距的数量级为1010-米,要使原子晶格成为光波的衍射光栅,光波的波长应小于1010-米。
但可见光的波长为7.6 — 7100.4-⨯米,是晶体中原子间距的1000倍。
因此,在晶体衍射中,不能用可见光。
4.温度升高时,衍射角如何变化?X 光波长变化时,衍射角如何变化?[解答] 温度升高时,由于热膨胀,面间距h k l d 逐渐变大,由布拉格反射公式λθn d hkl =sin 2可知,对应同一级衍射,当X 光波长不变时,面间距hkl d 逐渐变大,衍射角θ逐渐变小。
所以温度升高,衍射角变小。
当温度不变,X 光波长变大时,对于同一晶面族,衍射角θ随之变大。
5.以刚性原子球堆积模型,计算以下各结构的致密度(一个晶胞中刚性原子球占据的体积与晶胞体积的比值称为结构的致密度)分别为:(1)简立方,6π ; (2)体心立方,π83 ; (3)面心立方,π62 ; (4)金刚石结构,π163。
[解答] 该想晶体是由刚性原子球堆积而成。
一个晶胞中刚性原子球占据的体积与晶胞体积的比值称为结构的致密度。

四种晶体练习题及答案在化学和物理学科中,晶体是一种具有规律排列的原子、离子或分子组成的固体。
晶体结构的类型对于材料的物理性质有着重要的影响。
以下是四种常见晶体结构的练习题及答案。
练习题1:请描述简单立方晶体的排列特征,并说明其晶格常数的计算方法。
答案1:简单立方晶体中,原子或分子在立方体的每个顶点上排列,每个顶点的原子属于相邻的八个立方体共享。
晶格常数a可以通过测量立方体的边长来确定。
练习题2:面心立方(FCC)晶体和体心立方(BCC)晶体有何区别?请用原子填充率来说明。
答案2:面心立方晶体中,除了立方体的每个顶点上有一个原子外,每个面的中心也有一个原子。
体心立方晶体则在立方体的中心有一个原子,而顶点上没有原子。
FCC的原子填充率大约为74.05%,而BCC的原子填充率大约为68%。
练习题3:金刚石晶体是一种什么类型的晶体结构?请简述其原子排列方式。
答案3:金刚石晶体是一种面心立方晶体结构,但它的每个原子都与四个其他原子以四面体的方式连接,形成了一个非常稳定的三维网络。
练习题4:石墨的晶体结构是怎样的?请描述其层与层之间的连接方式。
答案4::石墨具有六角晶系的层状结构,每个碳原子与其三个最近邻的碳原子以sp²杂化形成平面六角网状结构,层与层之间通过范德华力连接。
练习题5:为什么说晶体的缺陷会影响其物理性质?答案5:晶体的缺陷,如点缺陷、线缺陷(位错)和面缺陷(晶界),会打断原子的规律排列,从而影响晶体的机械强度、导电性和光学性质等。
例如,位错的存在可以降低晶体的强度,而晶界的增加可以降低晶体的电导率。
结束语:通过以上练习题及答案,我们可以看到晶体结构的多样性及其对材料性质的重要影响。
了解和掌握不同晶体结构的特点对于材料科学和化学领域的研究至关重要。
希望这些练习题能帮助你更好地理解晶体结构的基本概念。

(一).填空题1.同非金属相比,金属的主要特性是2.晶体与非晶体的最根本区别是3.金属晶体中常见的点缺陷是,最主要的面缺陷是。
4.位错密度是指,其数学表达式为。
5.表示晶体中原子排列形式的空间格子叫做,而晶胞是指。
6.在常见金属晶格中,原子排列最密的晶向,体心立方晶格是,而面心立方晶格是。
7.晶体在不同晶向上的性能是,这就是单晶体的现象。
一般结构用金属为晶体,在各个方向上性能,这就是实际金属的现象。
8.实际金属存在有、和三种缺陷。
位错是缺陷。
实际晶体的强度比理想晶体的强度得多。
9.常温下使用的金属材料以晶粒为好。
而高温下使用的金属材料在一定范围内以晶粒为好。
‘10.金属常见的晶格类型是、、。
11.在立方晶格中,各点坐标为:A(1,0,1),B (0,1,1),C (1,1,1/2),D(1/2,1,1/2),那么AB晶向指数为,OC晶向指数为,OD晶向指数为。
12.铜是结构的金属,它的最密排面是,若铜的晶格常数a=0.36nm,那么最密排面上原子间距为。
13 α-Fe、γ-Fe、Al、Cu、Ni、Pb、Cr、V、Mg、Zn中属于体心立方晶格的有,属于面心立方晶格的有,属于密排六方晶格的有。
14.已知Cu的原子直径为0.256nm,那么铜的晶格常数为。
1mm3Cu中的原子数为。
15.晶面通过(0,0,0)、(1/2、1/4、0)和(1/2,0,1/2)三点,这个晶面的晶面指数为()16.在立方晶系中,某晶面在x轴上的截距为2,在y轴上的截距为1/2;与z轴平行,则该晶面指数为.17.金属具有良好的导电性、导热性、塑性和金属光泽主要是因为金属原子具有的结合方式。
18.同素异构转变是指。
纯铁在温度发生和多晶型转变。
19.在常温下铁的原子直径为0.256nm,那么铁的晶格常数为。
20.金属原子结构的特点是。
21.物质的原子间结合键主要包括、和三种。
2.大部分陶瓷材料的结合键为。
23.高分子材料的结合键是。

晶体结构与性质练习题晶体是由一定的周期性排列的原子、分子或离子组成的固体物质。
晶体的结构与性质有着密切的联系,不同的晶体结构会导致不同的晶体性质。
为了帮助大家更好地理解晶体结构与性质之间的关系,下面将提供一些练习题,供大家进行学习和思考。
题目一:简单晶体结构1. 以NaCl为例,简述其晶体结构的特点。
2. 请说出以下晶体中的阴离子和阳离子:CaF2、K2SO4、MgO。
3. 解释为什么NaCl和KCl的晶体结构相似,但是它们的性质却有所不同。
题目二:晶体缺陷1. 什么是点缺陷?举例说明。
2. 简述晶体中的位错缺陷以及其对晶体性质的影响。
3. 解释为什么金刚石可以成为优质的宝石。
题目三:晶体的导电性1. 解释为什么金属晶体具有良好的导电性。
2. 什么是半导体晶体?举例说明其应用。
3. 简述离子晶体的导电性及其应用。
题目四:晶体的光学性质1. 什么是吸收谱和荧光谱?它们对于研究晶体结构和性质有何意义?2. 简述偏光现象产生的原因以及其应用。
3. 解释为什么金属外观呈现出不同的颜色。
题目五:晶体的热学性质1. 解释晶体的热膨胀现象及其原理。
2. 简述晶体的热导性质以及其在热散热领域的应用。
3. 解释为什么铁磁性晶体具有自发磁化特性。
题目六:晶体的力学性质1. 解释为什么晶体呈现出不同的硬度。
2. 简述晶体的弹性性质以及其应用。
3. 什么是形状记忆合金?简述其工业应用。
以上是晶体结构与性质练习题,希望能够帮助大家加深对晶体结构与性质之间关系的理解。
通过思考与学习这些问题,相信大家能够更好地掌握晶体学知识,并在实际应用中发挥自己的才能。
祝你们学习进步!。

高中化学晶体结构与性质练习题学校:___________姓名:___________班级:_____________一、单选题1.下列关于晶体的结构,粒子间的相互作用的说法,正确的是()A.分子晶体中只存在范德华力B.离子晶体中只存在离子键C.共价晶体中都存在极性键D.金属晶体中只存在金属键2.某晶体的一部分如图所示,这种晶体中A、B、C三种微粒数之比是()A.3:9:4 B.1:4:2 C.2:9:4 D.3:8:5 3.下列各组物质的晶体中,化学键类型和晶体类型均相同的是()A.NH3和NH4Cl B.HCl和H2OC.KCl和K D.CO2和SiO24.电子表、电子计算器、电脑显示器都运用了液晶材料显示图象和文字。
有关其显示原理的叙述中,正确的是()A.施加电压时,液晶分子沿垂直于电场方向排列B.移去电压后,液晶分子恢复到原来状态C.施加电场时,液晶分子恢复到原来状态D.移去电场后,液晶分子沿电场方向排列5.下列物质的晶体类型与其他几个不同的是()A.Na2S B.MgCl2C.AlCl3D.Al2O36.下列说法中,错误的是()A.只含分子的晶体一定是分子晶体B.碘晶体升华时破坏了共价键C.几乎所有的酸都属于分子晶体D.稀有气体中只含原子,但稀有气体的晶体属于分子晶体7.美国某杂志曾经报道:在40 GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,有关原子晶体干冰的推断错误的是()A.有很高的熔点和沸点B.易汽化,可用作制冷材料C.含有极性共价键D.硬度大,可用作耐磨材料8.化学用语是学习化学的工具和基础。
下列有关化学用语的说法或使用正确的是A.稀有气体的晶体,其组成微粒是原子,晶体中不存在分子间作用力B.核素C—12的原子组成符号为C,二氧化碳分子的结构式为O=C=OC.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2OD.表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol 9.铁元素形成的单质有三种晶胞的结构,如图所示,则下列说法正确的是()A.铁元素基态原子M层上有8对成对电子BC.三种晶胞α、β、θ中铁原子的配位数之比为4:6:3D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体结构相同10.下列说法正确的是()A.晶体一般都是透明的B.金刚石属于混合型晶体C.区分晶体和非晶体最可靠的科学方法是对固体进行X射线衍射实验D.在[Cu(NH3)4]2+配离子中NH3与中心离子Cu2+结合的化学键是非极性键11.金属钛(Ti)与氮形成的某种化合物常被用作高温结构材料和超导材料。
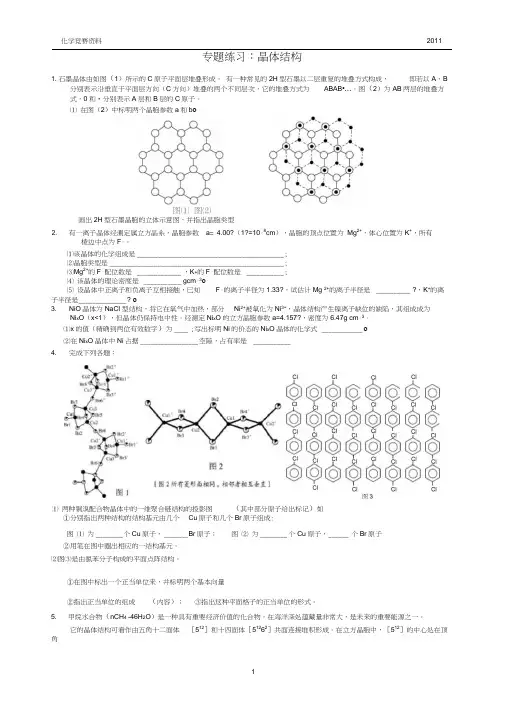
专题练习:晶体结构1. 石墨晶体由如图(1)所示的C原子平面层堆叠形成。
有一种常见的2H型石墨以二层重复的堆叠方式构成,即若以A、B 分别表示沿垂直于平面层方向(C方向)堆叠的两个不同层次,它的堆叠方式为ABAB•…。
图(2)为AB两层的堆叠方式,0和•分别表示A层和B层的C原子。
⑴ 在图(2)中标明两个晶胞参数a和b o图⑵画岀2H型石墨晶胞的立体示意图,并指岀晶胞类型有一离子晶体经测定属立方晶系,晶胞参数a= 4.00?(1?=10「8cm),晶胞的顶点位置为Mg2+,体心位置为K+,所有棱边中点为F「。
⑴该晶体的化学组成是___________________________________________ ;⑵晶胞类型是___________________________________________________ ;⑶Mg2+的F「配位数是_____________ ,K+的F「配位数是___________ ;⑷ 该晶体的理论密度是___________ gcm「3o⑸ 设晶体中正离子和负离子互相接触,已知F「的离子半径为1.33?,试估计Mg 2+的离子半径是__________ ?,K+的离子半径是______________ ?o3. NiO晶体为NaCI型结构,将它在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成成为Ni x O(x<1),但晶体仍保持电中性。
经测定Ni x O的立方晶胞参数a=4.157?,密度为6.47g cm「3。
⑴x的值(精确到两位有效数字)为____ ;写出标明Ni的价态的Ni x O晶体的化学式____________ o⑵在Ni x O晶体中Ni占据_________________ 空隙,占有率是___________4. 完成下列各题:①分别指出两种结构的结构基元由几个Cu原子和几个Br原子组成:图⑴ 为________ 个Cu原子,_______ B r原子;图⑵ 为________ 个Cu原子,______ 个Br原子②用笔在图中圈出相应的一结构基元。

专题八化学键分子和晶体的结构与性质考点三晶体结构与性质1.(2022湖北,7,3分)C60在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。
下列关于该碳玻璃的说法错误的是()A.具有自范性B.与C60互为同素异形体C.含有sp3杂化的碳原子D.化学性质与金刚石有差异答案A A项,自范性是晶体的性质,碳玻璃为非晶态,没有自范性,错误;B项,碳玻璃和C60是由碳元素形成的不同的单质,二者互为同素异形体,正确;C项,碳玻璃的硬度高,与金刚石类似,结构也应有一定的相似性,所以含有sp3杂化的碳原子,正确;D项,同素异形体性质差异主要表现在物理性质上,但化学性质也存在差异,正确。
2.(2022湖北,9,3分)某立方卤化物可用于制作光电材料,其晶胞结构如图所示。
下列说法错误的是()A.Ca2+的配位数为6B.与F-距离最近的是K+C.该物质的化学式为KCaF3D.若F-换为Cl-,则晶胞棱长将改变答案B A项,由题图可知,Ca2+位于体心,F-位于面心,所以Ca2+的配位数为6,正确;B项,F-与K+F-与Ca2+的最近距离为棱长的12,与F-距离最近的是Ca2+,错误;C项,一个该晶胞中含K+个数为18×8=1,F-个数为12×6=3,Ca2+个数为1,故该物质的化学式为KCaF3,正确;D项,F-的半径小于K+,它位于四个K+围成的空隙中,Cl-的半径比K+大,Cl-替换F-后K+不再相切,晶胞棱长变长,正确。
知识拓展离子晶体的“堆积—填隙”模型:按照金属晶体中金属原子的空间堆积方式,把金属原子换成大的离子(通常是阴离子),然后把电性相反的小离子(通常是阳离子)填入堆积球的空隙中,就得到离子晶体的“堆积—填隙”模型。
(1)离子晶体中的大离子先在空间尽可能密地堆积起来——球是相切的。
(2)小离子填入堆积球之间的空隙——球不一定是相切的。
3.(2022湖北,10,3分)Be2+和Al3+的电荷与半径之比相近,导致两元素性质相似。

晶体练习题及答案题目一:晶体的基本概念1. 什么是晶体?答案:晶体指的是由周期性重复排列的原子、分子或离子组成的固态物质。
2. 晶体的特点有哪些?答案:晶体具有以下特点:- 具有长程有序性:晶体中的原子、分子或离子按照规则的排列方式组成,形成周期性的结构。
- 具有各向同性或各向异性:晶体的物理性质在不同方向上可能存在差异。
- 具有平面外的周期性:晶体的周期性结构在三维空间中保持着重复。
- 具有清晰的外形:晶体通常具有规则的几何形状,如立方体、六角柱等。
题目二:晶体的结构与分类1. 晶体的结构有哪些类型?答案:晶体的结构可分为以下几种类型:- 离子晶体:由正、负离子通过电子静力作用排列而成。
- 分子晶体:由分子通过分子间相互作用力排列而成。
- 原子晶体:由原子通过原子间相互作用力排列而成。
2. 晶体的分类方法有哪些?答案:晶体可按照成分、结构和形貌等进行分类。
- 成分分类:包括无机晶体和有机晶体两大类。
- 结构分类:根据晶体的结构类型,可分为离子晶体、分子晶体、原子晶体和金属晶体等。
- 形貌分类:按照晶体外形,可分为短柱状、针状、板状、粒状等多种形态。
题目三:晶胞与晶体的晶格1. 什么是晶胞?答案:晶胞是指晶体中最小的具有周期性结构的单位,通常由一组原子、分子或离子组成。
2. 什么是晶格?答案:晶格是指晶体中晶胞之间的无限重复排列形成的空间网格结构。
3. 晶体的晶格类型有哪些?答案:晶体的晶格类型可分为以下几种:- 简单晶格:晶胞中只有一个原子或离子。
- 面心立方晶格:晶胞的各个面心上都有一个原子或离子。
- 体心立方晶格:晶胞的中心位置还有一个原子或离子。
- 其他复杂晶格:如六方密排晶格、菱面体晶格等。
题目四:晶体的缺陷1. 晶体的缺陷有哪些?答案:晶体的缺陷可分为点缺陷、线缺陷和面缺陷三种。
- 点缺陷:包括空位、间隙原子和杂质原子等在晶体中的缺陷点。
- 线缺陷:主要指晶体表面的位错和堆垛层错等。

一、填空题1、晶体按宏观对称操作构成32 个点群。
晶体按按微观对称操作构成230个空间群。
2、晶体按对称性共分为7 晶系。
14种空间点群。
晶体的空间点阵型式有230种。
晶体的宏观独立对称元素有8 种。
3、十四种空间点阵型式中,属于立方晶系的晶体可以抽象出的点阵型式有:简单、体心、面心,正交具有P、C、I、F型式,四方P、I型式,六方P型式,三方P、R型式,单斜P、C型式;三斜P型式。
4、A1(立方面心)A2(立方体心)A3(六方晶胞)A4(立方面心)型密堆积的空间占有率分别为74.05% 68.02% 74.05% 34.01%。
5、NaCl晶体的空间点阵型式为立方面心,结构基元为NaCl。
6、常用晶格能来表示离子键的强弱,用偶极矩来度量分子极性大小。
7、NaCl晶体中负离子的堆积型式为立方面心,正离子填入正八面体空隙中。
8、晶胞的二个要素:一是晶胞大小和型式,二是晶胞中原子位置。
衍射的二要素是:衍射方向和衍射强度。
9、在层状石墨分子形成的二维晶体中,其结构基元应包括2个C,3个C-C。
10、晶体化学定律晶体的结构型式,取决于其结构基元的数量关系,离子大小关系,极化作用。
11、晶体对称性定律:晶体中对称轴的轴次n,并不是任意的,而仅限于n=1,2,3,4,612、CsCl晶体中,两离子的分数坐标为111(0,0,0)(,,)22213、某AB型离子晶体的/0.53+-=,则晶体r r应属于结构。
14、晶面指标是指晶面在三晶轴上的倒易截数的互质整数比。
二、选择题1、估算下列化合物的熔点和硬度的变化次序正确的为(A )(A)KCl<NaCl<MgS<MgO<SiC (B)SiC<KCl<NaCl<MgO<MgS (C)KCl<NaCl<SiC<MgO<MgS (D)NaCl<KCl<MgO<MgS<SiC2、有一AB4型晶体,属立方晶系,每个晶胞中有1个A和4个B,1个A的坐标是(111,,222),4个B的坐标分别是(0,0,0);(11,,022);(11,0,22);(110,,22)。

晶体有关练习题一、选择题1. 晶体是指具有规律排列的_______结构的物质。
a) 分子b) 无机c) 离子d) 聚合物2. 下列哪种晶体结构没有充分利用空间?a) 立方晶系b) 正交晶系c) 六方晶系d) 斜方晶系3. 晶体的硬度与下列哪个因素有关?a) 晶体的密度b) 晶体的折射率c) 晶体的结构d) 晶体的形状4. 斜方晶系中的晶体有几个直角?a) 1b) 2c) 3d) 45. 晶体的莫氏硬度是指晶体在______力作用下产生的硬度。
a) 压缩b) 拉伸c) 剪切d) 弯曲二、填空题1. 晶体中的_______决定了晶体的性质。
2. 晶体的_______决定了晶体的外形。
3. 晶体的_______决定了晶体的硬度。
4. 正交晶系中的晶体有_______个直角。
5. 晶体的_________是指晶体在压缩力作用下产生的硬度。
三、解答题1. 请简要解释晶体的结构和晶体的性质之间的关系。
四、应用题1. 钠氯化合物晶体具有面心立方晶系结构,请给出该晶体的结构示意图,并标明其中的钠离子和氯离子。
2. 请说明金刚石和石墨的晶体结构分别是什么,并解释这两种物质的硬度和导电性的差异。
五、综合题1. 选择正确的答案并解释:盐酸(HCl)的晶体属于哪种结构?a) 二硫化碳b) 雪花石英c) 闪锌矿d) 红磷答案: c) 闪锌矿。
盐酸晶体的结构与闪锌矿相似,都是离子键晶体,具有典型的六方最密堆积结构。
2. 解释为什么钻石比石墨硬,尽管它们的晶体都由碳原子构成。
答案: 钻石的晶体结构是由碳原子通过共价键连接而成的,每个碳原子与其他四个碳原子形成四面体结构。
这种共价键结构赋予了钻石极高的硬度。
而石墨的晶体结构是由平行的碳原子层通过范德华力连接而成的,这种结构层间存在较弱的连接力,因此石墨比较软。
以上是关于晶体的练习题,希望能帮助你加深对晶体结构和性质的理解。
晶体结构练习题一、(2005全国初赛)下图是化学家合成的能实现热电效应的一种晶体的晶胞模型。
图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII族元素,如铁。
按如上结构图写出这种热电晶体的化学式。
给出计算过程。
提示:晶胞的6个面的原子数相同。
设晶体中锑的氧化态为一1,镧的氧化态为+3,问:铁的平均氧化态多大?解析:晶胞里有2个La原子(处于晶胞的顶角和体心); 有8个Fe原子(处于锑形成的八面体的中心);锑八面体是共顶角相连的,平均每个八面体有6/2 = 3个锑原子,晶胞中共有8个八面体,8x3=24个锑原子;即:La2Fe8Sb24。
答案:化学式 LaFe4Sb12 铁的氧化态9/4 = 2.25二、(2004年全国初赛)最近发现,只含镁、喋和碳三种元素的晶体竟然也具有超导性。
鉴于这三种元素都是常见元素,从而引起广泛关注。
该晶体的结构可看作由镁原子和喋原子在一起进行(面心)立方最密堆积(“「),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由喋原子构成,另一种由喋原子和镁原子一起构成,两种八面体的数量比是1:3,碳原子只填充在喋原子构成的八面体空隙中。
(1)画出该新型超导材料的一个晶胞(碳原子用小球,喋原子用大。
球,镁原子用大球)。
(2)写出该新型超导材料的化学式。
(1)(在(面心)立方最密堆积一填隙模型中,八面体空隙与堆积球的比例为1:1,在如图晶胞中,八面体空隙位于体心位置和所有棱的中心位置,它们的比例是1:3,体心位置的八面体由喋原子构成,可填入碳原子,而棱心位置的八面体由2个镁原子和4个喋原子一起构成,不填碳原子。
)(2)MgCNi3(化学式中元素的顺序可不同,但原子数目不能错)。
三、将此凡与苛性钾共熔后,可以生成溶于水的铌酸钾,将其慢慢浓缩可以得到晶体KjNb m O n]・16H2O,同时发现在晶体中存在[Nb m Oj p-离子。
第三章晶体结构与性质单元练习一、单选题(共15道)1.下列过程中不能得到晶体的是A.对饱和NaCl溶液降温所得到的固体H O直接冷却成固态水B.气态2KNO冷却后所得到的固体C.熔融的3D.液态的玻璃冷却后所得到的固体2.下列说法正确的是A.金属导电是因为在外加电场作用下产生自由电子B.在化学反应中金属单质都是还原剂,非金属单质都是氧化剂C.某晶体中若含有阳离子则必含有阴离子D.如果金属失去自由电子,金属晶体将不复存在3.碳纳米管是一种具有特殊结构的一维量子材料,具有许多异常的力学、电学和化学性能。
近些年随着碳纳米管及纳米材料研究的深入,其广阔的应用前景也不断地展现出来。
下列关于纳米管说法错误的是A.具有导电、熔点高等特点B.纳米管是一种新型有机纳米材料C.纳米管可以由石墨烯在特定条件下卷曲而成D.纳米管孔径较大,可以掺杂各种金属原子,体现特殊的催化活性4.设N A为阿伏加德罗常数的值。
下列说法中正确的是()A.28 g晶体硅中含有Si—Si键的个数为2N AB.124 g白磷(P4)晶体中含有P—P键的个数为4N AC.12 g金刚石中含有C—C键的个数为4N AD.SiO2晶体中每摩尔硅原子可与氧原子形成2N A个共价键(Si—O键)5.下列各组物质中,按熔点由高到低的顺序排列正确的是CH>SiH>GeH B.CsCl>KCl>NaClA.444C .Na>Mg>AlD .金刚石>碳化硅>晶体硅6.下列说法正确的是(N A 为阿伏加德罗常数)A .124gP 4含有P—P 键的个数为4N AB .12g 石墨中含有C—C 键的个数为1.5N AC .1mol[Co(NH 3)4Cl 2]Cl 含有σ键的数目为12N AD .60gSiO 2中含Si—O 键的个数为2N A7.下列表示物质分子式的是A .SiO 2B .Na 2SO 4C .C 3N 4D .C 60(足球烯) 8.下列有关比较中,顺序排列错误的是A .微粒的半径:3Al Na Cl ++-<<B .共价晶体的硬度:SiC <晶体硅<金刚石C .物质的沸点:23H O HF AsH >>D .离子晶体的熔点:MgO NaCl KCl >>9.如图所示晶体的硬度比金刚石大,且原子间以单键结合,则有关该晶体的判断正确的是A .该晶体为片层结构B .该晶体化学式可表示为Y 3X 4C .X 的配位数是4D .X 、Y 元素分别位于周期表第ⅢA 、ⅢA 族10.下列关于物质特殊聚集状态的叙述中,错误的是A .在电场存在的情况下,液晶分子沿着电场方向有序排列B .非晶体的内部原子或分子的排列杂乱无章C .液晶最重要的用途是制造液晶显示器D .由纳米粒子构成的纳米陶瓷有极高的硬度,但低温下不具有优良的延展性 11.下列说法不正确...的是 A .利用原子光谱上的特征谱线来鉴定元素,称为光谱分析B .核外电子的概率密度分布被称为电子云C .等离子体和离子液体都具有良好的导电性D .用X 射线衍射摄取石英玻璃和水晶的粉末得到的图谱是相同的12.SiS2的无限长链状结构截取部分如图所示。
专题10 晶体结构一、选择题:1、下列个组物质的晶体中,化学键类型相同,晶体类型也相同的是()A、SO2和SiO2B、CO2和H2OC、NaCl和HClD、CCl4和KCl2、下列晶体中,不属于原子晶体的是()A、干冰B、水晶C、晶体硅D、金刚石3、下列晶体,属于分子晶体,且分子内只含极性键的是()A、I2B、CH3COONaC、CO2D、NH4Cl4、共价键、离子键、分子间作用力都是构成物质微粒间的作用,含有以上两种作用的是()A、SiO2B、干冰C、食盐D、蔗糖5、固体融化时,必须破坏非极性共价键的是()A、冰B、晶体硅C、溴D、二氧化硅6、下列个物质气化或熔化时,所克服的微粒见的作用,属同种类型的是()A、碘和干冰的升华B、二氧化硅和生石灰的熔化C、氯化钠和铁的熔化D、苯和环己烷的蒸发7、下列个组物质中,按熔点由低到高排列正确的是()A、O2、I2、HgB、CO2、KCl、SiO2C、Na、K、RbD、SiC、NaCl、SO28、碳化硅(SiC)的一种晶体有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。
在下列三种晶体(1)金刚石(2)晶体硅(3)碳化硅中,它们的熔点由高到低的顺序是()A、(1)(3)(2)B、(2)(3)(1)C、(3)(1)(2)D、(2)(1)(3)9、某共价化合物C、H、N三种元素,其分子内有4个氮原子,且4个单原子排列成内空的四面体,如同白磷的分子结构,每两个氮原子见都有一个碳原子,已知此分子内碳原子与碳原子之间不直接形成化学键,则该化合物的分子式为:()A、CH4N4B、C6H12N4C、C6H10N4D、C4H8N410、关于晶体的下列说法正确的是()A、在晶体中只要有阴离子就一定有阳离子B、在晶体中只要有阳离子就一定有阴离子C、原子晶体的熔点一定比金属晶体高D、分子晶体的熔点一定比金属晶体的低二、填空题:11、在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有____________(填数字)个碳原子,每个碳原子上任意两个C-C键的夹角都是_____________(填角度)12、右图是石英晶体平面示意图,它实际上是立体的网状结构,其中硅氧原子数之比为____________________。
第二章 晶体的结构习题1.晶面指数为(123)的晶面ABC 是离原点O 最近的晶面,0A ,0B 和0C 分别与基矢1a ,2a 和3a 重合,除0点外,0A ,0B ,和0C 上是否有格点若ABC 面的指数为(234),情况又如何 (答案: 只有A 点是格点; A 、B 、和C 都不是格点)2.在结晶学中,晶胞是按晶体的什么特性选取的3. 在晶体衍射中,为什么不能用可见光4.温度升高时,衍射角如何变化X 光波长变化时,衍射角如何变化(答案: 衍射角变小; 衍射角变大)5.以刚性原子球堆积模型,计算以下各结构的致密度(一个晶胞中刚性原子球占据的体积与晶胞体积的比值称为结构的致密度)分别为:(1)简立方,6π; (2)体心立方,π83 ;(3)面心立方,π62 ; (4)金刚石结构,π163 。
6. 在立方晶胞中,画出(101),(021)晶面。
|7. 六角晶胞的基矢 j a ai a 223+=, j a ai b 223+-=,ck c =。
求其倒格基矢。
(答案: )33(2*j i a a +=π, )33(2*j i a b +-=π,k cc π2*=) 8. 证明以下结构晶面族的面间距:(1) 立方晶系:2/1222][-++=l k h a d hkl ;(2) (2)正交晶系:2/1222])()()[(-++=c lb ka hd hkl ;(3)六角晶系:2/12222])()(34[-+++=c l ahk k h d hkl 。
9.求晶格常数为a 的面心立方和体心立方晶体晶面族)(321h h h 的面间距。
(答案:2/1232123212321])()()[(h h h h h h h h h a -+++-+++-;2/1221213232])()()[(h h h h h h a +++++)。
10. 试证三角晶系的倒格子也属于三角晶系。
…11. 一维原子链是由A ,B 两种原子构成,设A ,B 原子的散射因子分别为A f 和B f ,入射X 射线垂直于原子链,证明(1) 衍射极大条件是λθn a =cos ,a 是晶格常数,θ是衍射束与原子链的夹角.(2) 当n 为奇数,衍射强度比例于2B A f f -. (3) 讨论B A f f = 情况.。
1 在下列有关晶体的叙述错误的是A.离子晶体中,一定存在离子键B.原子晶体中,只存在共价键C.离子晶体中可能存在共价键D.分子晶体中有可能存在离子键2 科学家发现C60分子由60个碳原子构成,它的形状像足球(图C),含有C=C键,因此又叫足球烯。
1991年科学家又发现一种碳的单质——碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图D),图A、图B分别是金刚石和石墨的结构示意图。
图中小黑点或小黑圈均代表碳原子。
(1)金刚石,石墨、足球烯和碳纳米管四种物质互称为同素异形体,它们在物理性质上存在较大的差异,其原因是___________ _____ ;(2)同条件下,足球烯、石墨分别和气体单质F2反应时,化学性质活泼性的比较为足球烯比石墨(填“活泼”、“一样活泼”、“更不活泼”)理由是:;(3)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决H2的贮存问题,上述四种碳单质中有可能成为贮氢材料的是:_______ _______。
(4)下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是⑴⑵⑶⑷A.⑴B.⑵C.⑶D.(4)3 某晶体最小的结构单元,其化学式是A .z xy 3B .x 2y 2z 1C .x 3yzD .x 2y 3z4 金属能导电的原因是A. 金属晶体中金属阳离子与自由电子间的相互作用较弱B .金属晶体中的自由电子在外加电场作用下可发生定向移动C .金属晶体中的金属阳离子在外加电场作用下可发生定向移动D .金属晶体在外加电场作用下可失去电子5 某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。
阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是A 、1∶8B 、1∶4C 、1∶2D 、1∶16 石墨是层状晶体,每一层内,碳原子排列成正六边形,许多个正六边形排列成平面网状结构。