高效液相色谱法测定谷物及其制品中赭曲霉毒素A
- 格式:doc
- 大小:24.00 KB
- 文档页数:3
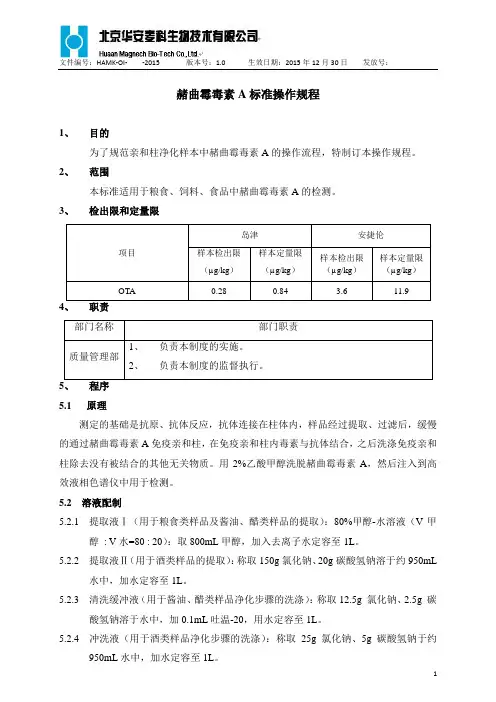
赭曲霉毒素A标准操作规程1、目的为了规范亲和柱净化样本中赭曲霉毒素A的操作流程,特制订本操作规程。
2、范围本标准适用于粮食、饲料、食品中赭曲霉毒素A的检测。
3、检出限和定量限项目岛津安捷伦样本检出限(µg/kg)样本定量限(µg/kg)样本检出限(µg/kg)样本定量限(µg/kg)OTA 0.28 0.84 3.6 11.9 4、职责部门名称部门职责质量管理部1、负责本制度的实施。
2、负责本制度的监督执行。
5、程序5.1 原理测定的基础是抗原、抗体反应,抗体连接在柱体内,样品经过提取、过滤后,缓慢的通过赭曲霉毒素A免疫亲和柱,在免疫亲和柱内毒素与抗体结合,之后洗涤免疫亲和柱除去没有被结合的其他无关物质。
用2%乙酸甲醇洗脱赭曲霉毒素A,然后注入到高效液相色谱仪中用于检测。
5.2 溶液配制5.2.1 提取液Ⅰ(用于粮食类样品及酱油、醋类样品的提取):80%甲醇-水溶液(V甲醇: V水=80 : 20):取800mL甲醇,加入去离子水定容至1L。
5.2.2 提取液Ⅱ(用于酒类样品的提取):称取150g氯化钠、20g碳酸氢钠溶于约950mL水中,加水定容至1L。
5.2.3 清洗缓冲液(用于酱油、醋类样品净化步骤的洗涤):称取12.5g 氯化钠、2.5g 碳酸氢钠溶于水中,加0.1mL吐温-20,用水定容至1L。
5.2.4 冲洗液(用于酒类样品净化步骤的洗涤):称取25g 氯化钠、5g碳酸氢钠于约950mL水中,加水定容至1L。
5.2.5 洗脱液(甲醇: 乙酸=49 : 1):取1ml乙酸加入到49ml甲醇中混匀即可。
5.2.6 赭曲霉毒素A标准工作液:用色谱级甲醇将储备工作液分别稀释到20 ng/ml、10ng/ml、5ng/ml、2 ng/ml、1 ng/ml。
5.3 样品前处理5.3.1 粮食类----20g±0.01g样品(固体样品需粉碎,并过2mm分样筛),5g氯化钠于三角瓶中,加入100mL的提取液Ⅰ(见5.2.1);----高速均质(≥10,000r/min)1min(或用摇床200r/min~300r/min剧烈振荡20min);----用快速定性滤纸过滤,收集滤液;----取10mL滤液加入40mL去离子水稀释,混匀;----用微纤维滤纸过滤,并收集滤液作为上样液;----取25mL上样液过免疫亲和柱净化。

Apr. 2024 CHINA FOOD SAFETY169食品科技粮食中赭曲霉素A 检验方法的研究进展姜 雪(松原市粮油质量检验监测站,吉林松原 138000)摘 要:赭曲霉素A (Ochratoxin A ,OTA )是青霉菌属与曲霉菌属共同产生的具有7种结构的二级代谢产物,在小麦、玉米、大米及大麦等粮食中广泛存在。
赭曲霉素A 可致畸,具有肾毒性、神经毒性、免疫毒性等危害,可引起动物肾脏、肝脏损伤、坏死以及肠黏膜损坏。
本文综述了粮食中赭曲霉素A 的主要检验方法,重点分析与讨论了不同检验方法优缺点,以期为更加准确、高效、便捷的检测粮食中赭曲霉素A 提供依据。
关键词:赭曲霉素A ;理化性质;检验方法Research Progress on the Detection Method ofOchratoxin A in GrainJIANG Xue(Songyuan City Grain and Oil Quality Inspection and Monitoring Station, Songyuan 138000, China)Abstract: Ochratoxin A is a secondary metabolite with seven structures produced by Penicillium and Aspergillus. It is widely found in wheat, corn, rice and barley. Ochratoxin A can cause teratogenicity, nephrotoxicity, neurotoxicity, immunotoxicity and other hazards, which can cause kidney, liver damage, necrosis and intestinal mucosal damage in animals. In this paper, the main detection methods of ochratoxin A in grain were reviewed, and the advantages and disadvantages of different detection methods were analyzed and discussed in order to provide a basis for more accurate, efficient and convenient detection of ochratoxin A in grain.Keywords: ochratoxin A; physicochemical properties; testing method1 赫曲霉毒素A 理化性质赫曲霉毒素(Ochratoxin A ,OTA )是青霉菌属与曲霉菌属共同产生的具有7种结构的二级代谢产物,7种曲霉和6种青霉菌均能产生赭曲霉毒素。

JOURNAL OF INSPECTION AND QUARANTINE 检验检疫学刊Vol.30No.22020年第2期1前言赭曲霉毒素是继黄曲霉毒素后又一种引起世界广泛关注的霉菌毒素,主要由多种生长在粮谷类农作物上的曲霉和青霉产生。
赭曲霉毒素主要侵害动物肝脏与肾脏,可引起肾脏损伤,大量的毒素可引起动物的肠黏膜炎症和坏死[1]。
其中,毒性最大的是赭曲霉毒素A,GB 2762—2017《食品中污染物限量》[2]中规定,谷物制品中赭曲霉毒素A 的最大限量为5.0μg/kg。
2仪器尧材料与方法2.1仪器高效液相色谱仪(HPLC 美国Waters),配荧光检测器。
2.2材料赭曲霉毒素A 免疫亲和柱:Agela,产品编号:BAC10005;甲醇(CH 3OH):色谱纯(默克);乙腈(CH 3CN):色谱纯(默克);冰乙酸(C 2H 4O 2):优级纯(天津大茂化学试剂有限公司);赭曲霉毒素A 标准物质[3]:GBW(E)100303,浓度1.9μg/mL;赭曲霉毒素A 标准储备液:用甲醇-乙腈(50+50)溶液将标物稀释10倍,配制成浓度0.19μg/mL 的标准储备液,4℃冰箱保存;提取液:乙腈+水(60+40);真菌毒素清洗缓冲液:称取25.0g 氯化钠、5.0g 碳酸氢钠溶于水中,加入0.1mL 吐温20,用水稀释至1L;磷酸盐缓冲液:称取8.0g 氯化钠、1.2g 磷酸氢钠、0.2g 磷酸二氢钾、0.2g 氯化钾溶解于约990mL 水中,用浓盐酸调节pH 至7.0,用水稀释至1L。
2.3方法2.3.1色谱条件液相色谱柱C18柱(1.7μm×2.1mm×50mm);检测器:荧光检测器(大流通池),激发波长333nm,发射波长460nm;流动相:水(含2%冰乙酸):乙腈=54∶46;第一作者E-mail:****************收稿日期:2020-02-15HPLC 法测定谷物食品中赭曲霉毒素A 检出限、精密度、准确度试验郝艳萍张胜利冯骁骄(晋中市综合检验检测中心山西晋中030600)摘要为了解晋中市综合检验检测中心是否具备高效液相色谱(HPLC )法开展谷物食品中赭曲霉毒素A 的测定检验能力,本文对HPLC 法测定谷物食品中赭曲霉毒素A 的检出限、精密度、准确度进行评价。


免疫亲和层析净化液相色谱法检测谷物中赭曲霉毒素A作者:李建忠张舸来源:《粮食科技与经济》2018年第06期【摘要】采用免疫亲和层析净化液相色谱法测定多种谷物(小麦、玉米和大米)样品中的赭曲霉毒素A。
提取液提取试样中的赭曲霉毒素A,经免疫亲和柱净化后,采用高效液相色谱法荧光检测器测定,外标法定量。
结果表明,不同粮食中赭曲霉毒素A在0.5~50.0ng/mL浓度范围内呈良好的线性关系,相关系数(r)>0.999;样品在0.3μg/kg、5.0μg/kg和10.0μg/kg 三个添加水平下的加回收率为84.4%~96.7%;方法检出限为0.3μg/kg,重复性的相对标准偏差为1.03%~3.17%。
【关键词】免疫亲和;层析净化;液相色谱法;赭曲霉毒素A赭曲霉毒素包括A、B、C、D四种结构类似的化合物,其中以赭曲霉毒素A(OTA)毒性最强、分布最广、对人类和动物影响最大,广泛分布于谷物、饲料及动物体内,对食品污染的范围广泛。
毒理学研究表明,赭曲霉毒素A具有很强的肝脏毒性和肾脏毒性,并有致畸、致突变和致癌作用,许多国家对其制定了严格的限量标准,国际癌症研究机构将其定为2B类致癌物,所以控制谷物中OTA的含量至关重要。
国家标准GB 2761规定谷物及其研磨加工品中OTA限量为5.0μg/kg。
采用国标方法GB5009.96-2016中免疫亲和层析净化液相色谱法,通过加标实验测定阴性样品中OTA含量,采用的方法和所得数据为粮油质检部门提供参考。
1材料与方法1.1材料新收获玉米样品,经国标方法检测后确定为阴性样品。
锤式旋风磨粉碎,85%过孔径为1mm试验筛,制备成玉米粉样品。
1.2主要仪器与试剂LC-2010AHT液相色谱仪,配荧光检测器,日本岛津公司;HQBTWT93不锈钢均质器,北京中检维康生物技术有限公司;N-EVAPl2氮吹仪;CP512百分之一电子天平,上海奥豪斯仪器有限公司;OTA标准物质,浓度均为50.0μg/mL,有国家标准物质证书;甲醇、乙腈、冰乙酸:色谱纯;10倍PBS浓缩液;水为GB/T6682规定的一级水。

《粮油检测粮食中赭曲霉毒素A的测定超高效液相色谱方法》行业标准制定编制说明赭曲霉毒素A主要由曲霉属的赭曲霉(Aspergillus ochraceus)、洋葱曲霉(A.alliaceus)、硫色曲霉(A.sulphureus)、蜂蜜曲霉(A.melleus)、孔曲霉(A.ostianus)、佩特曲霉(A.petrakii)和菌核曲霉(A.sclerotiorum)、黑曲霉(A. niger)等, 青霉属的纯绿青霉(Penicillium verrucosum)、震颤青霉(Penicillium palitans)、团青霉(Penicillium commune)、变紫青霉(Penicillium purpursescens)、圆弧青霉(Penicillium cyclopium)等产生,对人、动物具有致病、致癌作用,被WHO的国际癌症研究组织列为2B级可疑致癌物质。
易污染玉米、大麦、小麦、燕麦、高粱、绿咖啡豆、豌豆、豆类、花生、面包、橄榄、啤酒、饲料、肉、奶酪、奶粉、干草、葡萄干、坚果。
我国食品安全国家标准《GB2761-2011 食品中真菌毒素限量》中规定谷物及豆类制品中赭曲霉毒素A限量为5 μg/kg。
目前报道用于检测赭曲霉毒素A的分析方法有酶联免疫法、免疫胶体金试纸法、生物传感器法、高效液相色谱法、液相色谱质谱联用法、间接竞争免疫分辨荧光免疫分析、薄层色谱法等。
薄层色谱法由于操作复杂,目前应用较少;胶体金和酶联免疫方法用于快速筛查;普通液相色谱方法目前应用较多,但分析速度较慢,耗费溶剂较多,成本增加,环保性不足;液质联用仪检测需要高端的质谱仪。
当前急需建立一种更加灵敏、高效、低溶剂量的赭曲霉毒素A微量快速定量方法。
为了满足当前我国粮食绿色检测、监测定量分析的需要,通过查阅文献,根据范德米特(van Deemeter)方程理论,结合免疫亲和净化手段,基于UPLC分离技术,建立了一种进样量小、分离度高、快速准确、环保的赭曲霉毒素A定量分析方法。

谷类中赭曲霉毒素A的快速检测是由曲霉菌和青霉属菌株产生的一种有毒的真菌次级代谢产物,广泛存在于谷物及谷物产品、香料和咖啡豆等产品中。
赭曲霉毒素A具有很强的肝脏和肾脏毒性,并有致畸、致突变和致癌作用,严峻危害人类健康。
赭曲霉毒素普通用薄层色谱、高效液相色谱法检测,但因其操作繁杂、费用昂贵而影响实际应用。
[采样地点]农贸市场、大型超市等。
[样品]预包装、散装形式的大米、豆类等食品。
[检测原理]用法谷类中赭曲霉毒素的迅速检测(ELlSA法)。
此办法的原理是采纳间接竞争ELISA办法,在酶标板微孔条上预包被赭曲霉毒素抗原,样本中赭曲霉毒素和此抗原竞争抗赭曲霉毒素的抗体(抗试剂),加入酶标二抗(酶标物)与抗赭曲霉毒素抗体结合,再经(3,3',,5,5'-四甲基联苯胺)(TMB)底物显色,样本吸光值与其含有的赭曲霉毒素成负相关,与标准品比较再乘以其对应的稀释倍数,即可得出样品中赭曲霉毒素的含量。
[试验材料与设备](1)NCD- IOOA型多功能农产品平安分析仪(上海瑞鑫科技仪器有限公司)。
(2)赭曲霉毒素试剂盒(含酶标板、3倍标准品×5瓶、赭曲霉毒素抗试剂、赭曲霉毒素酶标物、底物液A液、底物液B液、终止液、浓缩洗涤液、、、去离子水)。
(3)微量移液器单道 20~200μL,200 ~1000μL。
(4)电子天平等。
[试验办法](1)溶液的配制分离配制洗涤工作液、样品提取液、5个不同浓度的标准液等。
(2)样本前处理粉碎并取5 g有代表性的样品,加入25 mL样品提取液,同时加入2mL。
强烈振荡5min ;于5000r/min离心5min ;取中间层用蒸馏水成倍稀释,即一份中间层清液加一份蒸馏水;取稀释后液体待测。
(3)加标准品/样本加标准品/样本50uL到对应的微孔中,然后加赭曲霉毒素抗试剂50uL/孔,轻轻振荡混匀,用盖板膜盖板后置25℃避光环境中反应 30min。
(4)洗板当心揭开盖板膜,将孔内液体甩干,用洗涤工作液300μL/孔,充分洗涤5次,每次间隔30s,用吸水纸拍干(拍干后未被清除的气泡可用未用法过的枪头戳破)。

T logy科技分析与检测赭曲霉毒素(ochratoxin)是一种天然存在的毒性污染物质,有A、B、C与D 4种,其中赭曲霉毒素A (ochratoxin A,简称OTA)毒性最大[1]。
赭曲霉毒素广泛存在于粮食、豆类、咖啡豆和饲料等,在存储及运输方式不当时,食品发生霉变可产生。
OTA 对动物及人类的免疫系统有显著性的破坏作用,对动物及人类肾脏、肝脏等具有致癌、致畸等作用[2-3],所以食品中OTA含量检测至关重要。
目前,我国对于豆类及其制品中赭曲霉毒素A的定量检测方法主要包括液相色谱(HPLC)[4]和液相色谱串联质谱(LC-MS/MS)法[5]。
HPLC法采用荧光检测器检测,准确性高。
LC-MS/MS法具有更高的灵敏度和高效性,但实验前处理方法对检测结果的干扰较大。
常用的净化方法有免疫亲和柱净化[6]、离子交换固相萃取柱净化[7]、酶联免疫吸附法[8]等。
此外,目前文献中对于豆类及其制品中赭曲霉毒素A测定技术的研究较少。
本研究基于LC-MS/MS检测技术,在现有检测方法基础上对豆类及其制品的赭曲霉毒素A提取及测定方法进行优化,研究成果可为实验室检测赭曲霉毒素A提供可靠依据。
1 实验部分1.1 仪器、试剂与材料 Agilent1290-6470液相色谱-三重四级杆串联质谱仪(美国,安捷伦公司);BAS224S-CW万分之一天平(赛多利斯);KQ-400KDE高功率数控超声波清洗器(昆山市超声仪器有限公司);TGL-18高速离心机(上海安亭科学仪器厂);RE-2000B旋转蒸发仪(上海亚荣生化仪器厂);SHB-IIIA循环水式多用真空泵(上海豫康科教仪器设备有限公司);AutoVapS60氮吹浓缩仪(美国ATR)。
赭曲霉毒素A标准品(10 μg/L,Pribolab Pte Ltd),氯化钠,甲醇(AR级,国药集团);甲醇,乙腈,甲酸(HPLC级,美国Honeywell公司);免疫亲和柱(Romer Labs)。

分析检测高效液相色谱法测定小麦粉中赭曲霉毒素A的不确定度评定唐 莉(镇江市食品药品监督检验中心,江苏镇江 212000)摘 要:按照《食品安全国家标准食品中赭曲霉毒素A的测定》(GB 5009.96—2016)检测小麦粉中赭曲霉毒素A的含量,并建立不确定度分析的数学模型,对检验结果的不确定度来源进行分析及量化评定。
分析结果显示,标准曲线拟合和标准溶液的配制引入的不确定度最大。
小麦粉中赭曲霉毒素A的含量为4.62 μg·kg-1时,其扩展不确定度为0.31 μg·kg-1,k=2。
关键词:赭曲霉毒素A;不确定度;小麦粉;高效液相色谱法Evaluation of Uncertainty in the Determination of OchratoxinA in Wheat Flour by HPLCTANG Li(Zhenjiang Food and Drug Supervision and Inspection Center, Zhenjiang 212000, China) Abstract: According to GB 5009.96—2016, the content of ochratoxin A in wheat flour was detected, and a mathematical model for uncertainty analysis was established to analyze and quantitatively evaluate the sources of uncertainty in the test results. The analysis results show that the fitting of standard curves and the preparation of standard solutions introduce the greatest uncertainty. The content of ochratoxin A in wheat flour is 4.62 μg·kg-1, its expanded uncertainty is 0.31 μg·kg-1, k=2.Keywords: ochratoxin A; uncertainty; wheat flour; high performance liquid chromatography赭曲霉毒素A(Ochratoxin A,OTA)是一种分布广,与人类健康密切相关的真菌毒素,主要表现为慢性毒性,且具有很强的肝脏和肾脏毒性,并有致畸、致癌性,已受到全世界的广泛关注。

高效液相色谱法测定粮食中赭曲霉毒素A含量的不确定度评定邵亮亮;赵美凤;房芳;宁晖;杜京霖;张谷平【摘要】对高效液相色谱法测定粮食中赭曲霉毒素A含量的测量不确定度进行评定.建立数学模型,分析不确定度来源,计算不确定度分量,并合成测量结果的不确定度.本次评定结果表明:赭曲霉毒素A测量结果的不确定度主要来自样品不均匀性、浓度、体积、称量、提取效率,重复性6个因素,其中浓度因素引入的不确定度分量贡献最大,其次是体积因素,而由试样称量因素引入的不确定度分量最小.高效液相色谱法测定粮食中赭曲霉毒素A的含量为4.48 μg/kg时,其扩展不确定度为0.41μg/kg,k=2.【期刊名称】《粮食与食品工业》【年(卷),期】2019(026)001【总页数】8页(P60-67)【关键词】不确定度;赭曲霉毒素A;高效液相色谱法;粮食【作者】邵亮亮;赵美凤;房芳;宁晖;杜京霖;张谷平【作者单位】浙江省粮油产品质量检验中心杭州 310012;浙江省粮油产品质量检验中心杭州 310012;浙江省粮油产品质量检验中心杭州 310012;浙江省粮油产品质量检验中心杭州 310012;浙江省粮油产品质量检验中心杭州 310012;浙江省粮油产品质量检验中心杭州 310012【正文语种】中文【中图分类】TS207赭曲霉毒素A(Ochratoxin A,OTA),是由多种曲霉属和青霉属真菌产生的一种次级代谢产物[1]结构式见图1,主要污染粮谷类农作物,在多种粮食及制品中都检出过OTA。
人和动物进食被OTA污染的食物后,会导致体内OTA的蓄积,而且代谢缓慢[2]。
OTA主要危及人和动物肾脏,具有高度的致癌、致畸、致突变的作用[3],并被认为与人类的巴尔干肾病和泌尿系统肿瘤有关[6],国际癌症研究机构已将其定为2B类致癌物。
因此,粮食中的OTA检测已经引起国内外的高度关注。
联合国粮农组织和世界卫生组织建议OTA的周摄入量不超过100 ng/kg体重[7];我国目前还没有关于人群OTA膳食摄入量的评价研究,但食品安全国家标准规定了谷物等粮食及制品中OTA的限量标准为5 μg/kg[8],同时指明了其方法标准为GB 5009.96,其仲裁法为免疫亲和层析净化高效液相色谱法[9]。

超高效液相色谱-串联质谱法测定全麦粉中的赭曲霉毒素A唐德红,张 季,张冰雪,任 伟,张丹丹,刘 冲*(遵义市产品质量检验检测院,贵州遵义 563000)摘 要:目的:建立超高效液相色谱-串联质谱法测定全麦粉中赭曲霉毒素A的含量。
方法:全麦粉样品经甲醇-水(60∶40,V∶V)提取,磷酸盐缓冲溶液稀释,赭曲霉毒素A免疫亲和柱净化,超高效液相色谱-串联质谱测定分析,内标法定量。
结果:赭曲霉毒素A在0.475~9.500 ng·mL-1具有良好的线性关系(R2=0.999 9),3个加标水平下的平均回收率为85.62%~99.42%,相对标准偏差为1.92%~4.66%,检出限为0.68 μg·kg-1、定量限为2.27 μg·kg-1。
结论:该方法便捷、稳定、灵敏度高、准确度好,可用于快速分析全麦粉中赭曲霉毒素A的含量。
关键词:全麦粉;赭曲霉毒素A;超高效液相色谱-串联质谱Determination of Ochratoxin A in Whole Wheat Flour by Ultra Performance Liquid Chromatography-Tandem MassSpectrometryTANG Dehong, ZHANG Ji, ZHANG Bingxue, REN Wei, ZHANG Dandan, LIU Chong*(Product Quality Inspection and Testing Institute in Zunyi, Zunyi 563000, China) Abstract: Objective: To establish an ultra high performance liquid chromatography-tandem mass spectrometry method for the determination of ochratoxin A in whole wheat flour. Method: Whole wheat flour samples were extracted with methanol water (60∶40, V∶V), diluted with phosphate buffer solution, purified with ochratoxin A immunoaffinity column, analyzed by ultra-high performance liquid chromatography tandem mass spectrometry, and quantified by internal standard method. Result: Ochratoxin A ranges from 0.475 ng·mL-1 to 9.500 ng·mL-1 has a good linear relationship (R2=0.999 9). The recovery rates at three spiked levels were 85.62%~99.42%,the relative standard deviation was 1.92%~4.66%, and the detection limit was 0.68 μg·kg-1, with a quantification limit of 2.27 μg·kg-1. Conclusion: This method is convenient, stable, sensitive, and accurate, and can be used for rapid analysis of ochratoxin A content in whole wheat flour.Keywords: whole wheat flour; ochratoxin A; ultra performance liquid chromatography-tandem mass spectrometry赭曲霉毒素A(Ochratoxin A,OTA)是食物中最常见的霉菌毒素之一[1],是曲霉属和青霉属的真菌形成的次级代谢产物[2-4],广泛存在于各种食物中。
高效液相色谱法测定谷物及其制品中赭曲霉毒素A摘要针对谷物及其制品可能污染的霉菌毒素——赭曲霉毒素A,用免疫亲和柱净化高效液相色谱法进行了验证。
关键词赭曲霉毒素A;高效液相色谱法;谷物及其制品;OchraTest免疫亲和柱赭曲霉毒素A是曲霉属和青霉属一些菌种的有毒产物,动物毒性试验表明,赭曲霉毒素A具有免疫抑制毒性、神经毒性、致畸性及致癌性。
1993年,国际癌症研究中心已将赭曲霉毒素A列为可能的人类致癌物。
被赭曲霉毒素A污染的谷物及其制品是人体内赭曲霉毒素A的主要来源,通过对谷物及其制品中赭曲霉毒素A的检测可以估计人体每天摄入量。
目前国际上检测赭曲霉毒素A的方法有薄层层析法、酶联免疫吸附法及高效液相色谱法等,高效液相色谱法是最常用的方法。
本文验证了用高效液相色谱法测定谷物及其制品中赭曲霉毒素A含量的方法,现报告如下。
1材料与方法1.1试验原理将试样与提取溶液混合后高速均质、过滤得到提取液,提取液经稀释后加入到装有赭曲霉毒素A专一化抗体的免疫亲和柱中,使样品中的赭曲霉毒素A与抗体结合。
淋洗除杂质后,以甲醇洗脱溶液使赭曲霉毒素A与抗体分离洗脱,供液相色谱定性定量测定。
1.2材料与设备1.2.1材料。
色谱纯已腈、纯水、乙酸、磷酸盐缓冲液、色谱纯甲醇、折叠滤纸、微孔玻璃纤维滤纸、赭曲霉毒素A标准品。
1.2.2设备。
OchraTest免疫亲和柱,Agilent1100液相色谱仪(带有荧光检测器),高速均质机,手动玻璃注射器泵流架,电子天平(感量1g),谷物粉碎机。
1.3样品测定方法1.3.1提取。
称取50g磨细的样品,置于搅拌杯中,加入100 mL乙腈水溶液(乙腈∶水=60∶40),盖上搅拌杯的盖子,高速搅拌1min,取下盖子,将提取物倒入槽纹滤纸上,滤液收集于干净的容器中。
1.3.2提取物的稀释。
移取10mL上步的滤液,置于干净的容器中,用40mL纯水将滤液稀释、混匀,将上步稀释液通过玻璃微纤维滤纸过滤器,滤液收集于玻璃注射器筒中。
食品安全国家标准食品中赭曲霉毒素A的测定1 范围本标准规定了食品中赭曲霉毒素A的测定方法。
本标准第一法适用于粮食和粮食制品、酒类、酱油、醋、酱及酱制品中赭曲霉毒素A含量的测定,第二法适用于小麦、玉米和稻谷中赭曲霉毒素A的测定,第三法适用于粮食和粮食制品、酒类、酱油、醋、酱及酱制品中赭曲霉毒素A含量的测定,第四法适用于小麦、玉米和大豆中赭曲霉毒素A的测定。
第五法适用于玉米、小麦、大麦、大米、大豆及其的制品中赭曲霉毒素A的测定。
第一法免疫亲和层析净化液相色谱法2 原理及依据用提取液提取试样中的赭曲霉毒素A,经免疫亲和柱净化后,用高效液相色谱荧光检测器测定,外标法定量。
本法以GB/T 23502-2009 《食品中赭曲霉毒素A的测定免疫亲和层析净化高效色谱方法》为基础,补充添加SN/T 1940-2007 《进出口食品中赭曲霉毒素A的测定方法》、GB/T 25220-2010 《粮油检验粮食中赭曲霉毒素A的测定高效液相色谱法和荧光光度法》和SN/T 1746-2006《进出口大豆、油菜籽和食用植物油中赭曲霉毒素A的检验方法》。
3 试剂和材料除非另有说明,本方法所用试剂均为分析纯,实验用水为GB/T 6682规定的二级水。
3.1 试剂3.1.1 甲醇(CH3OH):色谱纯。
3.1.2 乙腈(CH3CN):色谱纯。
3.1.3 冰乙酸(C2H4O2):色谱纯。
3.1.4 氯化钠(NaCl):分析纯。
3.1.5 聚乙二醇(HOCH2(CH2O·CH2)nCH2OH):分析纯。
3.1.6 吐温-20(Tween-20):分析纯。
3.1.7 碳酸氢钠;分析纯。
3.1.8 磷酸二氢钾:分析纯。
3.1.9 浓盐酸。
3.2 试剂配制3.2.1 提取液1:甲醇+水(80+20),80份甲醇和20份水混合而成。
3.2.2 提取液2:称取150 g氯化钠、20 g碳酸氢钠溶于约950 mL水中,加水定容至1 L。
3.2.3 提取液3:乙腈+水(60:40),60份乙腈和40份水混合而成。
江苏农业学报(Jiangsu J.of Agr.Sci.),2016,32(6):1416~1420h ttp://w w w.js n y x b.c o m孙 月,赵晋铭,贾雯晴,等.固相萃取⁃高效液相色谱串联质谱法检测粮食中赭曲霉毒素A[J].江苏农业学报,2016,32(6):1416⁃1420.doi:10.3969/j.issn.1000⁃4440.2016.06.034固相萃取⁃高效液相色谱串联质谱法检测粮食中赭曲霉毒素A孙 月1, 赵晋铭2, 贾雯晴3, 田中伟4, 董 飞5(1.南京农业大学国家肉品质量安全控制工程技术研究中心,江苏南京210095;2.南京农业大学国家大豆改良中心/作物遗传与种质创新国家重点实验室/南京农业大学农学院,江苏南京210095;3.南京农业大学科学研究院,江苏南京210095;4.南京农业大学农学院/农业部作物生理生态与生产管理重点实验室,江苏南京210095;5.江苏省农业科学院食品质量安全与检测研究所,江苏南京210014)收稿日期:2016⁃08⁃30基金项目:中央高校基本科研业务费专项资金项目(KJQN201632㊁KJSY201618)作者简介:孙 月(1989⁃),女,安徽蚌埠人,硕士研究生,主要从事农产品质量安全分析检测研究㊂(Tel)010⁃59199383;(E⁃mail)sunyuenjau@ 摘要: 为了测定多种粮食样品中的赭曲霉毒素A(Ochratoxins A,OTA),建立了一种固相萃取⁃高效液相色谱串联质谱的检测方法㊂小麦㊁玉米㊁大豆和大米样品经乙腈⁃水(体积比80∶20)提取后,采用氨基固相萃取柱进行富集和洗脱,高效液相色谱串联质谱法进行检测㊂结果表明,不同粮食中赭曲霉毒素A 在0.5~10.0μg /kg 线性关系良好,相关系数(r )为0.999,定量限和检出限分别为0.50μg /kg 和0.25μg /kg,日内和日间精密度的相对标准偏差(RSD )分别为1.71%~3.53%和0.69%~1.58%,重复性的相对标准偏差为3.72%~5.56%,加标回收率为83.2%~98.6%,相对标准偏差为2.26%~6.25%㊂关键词: 固相萃取;高效液相色谱串联质谱法;赭曲霉毒素A;粮食中图分类号: TS207.5 文献标识码: A 文章编号: 1000⁃4440(2016)06⁃1416⁃05Application of solid⁃phase extraction to determination of ochratoxin A ingrains by high performance liquid chromatography⁃tandem mass spec⁃trometrySUN Yue 1, ZHAO Jin⁃ming 2, JIA Wen⁃qing 3, TIAN Zhong⁃wei 4, DONG Fei 5(1.Key Laboratory of National Meat Quality and Safety Control Engineering Research Center ,Nanjing Agricultural University ,Nanjing 210095,China ;2.National Center of Soybean Improvement /State Key Laboratory of Crop Genetics and Germplasm Enhancement /College of Agriculture ,Nanjing Agricultur⁃al University ,Nanjing 210095,China ;3.The Academy of Science ,Nanjing Agricultural University ,Nanjing 210095,China ;4.Agronomy College of Nanjing Agricultural University /Key Laboratory of Crop Physiology Ecology and Production Management of Ministry of Agriculture ,Nanjing 210095,Chi⁃na ;5.Institute of Food Quality and Safety ,Jiangsu Academy of Agricultural Sciences ,Nanjing 210014,China ) Abstract : In order to determine the ochratoxin A (OTA)in different grains,a method was developed for the deter⁃mination of OTA in wheat,corn,soybean,and rice by solid⁃phase extraction (SPE)⁃high performance liquid chromatogra⁃phy⁃tandem mass spectrometry (LC⁃MS /MS).After extracted by acetonitrile⁃water (80∶20,V /V)and purified with NH 2⁃SPE column,OTA was detected by HPLC⁃MS /MS.The results showed that the linear correlation coefficient (r )wasgreater than 0.999in the range of 0.5⁃10.0μg /kg.The limits of quantitation (LOQ )and detection (LOD )were 0.50μg /kgand 0.25μg /kg,and the relative standard deviation (RSD )of repeatability was ranged from 3.72%to 5.56%.The RSD of in⁃tra⁃day and inter⁃day precision were ranged from 1.71%to3.53%and 0.69%to 1.58%,respectively.At different spiked6. All Rights Reserved.levels,the recoveries were ranged from83.2%to98.6%,and the RSD was ranged from2.26%to6.25%.Key words: solid⁃phase extraction;HPLC⁃MS/MS;ochratoxin A;grain 赭曲霉毒素(Ochratoxins)是由曲霉属和青霉属等部分产毒菌株产生的一组结构类似的有毒代谢物质㊂赭曲霉毒素包括7种结构类似的化合物,其中以赭曲霉毒素A(Ochratoxins A,OTA)毒性最强,分布最广,各种谷物和豆类受赭曲霉毒素A污染较为严重[1⁃2]㊂赭曲霉毒素A可溶于极性有机溶剂和稀碳酸氢钠溶液,微溶于水,赭曲霉毒素A的化学名称为7⁃(L⁃β⁃苯基丙氨基⁃羰基)⁃羧基⁃5⁃氯代⁃8⁃羟基⁃3,4⁃二氢化⁃3R⁃甲基异氧杂奈邻酮(香豆素),分子式为C2OH18ClNO6,化学结构中含有一个羧基基团㊂动物毒性试验结果表明,赭曲霉毒素A具有免疫抑制毒性㊁神经毒性㊁致畸性及致癌性[3]㊂1993年,国际癌症研究中心已将赭曲霉毒素A列为可能的人类致癌物[4]㊂世界各国均重视对赭曲霉毒素A的检测和控制,制定了相关的限量标准㊂中国在2011年最新颁布的国家食品安全标准‘食品中真菌毒素限量“规定了谷物及其制品中赭曲霉毒素A 的最高限量值为5μg/kg[5]㊂目前,国内外对于粮食中赭曲霉毒素A检测的前处理方法主要是免疫亲和层析柱法[6⁃12]㊁多功能净化柱法[13⁃14]和固相萃取法[3,8,15]㊂免疫亲和层析柱法因其选择性高,特异性强,样品回收率较高,准确度高,已被国内外列为标准赭曲霉毒素A检测净化技术[16],但缺点是成本高㊂目前国内尚无针对粮食中赭曲霉毒素A的多功能净化柱,需依赖进口,价格较为昂贵㊂固相萃取法是一种相对廉价而有效的方法,目前国内外也有将其纳为检测标准技术的例子[17⁃18],但大多存在着前处理复杂,能处理的粮食种类有限等问题㊂因此迫切需要建立一种适用于多种粮食㊁灵敏㊁简单和成本低廉的检测方法㊂本研究根据赭曲霉毒素A化学结构,采用氨基固相萃取柱富集净化,优化洗脱试剂组成,改进流动相组成并利用高效液相色谱串联质谱法进行分析,以期建立一种可用于小麦㊁玉米㊁大豆和大米等大量粮食样品中赭曲霉毒素A的定量检测方法㊂1 材料与方法1.1 仪器与试剂主要仪器有高效液相色谱LC20A(日本岛津公司产品)㊁质谱AB6500(美国AB公司产品)㊁氨基固相萃取柱(500mg,6ml,上海安谱公司产品)㊁0.22μm有机滤膜(天津津腾公司产品)㊁固相萃取仪Vi⁃siprep24TM DL(美国Supelco公司产品)㊁电子天平YP30002(上海佑科仪器公司产品)㊁电子天平BT125D(德国Sartorius公司产品)㊁离心机5810R (德国Eppendorf公司产品)㊁氮吹仪N⁃WVAP TM112 (美国Organomation公司产品)㊂赭曲霉毒素A标准品,纯度≥99%,Romer国际贸易(北京)有限公司产品;乙腈,分析醇,天津科密欧化学试剂有限公司产品;甲醇,色谱纯,德国Mer⁃ck公司产品;甲酸,色谱纯,上海安谱公司产品;乙酸铵,色谱纯,美国Tedia公司产品;实验用水为Milli⁃Q超纯水,美国Millipore公司生产㊂1.2 液相色谱条件色谱柱为Waters Atlantis R T⁃3色谱柱(4.6mm×150mm,5μm)㊂流动相:A为水(含0.1%甲酸和5mmol/L乙酸铵),B为甲醇㊂采用线性梯度洗脱, 0~3min,流动相中水相(A)比例由90%下降到10%;3~5min,保持流动相中水相(A)比例为10%;5~7min,流动相中水相(A)比例由10%上升至90%;7~10min,保持流动相中水相(A)比例为90%㊂单次样品运行时间总共为10min㊂1.3 质谱条件离子化模式为电喷雾电离正离子模式(ESI+),多反应监测(MRM),离子源温度500℃,驻留时间100ms,雾化气压34.5kPa,辅助气压34.5kPa,喷雾电压5500V,碰撞室射出电压6V㊂赭曲霉毒素A的质谱参数见表1㊂表1 赭曲霉毒素A质谱条件参数Table1 HPLC⁃MS/MS parameters for OTA化合物保留时间(min)母离子质荷比(m/z)特征离子质荷比(m/z)碰撞能量(eV) OTA 3.37404358.0*,239.032,20 *定量离子㊂1.4 样品提取与净化将粮食(小麦㊁玉米㊁大豆㊁大米)样品用粉碎机粉碎至完全通过0.5mm筛㊂准确称取5.0g样品于50ml具塞三角瓶中,准确量取并加入25ml乙腈⁃水(体积比80∶20),置于摇床中180r/min振荡7141孙 月等:固相萃取⁃高效液相色谱串联质谱法检测粮食中赭曲霉毒素A . All Rights Reserved.30min,静置5min后,2500r/min离心5min,取上清,待净化㊂将氨基固相萃取柱连接在固相萃取仪上,分别取5ml甲醇和甲醇⁃水(体积比25∶75)活化㊂准确移取5ml待净化的离心上清加入柱中,使上清液以约1s1滴的流速通过氨基固相萃取柱,弃过柱液,分别取5ml甲醇⁃水(体积比25∶75)和甲醇过柱淋洗,弃淋洗液㊂准确量取10ml乙腈⁃甲酸(体积比85∶15)加入固相萃取柱,洗脱富集在固相萃取柱上的赭曲霉毒素A,流速约为1s1滴,收集全部洗脱液于干净的玻璃试管中,氮气吹干,残留物加入1ml流动相溶液,于漩涡混合器上振荡1min,过0.22μm有机滤膜,供HPLC⁃MS/MS检测㊂1.5 基质标准曲线的建立按GB/T25220⁃2010[19]的方法对从市场购买的小麦㊁玉米㊁大米和大豆样品进行检测,取未检出赭曲霉毒素A的4种粮食用粉碎机粉碎至完全通过0.5 mm筛㊂分别称取5.0g未检出赭曲霉毒素A的空白粮食样品,分别加入50ml具塞三角瓶中,采用方法1.4提取净化,将赭曲霉毒素A标准品用上述空白基质稀释,分别标定为0.5μg/L㊁1.0μg/L㊁2.0μg/L㊁5.0μg/L㊁10.0μg/L的系列标准工作液㊂1.6 方法的精密度㊁重复性与回收率测定采用本研究建立的方法对添加赭曲霉毒素A 的粮食样品进行检测,测定方法的精密度㊁重复性与回收率㊂日内精密度测定:添加赭曲霉毒素A使其终浓度为1μg/kg,对添加后的4种粮食样品进行提取与净化,1d内连续检测6次,计算日内精密度;日间精密度测定:添加赭曲霉毒素A使其终浓度为1μg/kg,提取净化后连续检测3d;重复性测定:添加赭曲霉毒素A使其终浓度为1μg/kg,重复提取㊁净化㊁检测6次;回收率测定:分别在4种粮食中添加赭曲霉毒素A使其浓度达到1μg/kg㊁2μg/kg㊁5μg/kg,每个添加浓度重复3次,测定该方法的回收率和相对标准偏差(RSD)㊂2 结果与分析2.1 液相色谱流动相的选择由于赭曲霉毒素A在ESI+条件下产生的是[M+ H]+离子,酸性环境的流动相可明显改善谱峰形状,乙酸铵可提高谱峰强度[20]㊂本研究以水(含0.1%甲酸和5mmol/L乙酸铵)和甲醇为液相色谱流动相,赭曲霉毒素A的峰形对称且灵敏度高(图1)㊂图1 赭曲霉毒素A(OTA)的总离子流图Fig.1 Total ion chromatogram of ochratoxin A(OTA)2.2 方法的线性范围与灵敏度取未检出赭曲霉毒素A的空白粮食样品进行提取净化,将赭曲霉毒素A标准品用空白基质稀释,分别标定为0.5μg/L㊁1.0μg/L㊁2.0μg/L㊁5.0μg/L㊁10.0μg/L的系列标准溶液㊂以赭曲霉毒素A 浓度为横坐标(X),峰面积为纵坐标(Y)作线性回归方程,根据3倍信噪比的峰响应值得到方法的检出限,根据10倍信噪比的峰响应值得到线性范围的下限㊂结果显示,线性范围为0.5~10.0μg/kg,相关系数(r)为0.999,检出限(LOD)为0.25μg/kg,定量限(LOQ)为0.50μg/kg㊂2.3 优化的赭曲霉毒素A洗脱条件采用静态洗脱的方式,比较不同体积比的乙腈⁃甲酸对富集赭曲霉毒素A的洗脱效果㊂结果显示,随着洗脱试剂中甲酸比例增高,洗脱效率随之增高,乙腈⁃甲酸体积比为85∶15时,小麦㊁玉米㊁大米和大豆中的洗脱效率均在80%以上㊂但是,当乙腈⁃甲酸体积比为80∶20时,小麦和玉米中的洗脱效率仅分别上升了0.4%和0.2%,而大米和大豆样品的洗脱效率分别下降了3.0%和1.7%㊂因此,本方法选择体积比为85∶15的乙腈⁃甲酸作为洗脱试剂㊂2.4 方法的精密度㊁重复性与回收率采用本方法对小麦㊁玉米㊁大米和大豆样品中添加的OTA进行检测,结果表明,日内和日间精密度相对标准偏差分别为1.71%~3.53%和0.69%~ 1.58%,重复性相对标准偏差为3.72%~5.56%,加标回收率为83.2%~98.6%,相对标准偏差(RSD)2.26%~6.25%(表2)㊂8141江苏农业学报 2016年第32卷第6期. All Rights Reserved.表2 不同OTA添加水平的添加回收率Table2 Recoveries of spiked samples with different OTA concen⁃trations样品添加量(μg/kg)回收率(%)相对标准偏差(RSD)(%)小麦198.6 6.25291.4 4.87593.6 2.56玉米190.1 5.23286.8 3.98588.5 4.11大米193.2 4.71287.2 3.45591.6 2.26大豆189.6 5.42283.2 3.87587.1 3.202.5 不同前处理方法的比较目前应用于粮食中赭曲霉毒素A检测的前处理方法主要有免疫亲和层析柱法㊁多功能净化柱法和固相萃取法等(表3)㊂比较这些方法后发现,本方法在粮食中的加标回收率为83.2%~98.6%,回收率相对较高;本方法的定量限为0.5μg/kg,低于多功能净化柱和其他固相萃取柱,与采用免疫亲和层析柱测定小麦粉中赭曲霉毒素A的定量限一致,仅低于采用免疫亲和层析柱测定玉米中赭曲霉毒素A的定量限(0.25μg/kg)㊂本方法的检测灵敏度较高,采用的氨基固相萃取柱价格远低于免疫亲和层析柱和多功能净化柱,适用于大量粮食样品中赭曲霉毒素A 的定量分析㊂表3 本方法与文献报道方法检测结果的比较Table3 Comparison of detection results obtained by this method and literature methods 样 品前处理方法定量限(μg/kg)回收率(%)参考文献玉米免疫亲和柱0.2575.9~105.7[6]小麦粉免疫亲和柱0.5086.1~95.7[9]麦类多功能净化柱 1.0060.0~85.0[13]面粉SPE⁃SAX固相萃取 5.0093.7[15]小麦㊁大米SPE⁃C18固相萃取 2.0081.5~97.6[8]小麦㊁玉米㊁大米和大豆SPE⁃NH2固相萃取0.5083.2~98.6本方法3 讨论赭曲霉毒素A具有极大危害性且广泛分布,对人类健康㊁食品安全和国际贸易产生了严重的影响㊂世界各国纷纷制定了赭曲霉毒素A的检测标准和在食品㊁饲料等中的限量标准㊂中国在赭曲霉毒素A检测方面的研究相对落后,虽然已经制定了高效液相色谱和荧光光度法以及高效液相色谱⁃串联质谱法等[19,21⁃23],但大多采用免疫亲和层析柱法,该方法在样品前处理过程中净化时间长,成本较高,无法满足基层实验室对大量样品的检测需要㊂目前,国内尚未制定利用固相萃取结合高效液相色谱串联质谱方法检测多种谷物中赭曲霉毒素A的国家标准㊂ 本研究用乙腈∶水(体积比80∶20)作为提取剂,离心取上清,经氨基固相萃取柱富集,以乙腈⁃甲酸(体积比85∶15)洗脱,经高效液相色谱串联质谱法对来自不同地区的40份粮食样品(小麦㊁玉米㊁大米和大豆样品各10份)进行了测定,仅在1份玉米样品中检测出赭曲霉毒素A,含量为5.01μg/kg㊂应用结果表明,本方法前处理简单,重复性好,回收率高,灵敏度高,成本低,适用于大量粮食样品中赭曲霉毒素A的定量分析㊂参考文献:[1] 杨家玲,岳田利,高振鹏,等.赭曲霉毒素A检测方法的研究进展[J].农产品加工,2008(6):4⁃7.[2] 杨延友,高文花,温红玲,等.济南市售小米和玉米中赭曲霉素A污染状况研究[J].山东大学学报,2010,48(11):125⁃128.[3] 谈敦芳,康维钧,甄国新,等.高效液相色谱法检测谷物中赭曲霉毒素A的方法[J].中国卫生检验杂志,2008,18(1):9141孙 月等:固相萃取⁃高效液相色谱串联质谱法检测粮食中赭曲霉毒素A . All Rights Reserved.12⁃13.[4] MEDINA A,MATEO R,LÓPEZ⁃OCAÑA L,et al.Study of panishgrape mycobiota and ochratoxin A production by Isolates of Asper⁃gillus tubingensis and other members of Aspergillus section Nigri [J].Applied and Environmental Microbiology,2005,71(8): 4696⁃4702.[5] 卫生部,国家标准化管理委员会.食品安全国家标准 食品中真菌毒素限量:GB2761⁃2011[S].北京:中国标准出版社, 2011.[6] 文 虹,文 辉,徐田放.免疫亲和柱⁃高效液相色谱法测定饲料及饲料原料中赭曲霉毒素A的研究[J].饲料工业,2012, 33(3):45⁃47.[7] 李 军,于一茫,田 苗,等.免疫亲和柱净化⁃柱后光化学衍生⁃高效液相色谱法同时检测粮谷中黄曲霉毒素㊁玉米赤霉烯酮和赭曲霉毒素A[J].色谱,2006,24(6):581⁃584. [8] 谢 妮,徐 强,吕相征,等.高效液相色谱法检测小麦㊁大米中赭曲霉毒素A[J].国公共卫生,2003,19(2):210⁃211. [9] 李卫丽.高效液相色谱法测定小麦粉中的赭曲霉毒素[J].中国卫生检验杂志,2009,19(5):1154.[10]GAMZE N K,FATIH O,BULENT K.Co⁃occurrence of aflatoxinsand ochratoxin A in cereal flours commercialised in Turkey[J].Food Control,2015,54:275⁃281.[11]赵孔祥,葛宝坤,陈旭艳,等.在线免疫亲和净化⁃液相色谱⁃串联质谱快速测定中草药及中成药中10种真菌毒素[J].分析化学,2011,39(9):1341⁃1346.[12]ARNAU V,SONIA M,ANTONIO J R,et al.Determination of afla⁃toxins,deoxynivalenol,ochratoxin A and zearalenone in wheat and oat based bran supplements sold in the Spanish market[J].Food and Chemical Toxicology,2013,53:133⁃138.[13]樊 祥,褚庆华,周 瑶,等.多功能净化⁃高效液相色谱法检测麦类中赭曲霉毒素A[J].分析试验室,2007(26):284⁃286.[14]朱孟丽.高效液相色谱法对饲料中赭曲霉毒素的测定[J].广东饲料,2005,14(3):41⁃42.[15]王 峰,仓以鹏,蔡 晶,等.高效液相色谱⁃三重四级杆质谱法测定面粉中17种真菌毒素[J].食品科技,2014,29(11): 331⁃335.[16]Foodstuffs⁃determination of ochratoxin A in barley and roasted cof⁃fee HPLC method with immunoaffinity column clean⁃up:EN14132 [S].[17]Foodstuffs⁃determination of ochratoxin A in cereals and cerealproducts⁃part1:High performance liquid chromatographic method with silica gel clean up:ISO15141⁃1[S].[18]李 尧,张雪梅,党献民,等.基质分散故乡萃取精华液相色谱检测谷物中赭曲霉毒素A[J].粮食与饲料工业,2012,31(24):432⁃435.[19]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.粮油检测:粮食中赭曲霉毒素A的测定(高效液相色谱法和荧光光度法):GB/T25220⁃2010[S].北京:中国标准出版社,2010.[20]史 娜,路 勇,吴 颖,等.高效液相色谱⁃串联质谱法测食品中的赭曲霉毒素A[J].食品科学,2011,32(18):260⁃263.[21]中华人民共和国国家质量监督检验检疫总局.进口大豆㊁油菜籽和食用植物油中赭曲霉毒素A的检测方法:SN/T1746⁃2006[S].北京:中国标准出版社,2006.[22]中华人民共和国国家质量监督检验检疫总局.进出口食品中赭曲霉毒素A的测定方法:SN/T1940⁃2007[S].北京:中国标准出版社,2007.[23]中华人民共和国国家质量监督检验检疫总局.出口花生㊁谷物及其制品中黄曲霉毒素㊁赭曲霉毒素㊁伏马毒素B1㊁脱氧雪腐镰刀菌烯醇㊁T⁃2毒素㊁HT⁃2毒素的测定:SN/T3136⁃2007 [S].北京:中国标准出版社,2007.(责任编辑:张震林)0241江苏农业学报 2016年第32卷第6期. All Rights Reserved.。
全自动免疫亲和在线净化—高效液相色谱法快速测定粮食中赭曲霉毒素AXie Gang;Li Li;Li Rui;Wang Songxue;Wang Shuo【摘要】建立了全自动免疫亲和在线净化-高效液相色谱法快速测定粮食中赭曲霉毒素A(Ochtatoxin A,OTA)的方法.玉米、小麦样品经乙腈-水(60∶40,V∶V)提取,3% Tween-20 (m/V)水溶液10倍稀释后,用自动进样器注入RIDA(R) CREST 在线固相萃取系统,经赭曲霉毒素A免疫亲和小柱净化后,以乙腈-2%乙酸水(50∶50,V∶V)为流动相,流速为1.0 mL/min,C18色谱柱(150 mm×3.5 mm,3.5 μm)分离,荧光检测器测定.根据3倍信噪比的峰响应值,确定赭曲霉毒素A的检出限为0.24 μg/kg,在0.012 5~0.5μg/L范围内呈线性相关,R2值为0.999 8;在玉米、小麦样品中加标回收率为80.1%~ 106.9%,变异系数为2.4%~8.2%.本方法一次装柱可检测60个样品,24 h可检测100个样品,满足谷物中赭曲霉毒素A快速准确定量检测的需要.【期刊名称】《中国粮油学报》【年(卷),期】2019(034)006【总页数】6页(P114-119)【关键词】玉米;小麦;赭曲霉毒素A;在线免疫亲和柱净化;高效液相色谱【作者】Xie Gang;Li Li;Li Rui;Wang Songxue;Wang Shuo【作者单位】;;;;【正文语种】中文【中图分类】TS210.7赭曲霉毒素主要是由曲霉属和青霉属产生的一类有毒的次生代谢物,其中赭曲霉毒素A(ochratoxin A,OTA)毒性最强,能产生如胚胎毒性、致畸性、致癌性、免疫毒性、肝毒性等严重的毒性,被世界卫生组织的国际癌症研究组织列为2B级疑致癌物质 [1]。
此外,OTA稳定存在于谷物、酒类、干果、坚果、咖啡和豆类等农作物及其制品中[2-3]。
高效液相色谱法测定谷物及其制品中赭曲霉毒素A
摘要针对谷物及其制品可能污染的霉菌毒素——赭曲霉毒素A,用免疫亲和柱净化高效液相色谱法进行了验证。
关键词赭曲霉毒素A;高效液相色谱法;谷物及其制品;OchraTest免疫亲和柱
赭曲霉毒素A是曲霉属和青霉属一些菌种的有毒产物,动物毒性试验表明,赭曲霉毒素A具有免疫抑制毒性、神经毒性、致畸性及致癌性。
1993年,国际癌症研究中心已将赭曲霉毒素A列为可能的人类致癌物。
被赭曲霉毒素A污染的谷物及其制品是人体内赭曲霉毒素A的主要来源,通过对谷物及其制品中赭曲霉毒素A的检测可以估计人体每天摄入量。
目前国际上检测赭曲霉毒素A的方法有薄层层析法、酶联免疫吸附法及高效液相色谱法等,高效液相色谱法是最常用的方法。
本文验证了用高效液相色谱法测定谷物及其制品中赭曲霉毒素A含量的方法,现报告如下。
1材料与方法
1.1试验原理
将试样与提取溶液混合后高速均质、过滤得到提取液,提取液经稀释后加入到装有赭曲霉毒素A专一化抗体的免疫亲和柱中,使样品中的赭曲霉毒素A与抗体结合。
淋洗除杂质后,以甲醇洗脱溶液使赭曲霉毒素A与抗体分离洗脱,供液相色谱定性定量测定。
1.2材料与设备
1.2.1材料。
色谱纯已腈、纯水、乙酸、磷酸盐缓冲液、色谱纯甲醇、折叠滤纸、微孔玻璃纤维滤纸、赭曲霉毒素A标准品。
1.2.2设备。
OchraTest免疫亲和柱,Agilent1100液相色谱仪(带有荧光检测器),高速均质机,手动玻璃注射器泵流架,电子天平(感量1g),谷物粉碎机。
1.3样品测定方法
1.3.1提取。
称取50g磨细的样品,置于搅拌杯中,加入100 mL乙腈水溶液(乙腈∶水=60∶40),盖上搅拌杯的盖子,高速搅拌1min,取下盖子,将提取物倒入槽纹滤纸上,滤液收集于干净的容器中。
1.3.2提取物的稀释。
移取10mL上步的滤液,置于干净的容器中,用40mL纯水将滤液稀释、混匀,将上步稀释液通过玻璃微纤维滤纸过滤器,滤液收集于玻璃注射器筒中。
1.3.3分离柱色谱操作。
将上步10mL滤液以1~2滴/s的流速全部通过OchraTest免疫亲和柱,直至空气进入到亲和柱中。
将10mL磷酸盐缓冲液以1~2滴/s的流速全部通过亲和柱,直至空气进入到亲和柱中。
将10mL纯水以1~2滴/s 的流速全部通过亲和柱,直至空气进入到亲和柱中。
用1.5mL色谱纯甲醇以1滴/s的流速淋洗亲和柱,收集全部淋洗液与2mL小瓶中,供测试用。
1.3.4测定。
液相色谱条件:色谱柱流速:1mL/min;柱温:30℃;检测波长:激发波长333nm,发射波长477nm;流动相为水∶乙腈∶乙酸=99∶99∶1;进样量:30μL。
1.3.5液相色谱测定。
赭曲霉毒素A不同浓度标准溶液的液相色谱出峰面积线性关系见表1,赭曲霉毒素A标准品的液相色谱图见图1。
1.3.6计算方法。
样品中赭曲霉毒素A(μg/kg)=C×V/m,其中,C为液相色谱仪测得的样品溶液的浓度,μg/L;V为样品溶液的定容体积,mL;m为样品质量,g。
2结果与分析
2.1流动相的选择
在其他色谱条件不变的情况下,分别用甲醇∶水∶冰乙酸(99∶99∶1)、乙腈∶水∶冰乙酸(99∶99∶1)2种溶液作流动相,赭曲霉毒素A标准溶液浓度5ug/L,进样30μL。
试验表明,甲醇∶水∶冰乙酸(99∶99∶1)流动相在30min内无色谱峰出现,乙腈∶水∶冰乙酸(99∶99∶1)流动相在 6.7min出峰,且被测组分有较高的灵敏度,所以选用了后一种溶液作流动相。
2.2回收率与精密度
2.2.1回收率试验。
在面粉样品中分别加入浓度为0.8μg/L、4.0 μg/L的赭曲
霉毒素A标准溶液,回收率分别是82.0%、96.3%。
2.2.2精密度试验。
取分别加入5μg/L、10μg/L赭曲霉毒素A标准溶液的3个样品,每份样品3个平行样,在相同条件下连续每份样品6次重复测定,每份样品测定18次,分别计算各种浓度测定结果的相对标准偏差(RSD),其结果为9.21%和7.58%。
3结论
免疫亲和柱净化高效液相色谱法测定谷物中赭曲霉毒素A不仅测定灵敏度高,准确可靠,而且快速、经济、实用。