酸碱平衡和酸碱滴定分析
- 格式:doc
- 大小:336.50 KB
- 文档页数:9






无机及分析化学06酸碱平衡与酸碱滴定法酸碱平衡是无机及分析化学中的一个重要概念,它涉及到溶液中酸和碱之间的相互作用和平衡状态。
酸碱滴定法是一种常用于测定溶液中酸碱性质和浓度的分析方法。
本文将对酸碱平衡和酸碱滴定法进行详细介绍。
首先,我们来介绍酸碱平衡的基本概念。
酸碱平衡是指溶液中酸和碱之间的反应和平衡状态。
在溶液中,酸能够释放出H+离子,而碱能够接受H+离子。
这个过程被称为质子(H+)转移反应。
在酸碱平衡中,有两个重要的概念:酸性度(pH)和酸度常数(Ka)。
pH是用来表示溶液酸碱性强弱的指标,它的定义是pH=-log[H+],其中[H+]代表溶液中的氢离子浓度。
pH值越小,表示溶液越酸;pH值越大,表示溶液越碱。
在中性水溶液中,pH值为7酸度常数Ka用来衡量酸的强弱,它的定义是Ka=[H+][A-]/[HA],其中[H+]代表酸溶液中的氢离子浓度,[A-]代表酸的共轭碱的浓度,[HA]代表未解离酸的浓度。
Ka值越大,表示酸越强。
酸碱滴定法是一种常用于测定溶液中酸碱性质和浓度的分析方法。
在酸碱滴定中,通常会使用滴定管、酸度计、酸碱指示剂等实验装置和试剂。
滴定过程中需要滴定剂、指示剂和滴定的原料溶液。
滴定过程中,首先准备好要分析的溶液和滴定剂。
然后,用滴定管滴入适量的滴定剂到容器中,然后再加入适当的指示剂。
当滴定剂反应完全与原料溶液中的酸或碱反应完成时,指示剂的颜色将发生明显的变化。
通过测量滴定剂用量,可以计算出原料溶液中酸或碱的浓度。
酸碱滴定法有许多不同的类型,其中最常见的有酸碱滴定、氧化还原滴定和络合滴定。
酸碱滴定是根据滴定剂对溶液中的酸或碱进行中和反应来测定其浓度。
氧化还原滴定是通过滴定剂与溶液中的氧化还原反应来测定其浓度。
络合滴定是通过滴定剂与溶液中的金属离子形成络合物来测定其浓度。
酸碱滴定法在实际应用中有广泛的用途。
例如,它可以用于测定食品和药品中的酸碱度,以确保其安全和合规性。
此外,酸碱滴定还可以用于水质分析、环境监测和药物分析等领域。
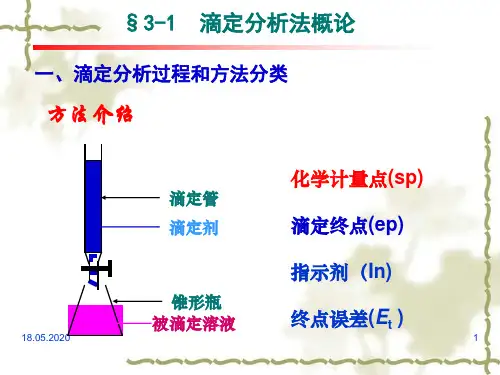


第7章酸碱平衡与酸碱滴定法7.1 溶液中酸碱平衡的处理方法 71酸碱滴定法是以酸碱反应为基础的滴定分析方法,是滴定分析中广泛应用的方法之一。
由于酸碱滴定法的基础是酸碱平衡,因此本章首先介绍溶液中酸碱平衡的基本理论,然后学习酸碱滴定法的基本原理及应用。
7.1 溶液中酸碱平衡的处理方法酸碱溶液中平衡型体之间存在三大平衡关系:①物料(质量)平衡,②电荷平衡,③质子平衡。
本章酸度的计算中,用质子平衡对酸碱平衡进行处理,最简单最常用。
因此分别介绍这些方法。
7.1.1 物料平衡平衡状态时,化学体系中某一组分的分析浓度等于该组分各种型体平衡浓度之和。
例题7-1:0.10 mol・L-1 HAc溶液,其物料平衡式为: cHAc=c(HAc) + c(Ac-)=0.10(mol・L-1)例题7-2:0.20 mol・L-1 NaHCO3溶液,其物料平衡式为:?2?c(Na+)=cNaHCO3=c(H2CO3) + c (HCO3) + c(CO3)=0.20 (mol・L-1)例题7-3:0.50 mol・L-1 NaOH溶液,其物料平衡式为: CNaOH=c(Na+ )=c(OH )=0.50 (mol・L-1)-例题7-4:0.50 mol・L-1 HCl溶液,其物料平衡式为: CHCl=c(Cl )=c(H+ )=0.50(mol・L-1 )-例题7-5:0.20 mol・L-1 NH4Cl溶液,其物料平衡式为: CNH4Cl=c(Cl )=c(NH4) + c(NH3)=0.20 (mol・L-1)-?7.1.2 电荷平衡处于平衡状态的水溶液是电中性的,即溶液中荷正电质点所带正电荷的总数与荷负电质点所带负电荷的总数相等。
例题7-6:0.10 mol・L-1 HAc溶液,其电荷平衡式为: c(H+ )=c(Ac- ) + c(OH )-对多价阳(阴)离子,平衡浓度各项中还有相应的系数,其值为相应离子的价数。


第七章酸碱平衡与酸碱滴定学习要求:1.熟悉弱电解质的特点,弱电解质的离解平衡,离解度及其影响因素,离解平衡常数,离解度和离解平衡常数之间的关系—稀释定律。
掌握酸碱平衡理论及溶液pH值的计算;2.掌握缓冲溶液的含义;掌握缓冲溶液酸碱度的计算,了解缓冲溶液的选择和配制。
3.了解酸碱指示剂的作用原理,掌握其理论变色点和变色范围,掌握指示剂的选择。
4.掌握各类酸碱滴定曲线的特点、化学计量点pH的计算及指示剂的选择;掌握影响pH 突跃范围大小的因素;5.掌握各类酸碱准确滴定、分步滴定及指示剂的选择依据,了解酸碱滴定法的应用,掌握酸碱滴定结果的计算。
前面已介绍了化学平衡的一般规律,本章主要讨论水溶液中的酸碱平衡。
酸碱平衡在生物体中也同样存在,生物体液需要维持一定的pH范围,pH的改变将会影响生物体内细胞的活性。
因此酸碱平衡及其有关反应与生物化学反应有密切关系。
与气相中的反应相比,溶液的反应活化能较低,热效应较小,因此反应速率快,而且其平衡常数受温度、压力的影响较小,一般可以只考虑浓度1对平衡的影响。
酸碱滴定法是酸碱反应为基础的滴定分析方法。
它不仅能用于水溶液体系,也可用于非水溶液体系,因此酸碱滴定法是滴定分析中最重要的和应用最广泛的方法之一。
在酸碱滴定中,溶液的pH如何随滴定剂的加入而发生变化,如何选择合适指示剂使其变色点与化学计量点接近,如何将酸碱滴定法用于实际测定中等,都是必须掌握的内容。
本章将学习酸碱平衡和酸碱滴定法的基本原理和应用实例。
第一节电解质溶液一、电解质的分类电解质是一类重要的化合物。
凡是在水溶液或熔融状态下能解离出离子而导电的化合物叫做电解质,如NaCl。
1923年,德拜(P. J. W.Debye)和休格尔(E. Hückel)提出强电解质理论,电解质可分为强电解质和弱电解质两大类。
强电解质在水溶液中是能完全解离成离子的化合物,如离子型化合物:NaCl、=1,因此处理问题通常可进近似地1在本章讨论中的所涉及的溶液都是较稀的溶液,活度系数i用浓度代替活动度。
第六章 酸碱平衡和酸碱滴定分析(一)选择题1. 欲配制pH=10.0的缓冲溶液,可以 考虑选用的缓冲对是( )。
A.HAc —NaAcB.HCOOH — HCOONaC.H 3PO 4 —NaH 2PO 4D.NH 4Cl —NH 32.NH 3的共轭酸为 ( )A.HClB.NH 2-C.NH 4+D.NH 4OH3.0.21-∙L mol HAc 与0.21-∙L mol NaAc 溶液等体积混合后,其pH=4.8,如将此溶液再与等体积水混合,稀释液的pH 值为( )A.2.4B.4.8C.7.0D.9.64.在实验室欲配制澄清的BiCl 3溶液,应在稀释前先加足够量的( )。
A.NaOHB.HClC.NaClD.Bi5.H 2S 的饱和水溶液中,各物浓度关系正确的是( )A.[][]+-≈H S 22B.[][]+-≈H HS C.[][][]-++≈HS H S H 2 D.[][]-≈22S S H 6.向醋酸(HAc)溶液中加一些NaAc 会使( )。
A.HAc 的K a 减少B.HAc 的电离度减少C.HAc 的Ka 减小,[H +]减小 D 溶液的pH 减小7需要配制pH=3.6的缓冲溶液,应该选用的缓冲对是( )A.HCOOH —HCOONa (HCOOH a,K =1.8×104-) B. HAc —NaAc (HAc a,K =1.8×105-) C.NaHCO 3—Na 2CO 3 (32CO H a,K =5.6×1011-) D.以上三种缓冲对都可选用8.用HAc(a K =4.75)和NaAc 配制pH=3.75的缓冲溶液,其缓冲比[]HAc /[]NaAc 是( )。
A.1B.5C.100D.109已知.NH 3 的b pK =4.75,若将浓度均为0.11L mol -∙的NH 3水和NH 4Cl 水溶液等体积混合,其混合液的pH 值为( )A.9.25B.4.75C.8.75D.10.2510.已知一缓冲溶液的缓冲比[]HA /[]NaA =21,弱酸HA 的a K =1×106-,则缓冲溶液的pH 值为( )。
A.5.7B.6.5C.7.3D.6.311.已知O H NH 23∙的b K =1.8×105-,则浓度为0.11L mol -∙的O H NH 23∙的[-OH ]为( )。
A. 1.8×106-B.1.34×103-C.4.2×103-D. 1.8×104-12.欲配的缓冲溶液,在下列缓冲对中应选( )。
A HAc —NaAc (.HAc 的a pK =4.75)B.O H NH 23∙—NH 4Cl (O H NH 23∙的b pK =4.75)C. HCOOH —HCOONa (HCOOH 的a pK =3.75)D.HCN —NaCN (HCN 的a pK =9.31)13. pH=4的溶液,其[H +]是pH =8的溶液的[H +]的( )倍。
A.4B.8C.400 D1000014.室温下将500ml 水加至1升HAc —NaAc 缓冲溶液中,则( )。
A. pH 值基本不变,缓冲容量β减小B. pH ↗β↗C. pH ↘β变D. pH ↗β不变15.用b pK =4.75的O H NH 23∙和NH 4Cl 配制pH=9.25的缓冲溶液,则缓冲比为( )。
A[盐]/[碱]=1 B. [盐]/[碱]=-1C. [盐]/[碱]=105.4 D[盐]/[碱].=105.4-16.浓度为0.11L mol -∙的HAc 的a K =1.75×105-,则[H +]为()。
A.1.32× 103-1L mol -∙B.4.3× 103-1L mol -∙C.1.3212L mol 10--∙⨯D.1.7515L mol 10--∙⨯17.H 2S 饱和溶液(C S H 2≈0.11L mol -∙)中,[-2S ]等于( )。
A.0.1 1L mol -∙B.2 [H +]C. S 1H 2KD. S 2H 2K18.酸碱质子理论认为,下列物质中全部是酸的是( )组。
A. H 2S ,-242O C ,HCO -3 B .-24HPO ,+4NH ,[62O)Fe(H ]+3C.Na(s),3BF ,O H 219.下列缓冲溶液中缓冲容量最大的溶液是( )。
A.0.011L mol -∙ HAc ──0.011L mol -∙NaAcB.0.051L mol -∙ HAc ──0.051L mol -∙NaAcC.0.021L mol -∙ HAc ──0.081L mol -∙NaAcD.0.061L mol -∙ HAc ──0.041L mol -∙NaAc20.下列化合物中其水溶液的pH 值最高的是( )。
A. NaClB. 32CO NaC. Cl NH 4D.3NaHCO21.在110ml 浓度为0.11L mol -∙的HAc 中,加入10ml 浓度为0.11L mol -∙的NaOH 溶液,则混合液的pH 值为(已知HAc 的a pK =4.75)A.4.75B.3.75C.2.75D.5.7522. 25℃ ,0.11L mol -∙某一元弱酸溶液的电离度为0.2%,则此溶液的-OH 浓度为( )1L mol -∙A. 2 410-⨯B.1 1010-⨯C.5 510-⨯D.51110-⨯23.下列关于盐类水解的论述中正确的是( )。
A.弱酸弱碱水解使溶液呈中性B.多元酸盐的水解是分步进行的C.加酸可以抑制弱酸盐的水解D.水解盐溶液越稀,水解常数越大24.下列缓冲溶液中,对碱有较大缓冲能力的是( )A.0.181L mol -∙HAc ─0.021L mol -∙NaAcB.0.021L mol -∙HAc ─0.181L mol -∙NaAcC.0.181L mol -∙ O H NH 23∙─0.021L mol -∙Cl NH 4D.0.051L mol -∙O H NH 23∙─0.051L mol -∙Cl NH 425.向1升0.11L mol -∙的弱酸HA(Ka=1510-⨯)溶液中加入固体NaOH (式量为40) 2克后,溶液的为pH 为( )。
(3.105.0lg -=)A.3.2B.11.8C.9.0 D5.026.根据下列质子传递反应⑴+--+=+O H S O H HS 322 K 1=11210-⨯⑵CN -+O H 2=HCN + OH - K 2=1410-⨯⑶HAc+O H 2=-++Ac O H 3K 3=1510-⨯ 4)HNO 2+CN -=HCN+NO 2- K 4=1×106 最强的质子碱是( )A.NO 2 -B.Ac - -D.S2- 27、相同浓度的下列阴离子,碱度最强的是:A 、CN -(K θHCN = 6.2×10-10) B 、S 2-(θ-HS K = 7.1×10-15) C 、CH 3COO -(θHAc K = 1.8×10-5) D 、Cl -(θHCl K >>1)28、EDTA 的θ1a PK ~ θ6a PK 分别为0.9、1.6、2.0、2.67、6.16、10.26,其θ5b PK 是:A 、11.33B 、7.75C 、12.00D 、12.4029、根据酸碱质子理论,错误的说法是:A 、酸越强,其共轭碱越弱。
B 、水中存在的最强酸是H 3O +。
C 、H 3O +的共轭碱是OH -。
30、浓度相等的下列水溶液,其pH 最高的是:A 、NaAcB 、Na 2CO 3C 、NH 4ClD 、NaCl31、0.050 mol ·L -1 NaH 2PO 4溶液的pH 值为:A 、9.77B 、4.69C 、3.69D 、3.5832、室温下H 2CO 3饱和溶液的浓度约为0.04 mol ·L -1,其pH 值为:A 、5.9B 、5.3C 、4.9D 、3.933、某碳酸盐混合碱样,以酚酞为指示剂,用HCl 标液V 1 ml ,继续以甲基橙为指示剂,又耗去HCl 标液V 2 ml ,若V 2 < V 1则此碱样为:A 、Na 2CO 3B 、NaOHC 、NaHCO 3 + Na 2CO 3D 、NaOH + Na 2CO 334、用甲基红作指示剂,能用NaOH 标准溶液准确滴定的酸是:A 、HCOOHB 、CH 3COOHC 、H 2C 2O 4D 、H 2SO 435、用0.100 mol ·L -1 NaOH 滴定0.100 mol ·L -1 HCl 和 0.200 mol ·L -1 H 3BO 3的混合液,理论终点时,溶液的pH 值为:A 、4.12B 、5.00C 、5.12D 、5.836、100 ml 0.30 mol ·L -1 NaOH 溶液从空气中吸收了2.00 m mol 的CO 2,现以为酚酞指示剂,用HCl 标准溶液滴定时,其浓度为:A 、0.25 mol ·L -1B 、0.26 mol ·L -1C 、0.27 mol ·L -1D 、0.28 mol ·L -137、用0.10 mol ·L -1 NaOH 滴定0.10 mol ·L -1的一元弱酸(θa PK = 4.0)其突跃范围为7.0 ~ 9.7;用同浓度NaOH 滴定θa PK = 3.0的一元弱酸时,其突跃范围为:A 、6.0 ~ 10.7B 、6.0 ~ 9.7C 、7.0 ~ 10.7D 、8.0 ~ 9.738、用0.10 mol ·L -1 HCl 滴定同浓度的NaOH ,其突跃范围为9.7 ~ 4.3,将浓度均改为0.010 mol ·L -1时,其突跃范围为:A 、8.7 ~ 4.3B 、8.7 ~ 5.3C 、10.7 ~ 5.3D 、10.7 ~ 3.339、浓度各扩大10倍,滴定突跃范围增加1个pH 单位的是_______,滴定突跃范围增加2个单位的是_______,滴定突跃范围不变的是_______。
A 、NaOH 滴定HClB 、NaOH 滴定HAcC 、NaOH 滴定二元弱酸至HA -D 、HCl 滴定NaOHE 、HCl 滴定NH 3·H 2OF 、HCl 滴定Na 2CO 3至NaHCO 340、取某磷酸盐混合液25.00 ml ,以酚酞为指示剂,耗0.50 mol ·L -1 HCl 标液10.00 ml ;另取一份25.00 ml ,以甲基红为指示剂,耗HCl 标液50.00 ml ,则混合液组成为:A 、NaH 2PO 4 ~ Na 3PO 4B 、Na 2HPO 4 ~ Na 3PO 4C 、Na 2HPO 4 ~ NaH 2PO 4D 、NaH 2PO 441、标定NaOH 溶液时,若采用了部分风化的H 2C 2O 4·2H 2O 为基准物,则标定的浓度将:A 、偏高B 、偏低C 、准确D 、无法判断42、已知0.10 mol ·L —1一元弱酸HB 溶液的pH = 3.0,则0.10 mol ·L —1共轭碱NaB 溶液的pH 是A 、 11.0;B 、9.0;C 、8.5;D 、9.5。