BD ELISPOT —单细胞分析技术
- 格式:ppt
- 大小:227.50 KB
- 文档页数:10

Elispot的原理及应用1. Elispot是什么Elispot(enzyme-linked immune spot assay)是一种用于测定单个细胞的分泌功能的实验技术。
它通过检测分泌细胞在特定条件下产生的细胞因子或细胞分泌物的分泌量,来评估细胞的免疫反应。
Elispot被广泛应用于免疫学、肿瘤学、感染病学等领域的研究和诊断。
2. Elispot的原理Elispot基于细胞分泌物的分泌原理进行测定。
其原理主要包括以下几个步骤:1.准备ELISPOT板:将特定抗体或刺激物涂覆在固相支持体上,形成抗原或刺激物捕获层。
常用固相支持体有多孔膜、96孔板等。
2.加样细胞:将待测细胞或其他产生细胞分泌物的细胞加入到ELISPOT板中,使其与抗原或刺激物接触。
3.细胞刺激:经过一定的培养条件和时间,刺激细胞产生分泌物。
4.分泌物检测:将细胞移除,用特异性抗体标记待测细胞分泌物中的目标分子,形成复合物。
5.免疫反应可见化:通过酶标法或荧光法,使复合物与ELISPOT板上的底物发生反应,产生可观察的斑点。
3. Elispot的应用Elispot技术广泛应用于以下领域:3.1 免疫学研究Elispot可以用于研究多种细胞因子的产生情况,如干扰素γ(IFN-γ)、白介素-2(IL-2)、肿瘤坏死因子(TNF-α)等。
它可以检测单个细胞的分泌情况,并通过对不同细胞类型进行比较,揭示免疫细胞的功能和相互作用。
3.2 肿瘤学研究Elispot可以评估肿瘤特异性T细胞的活性和功能。
通过使用与肿瘤相关的抗原刺激细胞,可以检测肿瘤特异性T细胞的分泌情况,进而评估免疫治疗的效果和抗肿瘤免疫应答的强度。
3.3 感染病学研究Elispot在感染病学研究中起到重要作用。
通过检测特定感染病原体的抗原刺激下,细胞分泌物的产生情况,可以评估免疫应答的强度和类型,并且可以用于疫苗开发和新药筛选等领域。
3.4 自身免疫性疾病研究Elispot可以用于评估自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮等)患者的自身免疫反应。

ELISPOT工作原理关键信息项:1、 ELISPOT 技术的定义2、涉及的实验材料和设备3、实验操作步骤4、数据采集与分析方法5、技术的优势和局限性11 ELISPOT 技术的定义ELISPOT(EnzymeLinked Immunospot Assay),即酶联免疫斑点检测技术,是一种用于检测和定量单个细胞分泌特定蛋白质的免疫学方法。
111 原理概述ELISPOT 基于细胞分泌的蛋白质能够在细胞周围的固相载体上形成可见斑点的原理。
当被检测的细胞受到特定刺激后,会分泌特定的细胞因子或抗体等蛋白质。
这些分泌的蛋白质会被预先包被在固相载体(通常是微孔板)上的特异性抗体捕获。
112 与其他技术的比较与传统的 ELISA(酶联免疫吸附测定)方法相比,ELISPOT 能够检测单个细胞的分泌水平,而 ELISA 则是对细胞群体分泌的总和进行测量。
12 涉及的实验材料和设备121 固相载体通常使用 96 孔或 384 孔的微孔板,表面经过特殊处理以增强抗体的吸附。
122 捕获抗体针对待检测的细胞因子或蛋白质的特异性抗体,用于包被微孔板。
123 检测抗体与捕获抗体识别不同表位的另一种特异性抗体,通常与酶标记物结合。
124 酶标记物如辣根过氧化物酶(HRP)或碱性磷酸酶(AP)等,用于催化显色反应。
125 显色底物根据所使用的酶标记物选择相应的显色底物,产生可见的斑点。
126 细胞培养相关试剂包括培养基、血清、刺激剂等。
127 细胞分离和制备设备如离心机、移液器等。
13 实验操作步骤131 微孔板包被将捕获抗体稀释至适当浓度,加入微孔板中,在适当条件下孵育,使抗体吸附在微孔板表面。
132 封闭用封闭液封闭微孔板上未结合抗体的位点,以减少非特异性结合。
133 细胞接种将处理好的细胞悬液加入微孔板中,在特定条件下培养。
134 刺激根据实验目的,加入适当的刺激剂,诱导细胞分泌目标蛋白质。
135 孵育在适当的温度和时间条件下孵育,使细胞分泌的蛋白质被捕获抗体捕获。

ELISPOT技术ELISPOT方法从创立至今已经有20多年的历史了。
1983年,在地球南北两个半球地理位置相距遥远的两个研究小组几乎同时、独立的创立了这项技术。
一个研究小组位于澳大利亚西部的柏斯Peth,牵头人是当时正在当地Margaret 女王医院儿童医学研究所攻读博士学位的Jonathon D. Sedgwich (Sedgwick JD et. al., 1983)。
另一个研究小组位于北欧瑞典城市哥德堡Gothenburg,带头人是哥德堡大学医学微生物系的学者Cecil C. Czerkinsky (Czerkinsky CC et. al., 1983a)。
前者开创ELISPOT方法是为了研究B淋巴细胞分泌IgM抗体的情况(Holt PG et. al., 1984;Sedgwick JD et. al., 1984);而后者除了用于研究B淋巴细胞分泌抗体的情况(Czerkinsky CC et. al., 1983b; 1983c),还应用于大肠杆菌分泌肠毒素(Czerkinsky CC et.al., 1983a)和成纤维细胞分泌纤维连接蛋白(Czerkinsky CC et. al., 1984)的研究中。
虽然研究的对象不一样,但是该实验技术所涉及的原理以及方法步骤和我们现在的标准ELISPOT 几乎完全相同。
这二十多年来,ELISPOT基本技术并没有什么重大变化,但是技术进步一直没有停顿,实验材料的改进了,实验灵敏度与重复性提高了,实验应用领域也拓宽了。
(1)底板材质的改进ELISPOT技术从创立之初,检测底板都是使用的普通塑料板,它的蛋白吸附能力差,因此实验的灵敏度有限。
1985年,Moller SA和Borrebaeck CA将膜板引入ELISPOT中(Moller SA et. al., 1985),检测的也是分泌抗体的阳性B细胞。
他们引入的是硝酸纤维素膜,获得了远远优于塑料板的结果。

bd单细胞测序原理随着生物技术的不断发展,单细胞测序技术已经成为研究生物学和医学领域的重要工具之一。
而bd单细胞测序作为其中的一种技术手段,具有高通量、高灵敏度和高准确性的特点,被广泛应用于基因表达、细胞异质性和个体差异等研究领域。
bd单细胞测序是通过将单个细胞分离和捕获,然后将其转录本进行扩增、测序和分析的方法。
其原理基于高通量测序技术,可以实现对数千个单个细胞的基因表达进行全面的分析。
bd单细胞测序的工作流程可以分为以下几个步骤:1. 细胞分离和捕获:首先,需要将目标细胞进行分离和捕获。
常用的方法包括流式细胞术、微流控芯片和微操作技术等。
这些方法可以帮助将单个细胞分离出来,并将其固定在特定的载体上,以便后续的处理和分析。
2. 转录本扩增和准备:在细胞捕获后,需要对其转录本进行扩增和准备。
这一步骤主要包括RNA的提取、反转录和cDNA合成。
通过这些步骤,可以将单个细胞中的RNA转录本扩增为足够数量的cDNA,以便进行后续的测序分析。
3. 测序:在转录本准备好后,接下来就是进行测序。
bd单细胞测序通常采用高通量测序技术,如Illumina测序平台。
通过测序,可以获取每个单细胞的转录本序列信息,从而了解其基因表达情况。
4. 数据分析:最后,对测序数据进行分析和解读。
这一步骤包括数据质控、比对、基因表达量计算和差异分析等。
通过这些分析,可以得到每个单细胞的基因表达谱,进而研究细胞异质性和个体差异等重要问题。
bd单细胞测序原理的关键在于将单个细胞进行分离和捕获,以及对其转录本进行扩增和测序。
这种方法可以避免传统的群体测序方法中的细胞异质性和掩盖效应,从而更准确地揭示细胞的功能和特性。
然而,bd单细胞测序也存在一些挑战和限制。
首先,细胞分离和捕获的效率和准确性需要进一步提高,以便更好地捕获稀有细胞和亚群体细胞。
其次,对转录本的扩增和测序过程中会引入一定的偏差和误差,需要采取相应的校正和标准化方法。
此外,数据分析的复杂性和存储的需求也是一个挑战,需要开发更高效和精确的算法来处理和解读大量的测序数据。


ELISPOT工作原理ELISPOT是一种基于酶联免疫斑点(enzyme-linked immunospot)技术的生物学实验方法,用于检测单个活细胞产生的细胞因子数量,以获得关于特定免疫反应的定量信息。
ELISPOT方法已成为研究和临床诊断中常用的细胞免疫分析技术。
本文旨在介绍ELISPOT技术的原理和应用。
1. ELISPOT技术的基本原理ELISPOT技术的基本原理是利用单个细胞在聚焦区域中分泌细胞因子的能力。
首先在多孔板上涂覆特定抗体,并使用细胞悬浮液孵育,使细胞吸附在多孔板上,然后刺激细胞产生细胞因子,特异性抗体识别并结合细胞因子,供试细胞被固定,而其产生的细胞因子仍然可扩散进入周围。
接着使用酶标技术,添加酶标抗体-酶复合物识别并结合周围可扩散的细胞因子,形成可被酶底物着色的斑点。
ELISPOT试验可用于检测细胞因子的免疫反应,可以在不光化细胞,也无需使用放射性同位素进行标记的情况下,测定非常微量的细胞因子。
2. ELISPOT技术的应用ELISPOT技术的应用非常广泛,可以用于研究细胞免疫学、癌症、感染病原体和自身免疫性疾病等。
下面将分别介绍这些应用。
2.1. 研究细胞免疫学ELISPOT技术可以用于检测不同和同种发育阶段、性别、某些基因型或特定条件下的免疫细胞产生的细胞因子。
例如,可以对不同的激活剂进行测试,检测免疫细胞的分泌情况,揭示特定免疫反应的机制。
此外,由于ELISPOT对特异性和非特异性T和B淋巴细胞的敏感性非常高,所以可以使用这种技术来监测疫苗接种效果或者进行不同细胞因子分子和癌细胞的功能评估等。
2.2. 癌症的研究和治疗免疫疗法已成为一种治疗恶性肿瘤的新式方法,其中包括活体细胞治疗和肿瘤抗原刺激,此类方法具有极大的潜力来抑制肿瘤细胞的增长和扩散。
ELISPOT技术用于评估肿瘤抗原特异性T细胞水平的变化,可以在研究和临床实验中确定特异性的肿瘤抗原。
ELISPOT技术具体可用于肿瘤特异性免疫反应的检测、克隆增殖能力的测定、转移性肿瘤特异性T细胞反应的检测,以及抗肿瘤免疫反应治疗效果的评估等。

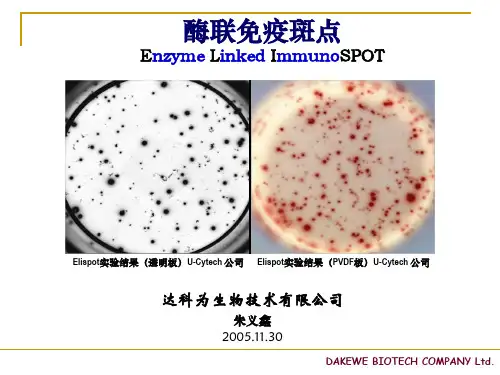

ELISPOT技术原理及实验方法介绍ELISPOT技术原理随着酶联免疫分析技术在医学及生物学领域的广泛应用,使体外检测各种细胞因子及抗体研究有了新的突破。
在研究免疫应答机制时以往常用酶联免疫吸附法(ELISA)检测体液中游离的细胞因子(CK)或抗体,但由于游离的循环抗体或CK的半哀期不同,使之在体液中不断的被代谢或与靶器官结合,而不能确切的反映体内的抗体及CK的水平。
80年代,国外的科研工作者根据ELISA技术的基本原理,建立了体外检测特异性抗体分泌细胞和CK分泌细胞的固相酶联免疫斑点技术(ELISPOT)。
因其具有较高的特异性和敏感性,目前正被国内外广泛应用,对探索自身免疫系统疾病发病机制具有重要意义。
ELISPOT法源自ELISA,又突破传统ELISA法,是定量ELISA技术的延伸和新的发展。
两者都是检测细胞产生的细胞因子或其他可溶性蛋白,它们最大的不同在于:1、ELISA通过显色反应,在酶标仪上测定吸光度,与标准曲线比较得出可溶性蛋白总量。
2、ELISPOT通过显色反应,在细胞分泌这种可溶性蛋白的相应位置上显现清晰可辨的斑点,可直接在显微镜下人工计数斑点或通过ELISPOT分析系统对斑点进行计数,1个斑点代表1个细胞,从而计算出分泌该蛋白的细胞的频率。
(某些研究不仅要测细胞因子生成量,还需检测分泌此细胞因子的细胞频率)3、由于是单细胞水平检测,ELISPOT比ELISA和有限稀释法等更灵敏,能从20万-30万细胞中检出1个分泌该蛋白的细胞。
4、捕获抗体为BD、R&D、Mabtach生产的高亲和力、高特异性、低内毒素单抗,在研究者以刺激剂激活细胞时,不会影响活化细胞分泌细胞因子。
ELISPOT检测原理:ELISPOT全名为Enzyme-linked Immunospot Assay,其技术原理与ELISA相似。
其实验设计是在96微孔培养盘底部披覆PVDF薄膜,用来吸附特殊挑选、且无毒性(不含sodium azide、内毒素endotoxin)的单株抗体。

检验科免疫学常见检测与分析方法为了满足你的要求,我将按照“检验科免疫学常见检测与分析方法”的格式来书写文章。
以下是文章的正文:检验科免疫学常见检测与分析方法免疫学是研究机体免疫系统结构、功能及其介导的免疫反应的科学。
在检验科中,免疫学检测和分析方法广泛应用于疾病诊断、药物研发和医学研究等领域。
本文将介绍免疫学常见检测与分析方法,包括间接免疫荧光法、酶联免疫吸附法、流式细胞术和酶联免疫斑点法。
一、间接免疫荧光法间接免疫荧光法是一种检测抗体和抗原相互作用的方法,其原理是利用荧光素标记的二抗结合到已与目标抗原结合的抗体上,通过荧光显微镜观察荧光标记的二抗与抗原结合的情况。
这种方法具有高灵敏度、高特异性和高分辨率的优点,因此被广泛应用于疾病的早期诊断和研究中。
二、酶联免疫吸附法酶联免疫吸附法(ELISA)是一种常用的免疫学检测方法,用于检测抗体或抗原的存在和浓度。
该方法利用酶和底物的反应产生可见的颜色变化,从而判断目标物的存在和数量。
ELISA方法具有操作简单、灵敏度高和可扩展性强的特点,被广泛应用于病原微生物的检测、药物筛选和免疫学研究中。
三、流式细胞术流式细胞术是一种光学技术,用于分析和计数悬浮在流动液体中的细胞。
该方法通过染色和荧光素标记的抗体等实验步骤,通过流式细胞仪实时检测细胞的形态、大小、荧光强度等特征,从而实现对细胞种类和状态的分析。
流式细胞术在免疫学研究和临床诊断中的应用广泛,如检测白细胞亚群、免疫球蛋白等。
四、酶联免疫斑点法酶联免疫斑点法(ELISPOT)是一种高灵敏度、高特异性的单细胞分析技术,用于检测细胞产生的蛋白质分子。
该方法通过将待检细胞分泌的蛋白质与荧光素标记的抗体结合,通过荧光显微镜观察形成的颗粒斑点。
ELISPOT方法被广泛应用于评估免疫细胞的功能和活性,例如检测细胞因子的分泌和细胞毒性。
总结:免疫学在检验科中的检测和分析方法多种多样,包括间接免疫荧光法、酶联免疫吸附法、流式细胞术和酶联免疫斑点法。

单细胞分析技术和单细胞测序生命科学领域一直以来都是非常先进和繁荣的科技领域。
尤其是近几年来,应用单细胞分析技术和单细胞测序技术来探究细胞的生理和病理状态,成为这个领域内最热门的方向之一。
下文将介绍单细胞分析技术和单细胞测序技术的原理、应用和展望。
一、单细胞分析技术单细胞分析技术是一种分离、捕获、检测、分析并对单一细胞进行解析的方法。
该技术的出现主要是为了突破传统细胞分析的局限性,因为传统细胞分析最少需要数百个或数千个细胞来获得足够的数据。
而单细胞分析技术则能够获取单个细胞的信息,不仅使样本获取更容易,也能够在细胞层面上了解细胞功能的差异和相关性。
单细胞分析技术可以细分为以下几类:单细胞检测技术、单细胞分选技术、单细胞操作技术和单细胞测序技术。
其中,单细胞检测技术和单细胞分选技术是核心技术,它们提供了单细胞检测和筛选的手段。
单细胞操作技术是在单通道微流控芯片中对单细胞进行操作,扩增和分离。
单细胞测序技术则可以获得单个细胞的转录组、蛋白质组或基因组信息,为其提供更进一步的分析。
二、单细胞测序技术单细胞测序技术是单细胞分析技术中最常用的一项技术。
它是早期分析DNA和RNA序列时开发出来的技术,如今已非常成熟且广泛使用。
基于不同的重点,单细胞测序技术可以分为单细胞RNA测序、单细胞DNA测序和单细胞蛋白质组学。
单细胞RNA测序是最常见的单细胞测序技术。
它适用于分析单个细胞的转录活性,可以获得每个细胞不同的转录本表达谱,在深入挖掘细胞转录调节网络方面起到了巨大的作用。
单细胞DNA测序则更多地用于描绘单个细胞的基因组结构和变异。
单细胞蛋白质组学则是基于质谱的技术,能够通过对单细胞中蛋白质的分析,找出其与功能差异相关的蛋白质标志物。
三、单细胞测序技术的应用和展望单细胞测序技术的应用具有广泛性和前瞻性。
利用单细胞测序技术,可以更好地理解复杂的细胞群体和组织之间的差异。
在生物医学方面,单细胞测序技术可以在诊断和治疗癌症、免疫性疾病和神经系统疾病等方面得到广泛应用。
基于ELISPOT技术的免疫细胞功能检测与分析研究免疫细胞功能检测与分析研究:基于ELISPOT技术引言:免疫细胞功能检测与分析是研究免疫系统功能的重要手段之一。
随着免疫监测技术的不断发展,基于ELISPOT(Enzyme-Linked ImmunoSpot)技术的免疫细胞功能检测和分析成为了目前最为常用和有效的方法之一。
本文将介绍基于ELISPOT技术的免疫细胞功能检测与分析研究的原理、应用领域以及未来的发展方向。
一、ELISPOT技术的原理ELISPOT技术是一种基于酶联免疫分析(ELISA)的改进方法,可用于单个细胞水平上的特异性分泌功能检测和分析。
它是通过测定单个免疫细胞(如T淋巴细胞、B淋巴细胞和巨噬细胞等)分泌的特定细胞因子(如细胞因子、抗体等)来评估免疫应答的强度和功能状态。
ELISPOT技术的原理主要分为两步:细胞固定和染色。
1. 细胞固定:待检测细胞株或外周血单个细胞与免疫抗体预涂的ELISPOT板发生特异性结合;2. 细胞染色:ELISPOT板上固定的细胞释放特异性细胞因子,并与免疫抗体形成免疫复合物;经过特异性染色和显色,ELISPOT板上每一个斑点对应于一个分泌免疫因子的单个细胞。
通过计算斑点数量,可以评估细胞分泌功能。
二、ELISPOT技术的应用领域1. 肿瘤免疫监测:ELISPOT技术可用于研究和评估肿瘤特异性T细胞的分泌能力和活力,为肿瘤免疫治疗提供重要依据。
例如,通过ELISPOT技术可以测定肿瘤患者术前和术后的肿瘤特异性T细胞活跃程度,从而评估疗效和预测预后。
2. 传染病免疫研究:ELISPOT技术可用于研究感染过程中的免疫细胞功能状态。
例如,通过测量HIV感染者的IFN-γ分泌水平,可以评估宿主的免疫应答情况,为HIV感染的预测、防控和治疗提供依据。
3. 自身免疫疾病研究:ELISPOT技术可用于评估自身免疫疾病的发病机制和评估治疗效果。
例如,在类风湿关节炎(RA)研究中,ELISPOT技术可以检测患者发病部位滤泡状树突细胞(FDC)的效应。
ELISpot检测技术操作要求及质量控制作者:刘佳来源:《兽医导刊》 2017年第9期酶联免疫斑点检测技术(enzyme-link immunospot assay,ELISpot) 是近年来发展起来的检测细胞因子免疫学检测技术,是在酶联免疫吸附技术(ELISA) 基础上与细胞培养技术充分结合而建立起来的一种可以在体外检测单细胞水平培养的特异性抗体分泌细胞的新型检测技术,此技术可以快捷、简便的对细胞因子分泌量进行定量,目前已经成为国际公认的抗原特异性T细胞免疫学研究的主流技术。
由此可以预见,该检测方法在动物免疫研究领域将会得到广泛应用,发挥其重要作用。
但是,此项技术尚未形成标准化,对细胞含量、细胞浓度、孵育、显色时间等优化条件还没有形成完整体系。
因此,在检测工作实践中,总结实验操作步骤注意事项,提高检测水平,对提高ELISpot技术检测的准确性以及对各个因素进行优化,建立稳定的检测体系具有重要意义。
一、细胞质量控制1. 采血。
选取45 ~ 50 日龄,没有疫苗接种经历的仔猪,从前腔静脉采集外周静脉血,保证无菌操作,抗凝剂抗凝。
采血后轻摇,使血液与抗凝剂充分混匀,避免出现血凝块,影响分离效果。
震荡过于剧烈或保存不当,会出现溶血现象。
2. 淋巴细胞分离。
6 h 内进行外周血单个核细胞(PBMC) 的分离,时间过长会影响活细胞数,淋巴细胞的活细胞比例直接影响酶联免疫斑点的形成。
将稀释好的细胞悬液沿管壁缓慢加至淋巴细胞分离液液面上,2 000 转/ 分钟离心10 min,转速不宜过高,否则会使细胞壁破裂。
离心后,离心管中由上至下细胞分为四层,即血浆或者组织匀浆液层、环状乳白色淋巴细胞富集层、透明分离液层、红细胞层。
吸出中间环状乳白色PBMC 富集层,吸取方法可以将组织匀浆层用吸管去掉,将乳白色淋巴细胞吸出,也可以直接将吸管插入淋巴细胞富集层吸出。
吸液要慢、稳,避免吸出红细胞。
洗涤后,如果有红细胞存在,可以使用红细胞裂解液,将红细胞去除。
2024临床免疫学检验名词解释(第二部分)49、荧光:荧光物质在吸收激发光的能量后,使原来处于基态的电子跃迁到激发态,当其回复至基态时,激发态的电子以发射光的形式释放出能量,这种发射光称为荧光。
50、荧光免疫试验:是以荧光物质标记抗体或抗原,通过与相应抗原或抗体发生特异性结合反应,以此对待测物进行定位、定性和定量分析的检测技术,具有高度特异性、敏感性和直观性。
51、时间分辨荧光免疫试验:以系元素标记抗原或抗体,并与时间分辨测定技术相结合而建立起来的一种新型非放射性微量分析技术。
52、Stokes位移:选择荧光物质作为标记物时,必须考虑激发光谱和发射光谱的波长差,即Stokes位移。
53、荧光偏振免疫试验:是利用抗原抗体竞争反应原理,根据荧光素标记抗原与荧光素抗原-抗体复合物之间荧光偏振程度的差异测定体液中小分子抗原物质的含量。
54、荧光效率:荧光物质分子将吸收的光能转变成荧光的百分率称为荧光效率。
55、荧光淬灭:荧光物质在某些理化因素(如紫外线照射、高温、苯胺、硝基苯、酚、I-等)作用下,发射荧光减弱甚至消退的现象称为荧光淬灭。
56、酶免疫试验:是继荧光免疫试验和放射免疫试验之后的三大经典免疫标记技术之一,它以酶标记抗体(抗原)作为主要试剂,将酶高效催化反应的专一性和抗原-抗体反应的特异性相结合的免疫检测技术。
57、包被:将抗原或抗体结合在固相载体上的过程称为包被。
58、封闭:由于包被液蛋白浓度很低,造成包被后固相载体表面会剩余少量未结合位点I可非特异性吸附标本中的蛋白质和酶结合物,形成非特异性结合,导致本底增高。
为消除干扰,包被后的微孔板或膜等还需用1%~5%牛血清白蛋白(BSA),5%~20%小牛血清或2%脱脂乳等再包被一次,此过程称为封闭。
59、均相酶免疫试验:是利用酶标记物与相应的抗原或抗体结合后,标记酶的活性会发生改变的原理,可以在不将结合酶标记物和游离酶标记物分离的情况下,通过测定标记酶活性的改变(酶活性增强或减弱),从而确定待测物的含量。