第十单元 课题1 常见的酸和碱(第三课时 常见的酸)
- 格式:ppt
- 大小:399.00 KB
- 文档页数:29



化学常见的酸和碱教案化学常见的酸和碱教案化学常见的酸和碱教案1 一、引入1、食醋为什么会有酸味?2、苹果、橙子、柠檬葡萄等这些水果为什么都有酸味?3、石灰水中含有的Ca(OH)2;NaOH;Cu(OH)2等都是碱。
二、酸碱指示剂1、指示剂的概念能跟酸或碱的溶液起作用而显示不同的颜色的物质,叫酸碱指示剂,通常也简称指示剂。
常见的有:石蕊溶液、酚酞溶液。
2、变色规律:说明:①指示剂变色简记方法:酚酞遇酸仍无色,酚酞遇碱红艳艳;石蕊遇酸紫变红,石蕊遇碱紫变蓝②注意:酸性溶液或碱性溶液可使指示剂变色,而不是说指示剂使酸性溶液或碱性溶液变色。
3、指示剂的应用酸碱指示剂主要用来检验溶液的酸碱性,如实验桌上有一瓶失去标签的液体要检验是酸性溶液还是碱性溶液,可用试管取少量溶液滴入1-2滴紫色石蕊试液,假如显红色证明是酸性溶液,假如显示蓝色证明是碱性溶液。
想一想:如何用酸碱指示剂检验溶液的酸碱性?[小结]检验溶液是酸性的方法:取少量该溶液,滴入几滴石蕊试液,假设溶液呈现红色,那么说明该溶液为酸性溶液。
检验溶液为碱性的方法:取少量该溶液,滴入几滴石蕊试液,假设溶液呈现蓝色;或者滴入几滴无色的酚酞试液,假设溶液呈现红色,那么说明该溶液为碱性溶液。
4、指示剂的替代用品酸碱指示剂除了常见的石蕊和酚酞外,还有其他的植物色素,可以用作石蕊和酚酞的代用品,如牵牛花,月季等。
几种植物花朵的酒精浸出液在酸碱溶液中的变色情况练习:⒈ 失去标签的三瓶无色液体,分别是稀H2SO4、蒸馏水、NaOH溶液,能把它们一次性区分开的试剂是〔〕 A. 酚酞B. 铁片C. 石蕊试液D. 二氧化碳气体⒉ 失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,能否用酚酞试液将它们鉴别出来?〔提示:HCl + NaOH=NaCl + H2O〔中性溶液〕〕三、常见的酸1、浓硫酸、浓盐酸的物理性质的比拟2、浓硫酸的特性浓硫酸的三大特性〔腐蚀性〕:吸水性:能吸收现存的H2O,可用作某些气体的枯燥剂。





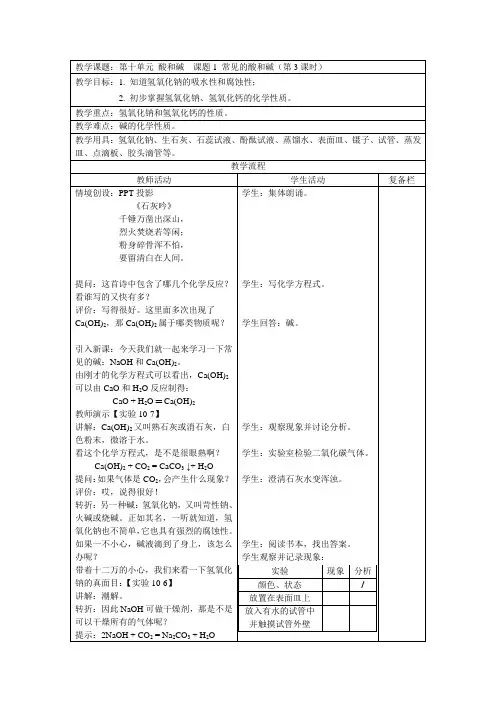
教学课题:第十单元酸和碱课题1 常见的酸和碱(第3课时)教学目标:1. 知道氢氧化钠的吸水性和腐蚀性;2. 初步掌握氢氧化钠、氢氧化钙的化学性质。
教学重点:氢氧化钠和氢氧化钙的性质。
教学难点:碱的化学性质。
教学用具:氢氧化钠、生石灰、石蕊试液、酚酞试液、蒸馏水、表面皿、镊子、试管、蒸发皿、点滴板、胶头滴管等。
教学流程教师活动学生活动复备栏情境创设:PPT投影《石灰吟》千锤万凿出深山,烈火焚烧若等闲;粉身碎骨浑不怕,要留清白在人间。
提问:这首诗中包含了哪几个化学反应?看谁写的又快有多?评价:写得很好。
这里面多次出现了Ca(OH)2,那Ca(OH)2属于哪类物质呢?引入新课:今天我们就一起来学习一下常见的碱:NaOH和Ca(OH)2。
由刚才的化学方程式可以看出,Ca(OH)2可以由CaO和H2O反应制得:CaO + H2O ═ Ca(OH)2教师演示【实验10-7】讲解:Ca(OH)2又叫熟石灰或消石灰,白色粉末,微溶于水。
看这个化学方程式,是不是很眼熟啊?Ca(OH)2 + CO2 = CaCO3↓+ H2O提问:如果气体是CO2,会产生什么现象?评价:哎,说得很好!转折:另一种碱:氢氧化钠,又叫苛性钠、火碱或烧碱。
正如其名,一听就知道,氢氧化钠也不简单,它也具有强烈的腐蚀性。
如果一不小心,碱液滴到了身上,该怎么办呢?带着十二万的小心,我们来看一下氢氧化钠的真面目:【实验10-6】讲解:潮解。
转折:因此NaOH可做干燥剂,那是不是可以干燥所有的气体呢?提示:2NaOH + CO2 = Na2CO3 + H2O 学生:集体朗诵。
学生:写化学方程式。
学生回答:碱。
学生:观察现象并讨论分析。
学生:实验室检验二氧化碳气体。
学生:澄清石灰水变浑浊。
学生:阅读书本,找出答案。
学生观察并记录现象:实验现象分析颜色、状态/放置在表面皿上放入有水的试管中并触摸试管外壁讲解:氢氧化钠只能干燥不与它发生反应的气体,如:N2、O2等。

课题1 常见的酸和碱(第3课时)【夯实基础】1、完成表格:(1)氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐步溶解,这种现象叫潮解。
潮解是物理变化。
(2)用途:可用作某些气体的干燥剂。
如:O2、N2、H2、CO、CH4、NH3,但不能干燥CO2、SO2。
(二)1、NaOH有强烈的腐蚀性,所以,它的俗名叫做苛性钠、火碱或烧碱。
2、如果不慎将碱液沾到皮肤上,应如何处理?要用较多的水冲洗,再涂上硼酸溶液。
3、注意:在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。
实验时最好戴防护眼镜。
4、氢氧化钠的用途:氢氧化钠是一种重要的化工原料,广泛应用于肥皂、造纸、石油、纺织和印染等工业。
氢氧化钠能够与油脂反应,在生活中可以去油污,如清洁剂就是利用的这一原理。
(三)1、氢氧化钙:白色粉末状固体;俗称:熟石灰或消石灰;溶解度:随温度升高而减小;2、Ca(OH)2微溶于水,其水溶液俗称石灰水;当石灰水中存在较多未溶解的熟石灰时,就称为石灰乳或石灰浆。
3、氢氧化钙俗称熟石灰或消石灰,可由生石灰与水反应制得。
氢氧化钙对皮肤、衣服有腐蚀作用。
使用时注意安全。
4、氢氧化钙在生产和生活中的用途:用作建筑材料、保护树木,防止冻伤,并防止害虫生卵、农业上制造波尔多液的原料和改良酸性土壤等。
5、常用的碱有:氢氧化钠、氢氧化钙、氢氧化钾 [KOH]、氨水[NH3·H2O] (无色液体)等。
两外还有两种经常用来中和胃酸的碱:Al(OH)3、Mg(OH)2。
二、碱的化学性质1、碱溶液能与指示剂反应:结论:紫色石蕊试液遇碱变蓝,无色酚酞试液遇碱变红。
2、碱与非金属氧化物作用:(1)石灰水与二氧化碳反应:现象:石灰水变浑浊。
反应方程式:Ca(OH)2+CO2=CaCO3↓+H2O。
(2)CO2与NaOH溶液反应反应方程式:2NaOH+CO2=Na2CO3+H2O。
思考:氢氧化钠为什么要密封保存?不仅吸收空气中的水分,还与空气中的二氧化碳反应。
1 常见的酸和碱(第三课时)教学目标1.知识与技能(1)知道几种常见酸和碱的主要性质和用途。
(2)会用酸碱指示剂检验溶液的酸碱性。
(3)认识酸和碱的腐蚀性及使用时的安全注意事项。
(4)能完成简单的探究实验。
2.过程与方法(1)进一步认识和体验科学探究的过程。
(2)运用实验的方法获取信息,运用比较概括等方法对获取的信息进行加工。
(3)增强对化学现象的探究欲,发展善于合作、勤于思考的科学精神。
3.情感态度与价值观进一步增强探究物质的好奇心和求知欲。
教学重点1.运用酸碱指示剂检验溶液的酸碱性。
2.酸碱各自相似的化学性质。
教学难点酸和碱各自具有相似化学性质的原因。
教学方法复习、总结、联系实际、实验探究、巩固练习。
教具准备教师用具:仪器:烧杯、玻璃棒、锥形瓶、双孔塞、分液漏斗、短玻璃导管、镊子、投影仪;药品:浓硫酸、鸡爪、NaOH溶液(20%)。
学生用具:仪器:滴管、研钵、烧杯、纱布、纸、小木棍、布、玻璃片、玻璃棒、点滴板、镊子、表面皿、蒸发皿、溶液导电性实验仪器;药品:食醋、稀盐酸、稀硝酸、稀硫酸、食盐水、石灰水、氢氧化钠溶液、紫色石蕊试液、无色酚酞试液、酒精、花(果实)、浓盐酸、浓硫酸、生锈的铁钉、NaOH固体、生石灰、蒸馏水。
课时安排课时第一课时:酸和碱溶液与酸碱指示剂的反应。
第二课时:几种常见酸和碱的主要性质和用途。
第三课时:酸和碱各自具有相似化学性质的原因。
教学过程[引入]通过上节课的活动与探究,我们知道酸碱各自具有相似的化学性质,它们为什么会具有相似的化学性质呢?[探究实验]采用导电仪分别试验盐酸、硫酸、硝酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、蒸馏水、乙醇的导电性。
[学生活动][交流探究结果][探究结果]蒸馏水和乙醇不导电,而盐酸、硫酸、硝酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液均能导电。
[设问]这些溶液为什么能导电?[联想]金属能导电的原因是什么?[学生回答]金属中存在着能自由移动的电子,电子带负电,在电场的作用下,电子定向运动产生电流。