弱酸弱碱盐的ph计算详细过程
- 格式:docx
- 大小:11.86 KB
- 文档页数:2

pH的简易计算之一
1.强酸、强碱溶液的pH之一
强酸:C——→[H+]——→pH
2.弱酸、弱碱溶液pH弱酸:
3.强酸与强酸混合液的pH
4.强碱与强碱混合液的pH
注意:不能这样计算.
如果已知两种强酸或两种强碱的pH,同样用上述方法来计算,而且有如下近似规律:
①两强酸等体积混合,混合液PH= pH小+0.3
②两强碱等体积混合,混合液pH=pH大-0.3
5.强酸与强碱混合液的pH:
①强酸与强碱正好完全反应,溶液呈中性,pH=7
再求pH= -lg[H+]余
最后求pH= -lg[H+]
6.酸碱溶液用水稀释后的pH
①强酸、强碱的稀释:在稀释时,当它们的浓度大于10-5mol·L-1时,不考虑水的电离;当它们的浓度小于10-5mol·L-1时,应考虑水的电离.
例如:pH=6的HCl溶液稀释100倍,混合pH≈7(不能大于7);
pH=8的NaOH溶液稀释100倍,混合pH≈7(不能小于7);
pH=3的HCl溶液稀释100倍,混合液pH=5;
pH=10的NaOH溶液稀释100倍,混合液pH=8.
②弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范围.
例如:pH=3的CH3COOH溶液,稀释100倍,稀释后3<pH<5;
pH=10的NH3·H2O溶液,稀释100倍,稀释后8<pH<10;
pH=3的酸溶液,稀释100倍,稀释后3<pH<5;
pH=10的碱溶液,稀释100倍,稀释后8≤pH<10;。


弱酸弱碱盐ph的计算公式
弱酸弱碱盐的 pH 值可以通过 Henderson-Hasselbalch 方程来
计算。
该方程的一般形式为 pH = pKa + log([A-]/[HA]),其中
pKa 是该弱酸或弱碱的离解常数的负对数,[A-] 是盐的共轭碱离子
的浓度,[HA] 是盐的共轭酸的浓度。
这个公式可以用于计算弱酸弱
碱盐在不同浓度下的 pH 值。
另外,如果你知道弱酸或弱碱盐的化学式,你也可以通过计算
其离子在水中的浓度并应用 pH = -log[H+] 这一公式来计算 pH 值。
在这种情况下,你需要考虑该盐在水中的离解情况,计算出溶液中
氢离子的浓度,然后求出 pH 值。
需要注意的是,这些计算都是基于理想条件下的模型,实际情
况可能会受到温度、离子强度等因素的影响。
因此,在实际应用中,需要结合实验数据和其他因素进行综合考虑。
希望这些信息能够帮
助到你理解弱酸弱碱盐 pH 值的计算方法。
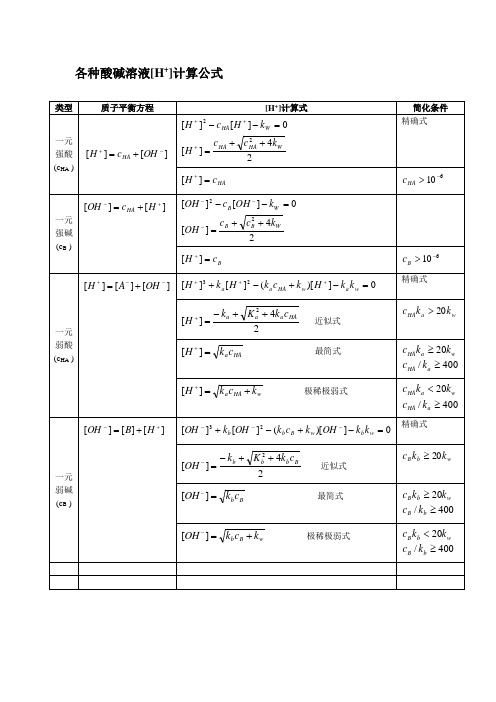
各种酸碱溶液[H+]计算公式类型质子平衡方程[H+]计算式简化条件一元强酸(c HA )][][-++=OHcHH A24][][][22WHAHAWHAkccHkHcH++==--+++精确式H AcH=+][610->HAc一元强碱(c B )][][+-+=HcOHH A24][][][22WBBWBkccOHkOHcOH++==-----BcH=+][610->Bc一元弱酸(c HA )][][][--++=OHAH0])[(][][23=-+-++++wawH AaakkHkckHkH精确式24][2HAaaackKkH++-=+近似式waH Akkc20>HAackH=+][最简式400/20≥≥aHAwaHAkckkcwHAakckH+=+][极稀极弱式400/20≥<aHAwaHAkckkc一元弱碱(c B )][][][+-+=HBOH0])[(][][23=-+-+---wbwBbbkkOHkckOHkOH精确式24][2BbbbckKkOH++-=-近似式wbBkkc20≥BbckOH=-][最简式400/20≥≥bBwbBkckkcwBbkckOH+=-][极稀极弱式400/20≥<bBwbBkckkc类型质子平衡方程[H+]计算式简化条件二元弱酸(c H2A )][][2][][2---+++=OHAHAH])[2(])[(][][21211212131422=-+---++++++waaAHaawawAHaaaakkkHckkkkHkckkkHkH精确式24][21211AHaaackKkH++-=+近似式400/2005.021122<≥<aAHwaHAaakckkcckkAHackH21][=+最简式400/2005.02111222≥≥<aAHwaAHaakckkcckk酸式盐NaHA c][][][][22--++=+OHAAHH][)][(][)][(])[(][1212112--+--+++=+=+HAkkHAkkHkHAkkHAkHawaawaaa精确式ckkckkHawaa++=+121)(][近似式[HA-]=cckckkHaaa+=+121][wakckcHA20][2≥=-21][aakkH=+122020][awakckckcHA≥≥=-弱酸弱碱盐NH4Acc3'3][][][][NHwa kkkOHNHHAcH=+=+-+][)][(][4'-++++=AckkNHkkHawaa精确式ckkckkHawaa++=+)(]['[Ac-]=[NH4+]=cckckkHaaa+=+'][wkcka20['≥'][aakkH=+awakckck2020'≥≥类型质子平衡方程[H+]计算式简化条件氨基酸ckkckkHawaa++=+121)(][近似式C为氨基酸的浓度ckckkHaaa+=+121][wakck202≥21][aakkH=+122020awakckck≥≥混合酸强酸c1+弱酸c2][][][][---+++=OHAClH2)(4)()(][21211aaakcckckcH++-+-=弱酸HAc1+弱酸HBc2][][][][---+++=OHBAH21][cKcKHH BH A+≈+[A-]=c1, [B-]=c2=缓冲溶液弱酸HB(c A)+共轭碱B-(c B)][][])[][(][-+-++-++-=OHHcOHHckHBAaBAa cckH=+][C A>> [OH-]-[H+]C B>>[H+]-[OH-]弱碱B-(c B)+共轭酸HB(c A)ABb cckOH=-][。

pH的计算的技巧总结1.简单酸碱溶液的pH由pH= -lg[H+],只要求得[H+]即可。
(1)一元强酸:[H+]=C酸二元强酸:[H+]=2C酸弱酸:[H+]=Cα,再求pH。
(α为弱酸的电离度)(2)一元强碱[OH-]=C碱,二元强碱:[OH-]=2C碱,2.强酸,强碱的稀释(1)强酸稀释过程pH增大,可先求稀释后溶液的[H+],再求pH。
(2)强碱稀释后pH减小,应先求稀释后,溶液中的[OH-],再求[H+],才能求得pH。
(3)极稀溶液应考虑水的电离。
酸溶液pH不可能大于7,碱溶液pH不可能小于7。
3.强酸、强碱溶液的混合等体积混合时:若pH相差2个单位以上“pH混=pH小+0.3”推导过程:有0.100mol/L 和0.001mol/L的盐酸溶液等体积混合,求混合后的pH值是多少?0.100mol/L 盐酸溶液的pH=1,0.001mol/L 盐酸溶液的pH=3设两种溶液都有1L,则c(H+)= [(0.100+0.001)÷2] mol/LpH= log [(0.100+0.001)÷2]= [log (0.100+0.001) log 2]= log (0.100+0.001) +log 2log (0.100+0.001) ≈log 0.100=1log 2 = 0.3010所以:pH混=pH小+0.3若pH相差1个单位“pH混=pH小+0.26”推导过程:有0.100mol/L 和0.010mol/L的盐酸溶液等体积混合,求混合后的pH值是多少?0.100mol/L 盐酸溶液的pH=1,0.010mol/L 盐酸溶液的pH=2设两种溶液都有1L,则c(H+)= [(0.100+0.010)÷2] mol/L= 0.055 mol/LpH= log 0.055= log (0.1×0.55)= (log 0.100 +log 0.55)log 0.100=1log 0.55 = 0.2596所以:pH混=pH小+0.26(2)两强碱混合:等体积混合时:若pH相差2个单位以上“pH混=pH大-0.3”推导过程:若pH相差1个单位“p H混=pH大-0.26”(3)强酸、强碱溶液混合:若恰好中和,溶液pH=7。

强碱弱酸盐的ph计算方法
PH值是一个标准可以用来表明溶液的强度程度的指标。
它可以用来衡量强碱弱酸盐的酸碱性,该种指标越接近7表明溶液越接近中性,也就是说它既不是强酸也不是强碱,而在7
以下代表强酸,7以上代表强碱。
PH计算是根据溶液中阳离子H+ 和阴离子OH-的浓度求出的。
主要的计算公式如下:
PH= -log [H+]
其中log是以10为底的对数, [H+] 是H+离子的浓度,单位是mol / L。
根据上式可以知道,H+浓度越高,PH值就越小;H+浓度越低,PH值就越大。
另外,我们还可以采用Kw公式来计算强碱弱酸盐的PH值。
Kw公式如下:
Kw=[H+][OH-]=1.0 × 10-14
Kw公式表明,水分解离子对的平衡常数等于H+和OH-浓度相乘之积等于1.0× 10-
14mol/L。
我们可以利用这个公式计算得出强酸弱碱盐的PH值:
PH = -log[H+] = 14 - log Kw - log[OH-]
以上就是计算强碱弱酸盐的PH值的方法。
从理论上讲,PH值能够反映强碱弱酸盐的强度,因此,它被广泛用来检测某些溶液的强度程度,比如:食品、饮料、海水、土壤等等。
弱酸ph值计算公式
弱酸pH值计算公式是一种能够计算出溶液中酸的强弱程度的重要工具。
它的定义是:根据溶液当量的共价酸离子和不结合离子的浓度,通过等价度定律计算出溶液的pH值。
弱酸pH值计算公式公式如下:
等价度定律
pH=-log[H+(A-)]
其中,[H+]表示共价酸离子的浓度,[A-]表示不结合离子的浓度。
这个计算公式的本质是计算[H+]和[A-]的比值。
因为[H+]的浓度是非常微小的(10^-7~10^-14),它们的比值可以用log(对数)表示。
弱酸pH值计算公式的应用广泛,几乎涉及到生物化学所有领域。
例如,在研究酶如何在细胞体内作用,可以利用这个公式计算出细胞体内的pH值;在研究植物和动物细胞代谢时,可以用这个公式计算出细胞内细胞色素p的浓度。
另外,这个公式也可以用于实验室中研究各种种类的溶液,如硫酸溶液、盐酸溶液、氯化物溶液等的pH值。
此外,在实际应用中,弱酸pH值计算公式也可以用于调整溶液的酸碱度,以达到最佳的化学性能。
例如,在研究水的资源利用时,可以利用这个公式对水进行pH值调整,以达到最佳的产水效果;在洗衣服时,也可以用这个公式计算出最佳的洗衣液pH值,以获得最佳的清洁效果。
总之,弱酸pH值计算公式是一种重要的工具,它可以让我们计
算出溶液中酸的强弱程度,并可以用于优化溶液的酸碱度,以达到最佳的化学性能。
计算一元弱酸或弱碱溶液ph值的新公式PH值计算公式
1. 对于强酸:
PH = -log[H^+]
2. 对于弱酸:
PH = -log[(H^{+})(A^{-})^{Ka}]
3. 对于强碱:
PH = 14 - log[OH^-]
4. 对于弱碱:
PH = 14 + log[(OH^{-}) (B^{+})^{Kb}]
以上是确定一元弱酸或弱碱溶液PH值所用的公式。
弱酸的pH值,需要使用此公式:
PH = -log[(H^{+})(A^{-})^{Ka}], 其中Ka是弱酸的平衡常数;
而弱碱溶液的PH值,需要使用另一个公式:
PH = 14 + log[(OH^{-}) (B^{+})^{Kb}], 其中Kb是弱碱的平衡常数。
为了计算一元弱酸或弱碱溶液的PH值,需要先知晓相应分子式、以及这些分子式形成不同有机物时,酸性和碱性的反应强度(即用平衡常数K表示,如Ka和Kb),才能使用以上公式正确的计算出PH值。
例如一种典型的弱碱,乙醇氮基聚磷酸盐(EDTP),它的平衡常数
Kb为7.4×10-9,此时,我们可以使用公式14 + log[(OH^{-}) (B^{+})^{Kb}]计算,其PH值为9.225。
弱酸弱碱盐的ph计算详细过程
计算弱酸弱碱盐的pH需要用到电离平衡常数和离子积常数。
首先,我们需要了解电离平衡常数和离子积常数的定义和计算方法。
1.电离平衡常数(Ka)是弱酸在水溶液中电离出的氢离子与未电离的弱酸分子之间的平衡常数,其大小与温度有关。
2.离子积常数(Kw)是水溶液中氢离子浓度与氢氧根离子浓度之间的平衡常数,其大小与温度有关。
3.对于弱酸弱碱盐,其电离平衡常数不仅与温度有关,还与盐的组成有关。
假设该盐为AB,其中A为弱酸根,B为弱碱阳离子。
则该盐的电离平衡常数可以表示为:
Ka(AB) = Ka(A) × Kb(B)
其中,Ka(A)为弱酸A的电离平衡常数,Kb(B)为弱碱B的电离平衡常数。
在已知盐的组成的情况下,可以通过查找相关文献或计算得到Ka(A)和Kb(B)的值。
然后,我们可以利用电离平衡常数和离子积常数计算出该盐在水溶液中的pH值。
假设该盐的浓度为c mol/L,则其水溶液中的氢离子浓度可以表示为:
c(H+) = √(c × Ka × Kw)
其中,c为盐的浓度,Ka为该盐的电离平衡常数,Kw为水的离子积常数。
最后,我们可以利用上述公式计算出该盐在水溶液中的pH值。
需要注意的是,由于水的离子积常数会随着温度的变化而变化,因此在实际计算中需要考虑温度的影响。