高中化学第19讲 电解池 金属的电化学腐蚀与防护(精练)-2022年一轮复习讲练测(解析版)
- 格式:docx
- 大小:545.95 KB
- 文档页数:15


金属电化学腐蚀与防护一、单选题(共17题)1.根据所学习的电化学知识,下列说法正确的是A.酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀B.太阳能电池板的主要材料为二氧化硅C.水库的钢闸门与电源正极连接可实现电化学保护D.智能手机常用的锂离子电池属于一次电池2.生锈会造成钢铁制品或结构的劣化。
下列措施中,不利于防止生锈的是A.在不锈钢的表面形成一层致密三氧化二铬表层B.用混凝土包裹钢筋,混凝土使钢筋保存在碱性的环境中C.在汽车上喷上油漆涂料D.用锡箔沾水摩擦生锈的部份做抛光处理3.下列有关实验操作、现象及结论都正确的是A.A B.B C.C D.D 4.关于下列各装置图的叙述错误的是A.用图①装置精炼铜,b极为精铜,电解质溶液为CuSO4 溶液B.图②装置盐桥中KCl的K+ 移向乙烧杯C.图③装置中钢闸门应与外接电源的负极相连,称之为“牺牲阳极的阴极保护法”D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同5.下列各容器中盛有海水,则铁被腐蚀的速率由快到慢的顺序是A.④>②>①>③>⑤>⑥B.⑤>④>②>③>①>⑥C.④>⑥>②>①>③>⑤D.⑥>③>⑤>②>④>①6.我国突飞猛进的新科技深刻改变着人类的生活、生产方式。
下列说法错误的是A.“中国天眼”的镜片材料为SiC,属于新型无机非金属材料B.北斗导航专用ASIC硬件结合国产处理器打造出一颗真正意义的“中国芯”,其主要成分为SiO2C.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法D .我国自主研发的东方超环(人造太阳)使用的氚、氘与氕互为同位素7.化学创造美好生活。
下列生产活动中,没有运用相应化学原理的是A .AB .BC .CD .D8.下列反应对应的方程式正确的是A .用碳酸钠溶液处理锅炉水垢(CaSO 4):CaSO 4(s)+2-3CO (aq)⇌CaCO 3(s)+2-4SO (aq)B .用FeS 处理含Hg 2+的废水:Hg 2++S 2-=HgS↓C .用Fe 电极电解NaOH 溶液的阳极反应:4OH --4e -=O 2↑+2H 2OD .Cu 在酸性环境中腐蚀的正极反应:2H ++2e -=H 2↑9.下列用来表示物质变化的化学用语中,正确的是A .钢铁发生电化学腐蚀的负极反应式:Fe-2e -=Fe 2+B .氢氧燃料电池的负极反应式:O 2+2H 2O+4e -=4OH -C .粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e -=Cu 2+D .粗铜精炼时,阳极泥中可能含有的金属有 Au Ag Zn10.下列现象中,不是由于原电池反应造成的是A .含杂质的锌与盐酸反应比纯锌与盐酸反应速率快B .钢铁在潮湿的空气中易腐蚀C .纯铁和盐酸反应,如滴入几滴硫酸铜溶液,则可加快反应速率D .化工厂中的铁锅炉易腐蚀而损坏11.化学知识无处不在,下列家务劳动涉及的化学知识错误的是A.A B.B C.C D.D12.下列有关金属腐蚀和防护的说法,正确的是A.金属发生的化学腐蚀比电化学腐蚀要普遍得多B.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都比较差C.钢铁发生吸氧腐蚀时,负极反应是Fe-3e-=Fe3+D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法~)作用下,能被13.深埋在潮湿土壤中的铁制管道,在硫酸盐还原菌(最佳生存环境为pH78 2SO-腐蚀,其电化学腐蚀原理如图所示。


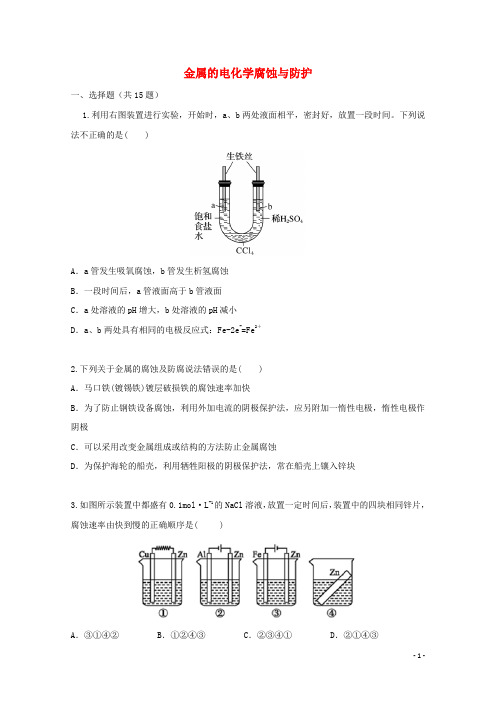
金属的电化学腐蚀与防护一、选择题(共15题)1.利用右图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。
下列说法不正确的是( )A.a管发生吸氧腐蚀,b管发生析氢腐蚀B.一段时间后,a管液面高于b管液面C.a处溶液的pH增大,b处溶液的pH减小D.a、b两处具有相同的电极反应式:Fe-2e-=Fe2+2.下列关于金属的腐蚀及防腐说法错误的是( )A.马口铁(镀锡铁)镀层破损铁的腐蚀速率加快B.为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极C.可以采用改变金属组成或结构的方法防止金属腐蚀D.为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块3.如图所示装置中都盛有0.1mol·L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是( )A.③①④②B.①②④③C.②③④①D.②①④③4.支撑海港码头基础的钢管桩,常用外加电流的阴极促护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。
下列有关表述不正确的是( )A.通电后外电路电子被强制从高硅铸铁流向钢管桩B.通入保护电流使钢管桩表面腐蚀电流接近于零C.通入的保护电流应该根据环境条件变化进行调整D.高硅铸铁的作用是作为损耗阳极材料和传递电流5.将金属M 连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。
在题图所示的情境中,下列有关说法正确的是A.钢铁设施的电极反应式为Fe 2e Fe2B.金属M 的活动性比 Fe 的活动性弱C.钢铁设施表面因积累大量电子而被保护D.钢铁设施在河水中的腐蚀速率比在海水中的快6.一定条件下,碳钢腐蚀与溶液pH的关系如下:pH 2 4 6 6. 5 8 13. 5 14腐蚀快慢较快慢较快FeO主要产物Fe2+Fe3O4Fe2O3-2下列说法不正确的是A.在pH<4的溶液中,碳钢主要发生析氢腐蚀B.在pH>6的溶液中,碳钢主要发生吸氧腐蚀C.在pH>14的溶液中,碳钢腐蚀的反应为O2+4OH-+4e-===2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢7.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:分析图像,以下结论错误的是()A.溶液pH≤2时,生铁发生析氢腐蚀B.在酸性溶液中生铁可能发生吸氧腐蚀C.析氢腐蚀和吸氧腐蚀的速率一样快,D.两溶液中负极反应均为Fe-2e→Fe2+8.如图是研究铁被海水腐蚀的实验装置。

金属的腐蚀与防护1.下列有关金属腐蚀的说法中正确的是()A.金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生2.下列关于钢铁腐蚀说法正确的是( )A.电化学腐蚀是造成钢铁腐蚀的主要原因B.钢铁腐蚀的负极为Fe-3e-=Fe3+C.弱酸性条件下钢铁发生析氢腐蚀D.镀锡铁器破损时镀层金属仍可以保护铁器3.下列有关镀锌钢管(锌盐溶液作电解质溶液)的说法正确的是( )A.电镀时,钢管作阳极,锌棒作阴极B.钢管镀锌过程中,阴阳两极的质量变化一定不相等C.镀锌的目的是在钢管表面形成Fe—Zn合金,增强钢管的耐腐蚀能力D.钢管镀锌过程中,阴极的电极反应式为Zn2++2e-=Zn4.化学与生活、生产有着密切关系,下列叙述中正确的是()A.钢铁发生析氢腐蚀时,H+得电子释放出H2,钢铁被腐蚀B.钢铁发生吸氧腐蚀时,OH-失电子释放出O2,钢铁被腐蚀C.船底镶嵌锌块,锌发生还原反应而被消耗,以保护船体D.外加电源的正极连接在海水中的钢铁闸门上,可保护闸门5.某地下了一场酸雨,在这种环境中的铁制品极易被腐蚀。
对该条件下铁制品发生电化学腐蚀的叙述正确的是( )A.该电化学腐蚀是析氢腐蚀B.正极反应式:O 2+4e-=2O2-C.原电池反应减缓了铁制品的腐蚀D.负极反应式:Fe-3e-=Fe3+6.如图所示的钢铁腐蚀中,下列说法正确的是( )A.碳表面发生还原反应B.钢铁被腐蚀的最终产物为FeOC.生活中钢铁制品的腐蚀以图①所示为主D.图②中,正极反应式为O2+4e-+2H2O═4OH-7.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的久置的雨水和生铁片。
实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。
湖南省长沙市高考化学一轮基础复习:专题19 电解池金属的腐蚀与防护姓名:________ 班级:________ 成绩:________一、单选题 (共10题;共20分)1. (2分)钢铁腐蚀在生活和生产中相当普遍。
下列措施能防止钢铁腐蚀的是()A . 把钢铁雕塑焊接在铜质基座上B . 将输送自来水的铁管表面镀锌C . 经常用自来水冲洗钢铁制品D . 将输油铸铁管道埋在潮湿、疏松的土壤中2. (2分)电化学腐蚀的本质是()A . 氧化还原反应B . 酸碱中和反应C . 置换反应D . 分解反应3. (2分) (2015高二上·怀化期末) 用石墨作电极,电解1mol•L﹣1下列物质的溶液,溶液pH变大的是()A . HClB . H2SO4C . NaClD . Na2SO44. (2分) (2016高二上·临漳期中) 串联电路中四个电解池分别装有0.5mol•L﹣1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最大的是()A . KNO3溶液B . NaCl溶液C . AgNO3溶液D . CuCl2溶液5. (2分)利用如图所示装置电解1L1mol•L﹣1的含酚酞的饱和食盐水,下列有关说法正确的是()A . 电键K置于N处,若X为铜棒,可实现铁棒免受腐蚀B . 电键K置于N处,若X为锌棒,铁棒上发生的电极反应式为O2+2H2O+4e﹣═4OH﹣C . 电键K置于M处,若X为碳棒,碳棒附近溶液变红D . 电键K置于M处,若X为铜棒,可实现在铁棒上镀铜6. (2分) (2016高二上·通化期中) 以惰性电极电解 CuSO4 溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为.()A . 0.64gB . 1.28gC . 2.56gD . 5.12g7. (2分)能正确表示下列反应的离子方程式为:()A . 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑B . 碳酸氢铵溶于过量的烧碱溶液中:HCO3-+OH-=CO32-+H2OC . 少量二氧化硫通入次氯酸钠溶液中:2ClO-+SO2+H2O= 2HClO+SO32-D . 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O8. (2分) (2017高二上·鸡西期末) 研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2﹣CaO 作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是()A . 由 TiO2 制得 1 mol 金属 Ti,理论上外电路通过 2 mol 电子B . 阳极的电极反应式为 C+2O2﹣﹣4e﹣═CO2↑C . 在制备金属钛前后,整套装置中 CaO 的总量减少D . 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接 Pb 电极9. (2分) (2019高一上·永春期中) 电解饱和食盐水,2NaCl+2H2O H2↑+Cl2↑+2NaOH 生成4mol 的NaOH,(a为饱和食盐水),下列说法正确的是()A . 在X极生成2mol Cl2B . 在X极生成2molH2C . 在Y极生成4mol Cl2D . NaOH在Y极生成10. (2分)下列叙述正确的是()A . 在铁件上镀铜时,金属铜作阴极B . 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为CH3OH+6OH﹣+6e﹣═CO2+5H2OC . 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快D . 电解精炼铜时,电解质溶液中铜离子浓度保持不变二、填空题 (共2题;共10分)11. (4分)铜及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS).写出CuSO4转变为铜蓝的离子方程式________ 。
第六章 化学反应与能量第19讲 电解池 金属的电化学腐蚀与防护(精练)完卷时间:50分钟可能用到的相对原子质量:H1 N14 O16 Na23 S32 Cl35.5 K39 Cu64一、选择题(每小题只有一个正确选项,共12*5分)1.(2021·山东潍坊市·高三三模)将电化学法和生物还原法有机结合,利用微生物电化学方法生产甲烷,装置如图所示。
下列说法错误的是A .离子交换膜可允许H +通过B .通电时,电流方向为:a →电子导体→离子导体→电子导体→bC .阳极的电极反应式为--+322C 6=H COO +2H O-e 2CO +7HD .生成0.1molCH 4时阳极室中理论上生成CO 2的体积是4.48L(STP)【答案】C【解析】由图示知,左池中CH 3COO -在电极上失电子被氧化为CO 2,故左池为电解的阳极室,右池为电解的阴极室,电源a 为正极,b 为负极。
A .由图示知,阳极反应产生H +,阴极反应消耗H +,故H +通过交换膜由阳极移向阴极,A 正确;B .这个装置中电子的移动方向为:电源负极(b)→电解阴极,电解阳极→电源正极(a),故电流方向为:电源正极(a)→外电路(电子导体)→电解质溶液(离子导体,阳极→阴极)→外电路(电子导体)→电源负极(b),形成闭合回路,B 正确;C .由分析知,左池为阳极,初步确定电极反应为:CH 3COO --8e -→2CO 2↑,根据图示知可添加H +配平电荷守恒,添加H 2O 配平元素守恒,得完整方程式为:CH 3COO --8e -+2H 2O →2CO 2↑+7H +,C 错误;D .由图示知,右池生成CO 2转化为CH 4,根据转移电子关系CH 4~8e -,0.1 mol CH 4生成转移0.8 mol 电子,由C 选项知:CO 2~4e -,故生成CO 2的n (CO 2)=0.8 mol =0.2 mol 4,故V (CO 2)=0.2 mol ×22.4 L/mol=4.48 L ,D 正确;故答案选C 。
2.(2021·辽宁高三三模)如图是电化学膜法脱硫过程示意图,电化学膜的主要材料是碳和熔融的碳酸盐。
下列说法错误的是A .工作一段时间后,生成H 2和S 2的物质的量之比为2:1B .净化气中CO 2含量明显增加,是电化学膜中的碳被氧化C .阴极反应式为H 2S+2e -=S 2-+H 2↑D .b 电极为阳极,发生氧化反应【答案】B【解析】由图示可知,该装置为电解池,H 2S 发生反应生成S 2-和H 2,可知a 电极为阴极,电极反应式为H 2S+2e -=S 2-+H 2↑,则b 电极为阳极,S 2-在阳极失去电子发生氧化反应生成S 2,电极反应式为2 S 2--4e -= S 2。
A .根据得失电子守恒可知,电解池上作一段时间后,转移相同物质的量的电子时,生成H 2和S 2的物质的量之比为2:1,故A 正确;B .H 2S 是酸性气体,能够和熔融碳酸盐反应生成CO 2,所以净化气中CO 2含量明显增加,故B 错误;C .由上述分析可知,阴极的电极反应式为H 2S+2e -=S 2-+H 2↑,故C 正确;D .由上述分析可知,b 电极为阳极,阳极上发生的是氧化反应,故D 正确;故选B 。
3.(2021·江西南昌市·高三二模)北京化工大学新开发的一种流动电池如图所示,其原理是:224442PbO 2H SO Cu PbSO CuSO 2H O ++=++,该电池的主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。
下列说法不正确的是A .b 为该电池的负极B .a 电极的反应式为:22442PbO 4H SO 2e PbSO 2H O +--+++=+C .当电池工作时,a b 、两电极的质量之和几乎不变D .调节电解质溶液,即补充一定量的24H SO 溶液和4CuSO 溶液【答案】D【解析】A .根据224442PbO 2H SO Cu PbSO CuSO 2H O ++=++分析铜化合价升高,是原电池的负极,因此b 为该电池的负极,故A 正确;B .根据总反应方程式a 极是PbO 2得到电子,因此a 电极的反应式为:22442PbO 4H SO 2e PbSO 2H O +--+++=+,故B 正确;.224442PbO 2H SO Cu PbSO CuSO 2H O ++=++,当电池工作时,a 极由1mol PbO 2变为1mol PbSO 4,质量相当增加了1mol SO 2即64g ,b 极减少1mol Cu 即64g ,因此a b 、两电极的质量之和几乎不变,故C 正确;D .24H SO 在不断消耗,因此调节电解质溶液,即补充一定量的24H SO 溶液,故D 错误。
综上所述,答案为D 。
4.(2021·广东汕头市·高三二模)2021年3月5日,李克强总理在国务院政府报告中指出,扎实做好碳达峰、碳中和各项工作。
科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO 2转化为CO ,实现节能减排的目标。
如图所示,下列有关说法正确的是A .N 极为阴极B .离子交换膜为阴离子交换膜C .阳极的电极反应式为CO 2+2e -+2H +=CO+H 2OD .理论上该装置在工作时,H 3PO 4与KH 2PO 4缓冲溶液的pH 保持不变【答案】D【解析】由图示知,该装置外电路有光伏电池(将太阳能转化为电能),故为电解池装置,在P 极上,CO 2得电子转化为CO ,故P 极为阴极,N 极为阳极,阴极电极反应为:CO 2+2H ++2e -=CO+H 2O ,需要缓冲溶液提供H +,故离子交换膜为阳离子交换膜,阳极电极反应为:2H 2O-4e -=O 2↑+4H +。
A .由分析知,N 极为阳极,A 错误;B .由分析知,离子交换膜为阳离子交换膜,B 错误;C .由分子知,CO 2在阴极转化为CO ,故选项所写电极反应为阴极电极反应,C 错误;D .根据得失电子守恒和阴阳极电极反应知,缓冲溶液流入阴极的H +和阳极流入缓冲溶液的H +数目相等,故缓冲溶液中c (H +)保持不变,故pH 保持不变,D 正确;故答案选D 。
5.(2021·黑龙江高三二模)次磷酸钴[Co(H 2PO 2)2]广泛应用于化学电镀,工业上利用电渗析法制取次磷酸钴的原理如图所示。
下列说法中正确的是A .b 为电源的负极,膜Ⅱ为阴离子交换膜B .当阴极生成224mL(标准状况)气体时,通过膜Ⅲ的离子的物质的量为0.01molC .M 电极反应为Co+2-22H PO -2e -=Co(H 2PO 2)2 D .电解过程中,阴极室c (NaOH)逐渐增大【答案】D【解析】膜Ⅰ和膜Ⅲ之间为产品室,-22H PO 经膜Ⅲ进入产品室,膜Ⅲ为阴离子交换膜,Co 2+经膜Ⅰ进入产品室,则M 为Co ,为电解池的阳极,则a 为电源的正极,N 为阴极,b 为电源的负极,膜Ⅱ为阳离子交换膜,防止OH -进入原料室消耗-22H PO 。
A .根据分析,b 为电源的负极,膜Ⅱ为阳离子交换膜,故A 不符合题意;B .b 为电源的负极,N 为阴极,电极反应为:2H 2O+2e -=H 2↑+2OH -,当阴极生成224mL(标准状况)气体时,n (H 2)=m V V =0.224L 22.4L/mol=0.01mol ,转移的电子的物质的量为0.02mol ,-22H PO 带一个单位的负电荷,故通过膜Ⅲ的离子的物质的量为0.02mol ,故B 不符合题意;C .M 为Co ,为电解池的阳极,M 电极产生Co 2+,反应为Co-2e -=Co 2+,故C 不符合题意;D .电解过程中,阴极反应为:2H 2O+2e -=H 2↑+2OH -,产生了OH -,膜Ⅱ为阳离子交换膜,Na +进入阴极,阴极室c (NaOH)逐渐增大,故D 符合题意;答案选D 。
6.(2021·四川泸州市·高三二模)已知Fe 2+与H 2O 2溶液混合发生Fenton 反应生成氧化性很强的羟基自由基(•OH),可将CN -氧化为低毒的CNO -,实现废水处理的目的。
三维电极电解-Fenton 反应处理废水的原理如图所示,多孔焦炭电极将整个电解槽变成了许多微电解池。
下列说法错误的是A.钛合金电极反应式为2H2O- 2e- =2H++2•OHB.阴极电极反应式为O2+ 2H++ 2e - = H2O2C.焦炭电极表面能产生•OH使废水处理效率提高D.Fe(OH)2+能在钛合金电极实现再生循环利用【答案】D【解析】由图示知,钛合金电极连接电源正极,作电解的阳极,H2O在电极表面放电生成·OH和H+,电极反应为:2H2O-2e-=2H++2·OH,石墨电极为电解的阴极,O2在电极表面得电子生成H2O2,电极反应为:O2+2e-+2H+=H2O2。
A.由分析知,A正确;B.由分析知,B正确;C.多孔焦炭电极将整个电解槽变成许多微电解池,其作阳极的部分对应电极反应与钛合金电极相同,也可产生·OH,使废水处理效率提高,C正确;D.Fe(OH)2+中Fe元素为+3价,变回Fe2+需得电子,故可在石墨电极(阴极)上再生循环,D错误;故答案选D。
7.(2021·天津高三一模)近期,天津大学化学团队以CO2与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图。
下列说法正确..的是A.Ni2P电极与电源负极相连B.辛胺转化为辛腈发生了还原反应C.In/In2O3-x电极上可能有副产物H2生成D.在In/In2O3-x电极上发生的反应为CO2+H2O-2e-=HCOO-+OH-【答案】C【解析】A.根据电解质“异性相吸”原理,氢氧根向Ni2P电极移动,说明Ni2P电极为阳极,与电源正极相连,故A错误;B.左侧CO2变为HCOO-,化合价降低,发生还原反应,则辛胺在阳极转化为辛腈发生了氧化反应,故B错误;C.In/In2O3-x电极为阴极,阴极可能有氢离子得到电子,因此可能有副产物H2生成,故C正确;D.In/In2O3-x电极为阴极,根据图中信息,阴极上发生的反应为CO2+H2O+2e-=HCOO-+OH-,故D 错误。
综上所述,答案为C。
8.(2020·吉林长春市·东北师大附中高三二模)为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:2Zn+2H2O+O2=2Zn(OH)2,下列说法正确的是A.锌块发生还原反应而被腐蚀B.船体与海水中的NaCl等发生反应C.正极的电极反应式为:2H2O+2e-=H2↑+2OH-D.该抵御措施称为牺牲阳极的阴极保护法【答案】D【解析】A.在船体上安装大型的锌块可以构成锌铁海水原电池,锌的金属性强于铁,锌做负极,失去电子发生氧化反应而被腐蚀,故A错误;B.在船体上安装大型的锌块可以构成锌铁海水原电池,反应的实质是锌与海水中溶解的氧气反应,不与海水中的NaCl等发生反应,故B错误;C.在船体上安装大型的锌块可以构成锌铁海水原电池,氧气在正极上得到电子发生还原反应,电极反应式为O2+4e-+2H2O =4OH-,故C错误;D.在船体上安装大型的锌块可以构成锌铁海水原电池保护船体的措施为牺牲阳极的阴极保护法,故D正确;故选D。