第十章 固体结构
- 格式:ppt
- 大小:8.78 MB
- 文档页数:77

大连理工大学《无机化学》自测练习题第十章:固体结构一、判断1、固体物质可以分为晶体和非晶体两类。
............................................................(√)2、仅依据离子晶体中正负离子半径的相对大小即可决定晶体的晶格类型。
. ............................. ............................. ............................. ................................ (×)3、自然界存在的晶体或人工制备的晶体中,所有粒子都是按照一定规律有序排列的,没有任何缺陷。
............................. ............................. ..................................(×)4、在常温常压下,原子晶体物质的聚集状态只可能是固体................................(√)5、某物质可生成两种或两种以上的晶体,这种现象叫做类质多晶现象。
........(×)1、√2、×3、×4、√5、×二、单选题1、下列物质的晶体结构中既有共价键又有大p键和分子间力的是....................(C)(A) 金刚砂;(B) 碘;(C) 石墨;(D) 石英。
2、氯化钠晶体的结构为.... ............................. ......................................................(B)(A) 四面体;(B) 立方体;(C) 八面体;(D) 单斜体。
3、下列各组离子中极化力由大到小的顺序正确的是. .........................................(B)(A) Si4+ > Mg2+ > Al3+ > Na+;(B) Si4+ > Al3+ > Mg2+ > Na+;(C) Si4+ > Na+ > Mg2+ > Al3+;(D) Na+ > Mg2+ > Al3+ > Si4+。
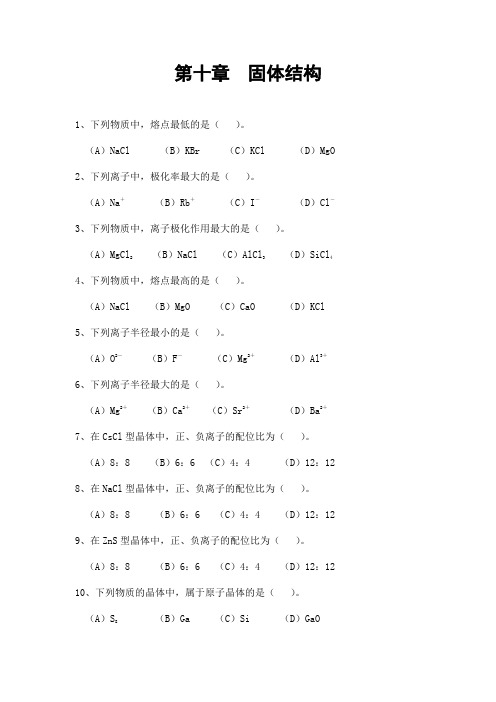
第十章固体结构1、下列物质中,熔点最低的是()。
(A)NaCl (B)KBr (C)KCl (D)MgO 2、下列离子中,极化率最大的是()。
(A)Na+(B)Rb+(C)I-(D)Cl-3、下列物质中,离子极化作用最大的是()。
(A)MgCl2(B)NaCl (C)AlCl3(D)SiCl44、下列物质中,熔点最高的是()。
(A)NaCl (B)MgO (C)CaO (D)KCl 5、下列离子半径最小的是()。
(A)O2-(B)F-(C)Mg2+(D)Al3+6、下列离子半径最大的是()。
(A)Mg2+(B)Ca2+(C)Sr2+(D)Ba2+7、在CsCl型晶体中,正、负离子的配位比为()。
(A)8:8 (B)6:6 (C)4:4 (D)12:12 8、在NaCl型晶体中,正、负离子的配位比为()。
(A)8:8 (B)6:6 (C)4:4 (D)12:12 9、在ZnS型晶体中,正、负离子的配位比为()。
(A)8:8 (B)6:6 (C)4:4 (D)12:12 10、下列物质的晶体中,属于原子晶体的是()。
(A)S8(B)Ga (C)Si (D)GaO11、下列离子中,极化力最大的是()。
(A)Cu+(B)Rb+(C)Ba2+(D)Sr2+12、下列晶体熔化时,需要破坏共价键的是()。
(A)SiO2(B)HF (C)KF (D)Pb 13、下列离子中,极化率最大的是()。
(A)K+(B)Rb+(C)Br-(D)I-14、下列氯化物熔点高低次序中错误的是()。
(A)LiCl<NaCl (B)BeCl2>MgCl2(C)KCl>RbCl (D)ZnCl2<BaCl215、下列沸点高低顺序正确的是()。
(A)HI>HBr>HCl>HF(B)H2Te>H2Se>H2S>H2O(C)NH3>SbH3>AsH3>PH3(D)CH3>GeH4>SiH416、石墨晶体中,层与层间的结合力是()。
(A)金属键(B)共价键(C)离子键(D)分子间力17、下列离子晶体中晶格能最大的是()。
![[课件]第十章 固体结构PPT](https://img.taocdn.com/s1/m/f47944451ed9ad51f01df276.png)


再以金属铁为例计算铁原子的金属半径。
室温下铁为体心立方堆积,实验测得其晶胞边长a 为286pm 。
立方体对角线的长d 等于金属半径r 的4倍,即d =4rd 2=(a 2+a 2)+a 2=3a 2所以d =3a =3×286pm =495pmr =d 4=14×495pm =124pm 根据上述讨论,还可以计算面心立方晶胞和体心立方晶胞的空间占有率。
对于面心立方晶胞,其体积为V =a 3=42r 3。
每个晶胞含有4个金属原子,图102 体心立方晶胞示意图每个原子的体积为V at m =43πr 3,空间占有率α:α=4V at m V ×100%=4×43πr 342r 3×100%=74% 对于体心立方晶胞,立方体的体积V 与原子半径的关系是:V =a 3=d33=4r33每个晶胞含有2个金属原子,所以空间占有率为α=2V at m V ×100%=2×43πr 34r33×100%=68%三、习题解析 [浅析] 解(101)题时,通过熔点推断晶体类型应注意到,活泼金属与活泼非金属生成的化合物通常熔点比较高,属离子晶体。
但是,这类化合物有的因离子极化转变为共价化合物,其熔点比较低或易升华,它们属于分子晶体。
某些非金属单质(如硅、硼)的熔点比较高,为原子晶体。
原子晶体熔点多半很高,像202第十章 固体结构BN 这类非金属间化合物,N 与B 电负性差不大,不可能为离子晶体,熔点很高,因此为原子晶体。
BBr 3这类非金属间化合物熔点低,只能为分子晶体。
1(103)畅根据离子半径比推测下列物质的晶体各属何种类型。
(1)KBr (2)CsI (3)NaI (4)BeO (5)M gO 解:(1)r (K +)r (Br -)=133pm 196pm =0畅679 KBr (s )属NaCl 型离子晶体(2)r (Cs +)r (I -)=169pm 216pm =0畅782 CsI (s )属CsCl 型离子晶体(3)r (Na +)r (I -)=95pm 216pm =0畅440 NaI (s )属NaCl 型离子晶体(4)r (Be 2+)r (O 2-)=31pm 140pm =0畅221 BeO (s )属于ZnS 型离子晶体(5)r (M g 2+)r (O 2-)=65pm 140pm =0畅464 M gO (s )属于NaCl 型离子晶体 樉半径比规则只适用于离子晶体,而且用其推断离子晶体属何种类型时,只能作为参考,判断结果是否正确必须用实验事实来验证。