实验六_植物原生质体分离及融合综述
- 格式:ppt
- 大小:461.50 KB
- 文档页数:16

植物原生质体的分离及融合生93沈睿2009012372同组:古梦婷实验日期:2011年11月2日一.实验原理1.原生质体分离原生质体指包被在植物细胞壁内的生活物质。
细胞壁的主要成分是纤维素和果胶质,它们分别经纤维素酶和果胶酶处理即可分解,从而脱去细胞壁,得到原生质体。
2.原生质体融和诱导原生质体融合的方法有多种,譬如物理法(电场刺激,激光,显微操作等)、化学法(聚乙二醇结合高钙高pH法)和生物法(仙台病毒法等)。
本实验用PEG诱导原生质体融和。
PEG是聚乙二醇的英文缩写,相对分子质量在200-6000之间的均可用作细胞融合剂,20-50%的浓度能对原生质体产生瞬间冲击效应,原生质体很快发生收缩与粘连。
PEG诱导融合的机理可能是由于其含有醚键而具负极性,与水、蛋白质、碳水化合物等一些正极化基团能形成氢键。
当PEG分子足够长时,可作为相邻原生质体表面之间的分子桥而使之粘连。
PEG也能连接Ca2+等阳离子。
Ca2+可在一些负极化基团和PEG之间形成桥,因而促进粘连。
在洗涤过程中,连接在原生质体膜上的PEG分子可被洗脱,这将引起电荷的紊乱和再分布,从而引起原生质体融合。
高钙、高pH洗液清洗则增加了质膜的流动性,因而大大提高了融合频率,洗涤时的渗透冲击对融合也可能起作用。
普遍认为PEG分子能改变各类细胞细胞膜的结构,由于两细胞相接处质膜的相互亲和以及彼此的表面张力作用,两细胞接触点处细胞膜的脂类分子发生疏散和重组。
PEG法诱导的优点是取材方便、操作简易、效率高且效果稳定,缺点是对细胞有毒性。
二.实验步骤1.原生质体的制备(1)将新鲜的剑兰(唐菖蒲)花瓣洗干净,用吸水纸吸干表面水分;将小平皿洗净,用蒸馏水冲洗后晾干或擦干。
(2)向小平皿中加入适量酶液,用尖头镊剥取剑兰花瓣的上、下表皮,27o C恒温振荡1h 左右。
(3)镜检细胞的酶解情况,若酶解效果不佳,可延长酶解时间,并用吸管吹吸。
(4)将酶解好的原生质体混合液经300目尼龙网过滤到10ml离心管,去除未被酶解的大块组织,用洗涤液冲洗平皿若干次,收集冲洗的液体。
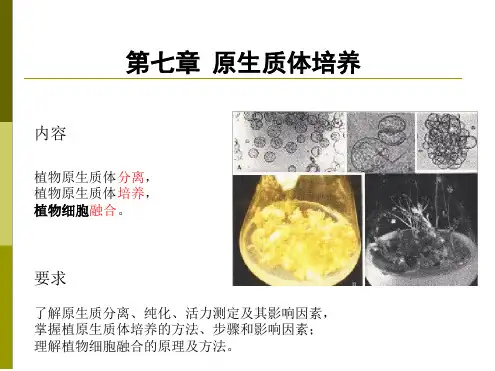

实验六植物原生质体的分离与融合一、实验目的:1、掌握原生质体分离的方法;2、了解并掌握利用PEG原生质体融合的原理和方法。
二、实验原理:PEG为一种高分子化合物,能与水、蛋白质、和碳水化合物等一些基团能形成氢键。
普遍认为聚乙二醇分子能改变各类细胞的膜结构,使两细胞接触点处质膜的脂类分子发生疏散和重组,由于两细胞接口处双分子层质膜的相互亲和以及彼此的表面张力作用,从而使细胞发生融合。
该方法的优点是:用法简单,容易获得融合体,融合效果好。
三、实验材料:(1)韭菜或大蒜叶;(2)红辣椒四、实验步骤:Ι 植物原生质体的分离与纯化1、酶解:将撕去表皮的植物叶片和果肉置于酶液(PH 5.4_5.8,去表皮面接触酶液),在适宜温度条件下,避光酶解数小时。
2、过滤:用350目网过滤除去未完全消化的叶片等残渣。
3、原生质体收集:在1000rpm条件下离心5分钟,弃上清液。
红辣椒800转/分离心5分钟。
4、洗涤:弃上清液,留沉淀约1ml,加入4ml13%CPW洗液,相同条件下再离心,弃上清液。
弃上清液,留沉淀约1ml,混匀呈悬浮备用。
5、纯化:**蔗糖漂浮法去除碎片法:(1)用细口吸管吸20%蔗糖溶液约3ml,小心插入盛有原生质体悬液的离心管底部,缓缓将蔗糖溶液挤出,由于比重不同,蔗糖溶液与原生质体悬液中间有一明显界面。
或者(1*)换一洁净离心管加入20%蔗糖溶液约3ml,然后小心将原生质体悬液平铺于离心管表面。
(以上任一方法皆能看到明显界面)(2)离心5分钟(1000转/分,辣椒800转/分),此时死细胞及碎片降至蔗糖溶液内,聚集在离心管底部,而活细胞由于有大量泡沫,故漂浮在上下界面处(3)用细管吸取漂浮在上下界面处的健康原生质体,转入干净的离心管中。
注意下步镜检决定是否需要:加入3~4ml13%CPW洗液离心,离心5分钟(1000转/分,辣椒800转/分),收集沉淀,最终原生质体体积控制在0.5ML左右。
Ⅱ细胞融合1.不同的原生质体各300μl与带盖离心管中,另加入300μl 40% PEG液,30℃水浴中温浴15min;2.融合液一滴于载玻片上(注意保持一定湿度,不能太干),轻轻盖上盖玻片,显微镜观察。





植物原生质体融合和培养在理论和实践上都有很大的意义,在植物遗传工程和育种研究上具有广阔的应用前景。
它是植物同源、异源多倍体获得的途径之一,它不仅能克服远缘杂交有性不亲和障碍,也可克服传统的通过有性杂交诱导多倍体植株的麻烦,最终将野生种的远缘基因导入栽培种中,原生质体融合技术可望成为作物改良的有力工具之一。
原生质体的分离分离原生质体时,首先要让酶制剂大量地吸附到细胞壁的纤维素上去,因此,一般先将材料分离成单细胞,然后分解细胞壁。
采用将酶液减压渗入组织,或将组织切成薄片等方法,都可增加酶液与纤维素分子接触的机会。
酶处理目前常用的多是“一步法”,即把一定量的纤维素酶,果胶酶和半纤维素酶组成混合酶溶液,材料在其中处理一次即可得到分离的原生质体。
植物材料须按比例和酶液混合才能有效地游离原生质体,一般去表皮的叶片需酶量较少,而悬浮细胞则用酶量较大。
每克材料用酶液10~30ml不等。
由于不同材料的生理特点不同,在研究游离条件时,必须试验不同渗透压浓度的细胞,找出适宜的渗透浓度。
例如,游离小麦是浮细胞的原生质体的酶液中须加入0.55mol/L甘露醇,游离水稻悬浮细胞的原生质体的酶液中只加0.4~0.45mol/L的甘露醇,两者差别较大。
酶解处理时把灭菌的叶片或子叶等材料下表皮撕掉,将去表皮的一面朝下放入酶液中。
去表皮的方法是:在无菌条件下将叶面晾干、顺叶脉轻轻撕下表皮。
如果去表皮很困难,也可直接将材料切成小细条,放入酶液中。
对于悬浮细胞等材料,如果细胞团的大小很不均一,在酶解前最好先用尼龙网筛过滤一次,将原细胞团去掉,留下较均匀的小细胞团时再进行酶解。
酶解处理一般地在黑暗中静止进行,在处理过程中偶尔轻轻摇晃几下。
对于悬浮细胞,愈伤组织等难游离原生质体的材料,可置于摇床上,低速振荡以促进酶解。
酶解时间几小时至几十小时不等、以原生质体游离下来为准。
但是,时间过长对原生质体有害,所以一般不应超过24h。
酶解温度要从原生质体和酶的活性两方面考虑。

综合实验一:植物原生质体的分离、融合与培养植物原生质体融合和培养在理论和实践上都有很大的意义,在植物遗传工程和育种研究上具有广阔的应用前景。
它是植物同源、异源多倍体获得的途径之一,它不仅能克服远缘杂交有性不亲和障碍,也可克眼传统的通过有性杂交诱导多倍体植株的麻烦,最终将野生种的远缘基因导入栽培种中,原生质体融合技术可望成为作物改良的有力工具之一。
植物原生质体培养方法起源于植物单细胞的培养方法。
1954年,植物单细胞培养才获得成功。
Mllir培养的万寿菊及烟草悬浮细胞植入到长有愈伤组织的培养基上得到了它们的单细胞克隆,并建立了看护培养的方法;I960年Jones等建立了微室培养法。
同年,Cocking 应用酶法分离原生质获得成功,从而在实验条件下很容易获得大量的原生质体。
随着多种适用于原生质体分离的商品酶的出现,原生质体的培养方法也得到了不断地改进,现在常用的原生质体培养方法有:液体浅层培养法、双层培养法、琼脂糖包埋法、琼脂岛培养法以及使用条件培养基或饲喂培养等。
实验目的了解植物原生质体分离、融合和培养的基本原理及其过程实验原理植物原生质体是除去细胞壁后为原生质所包围的“裸露细胞。
是开展基础研究的理想材料。
其中酶解法分离原生质体是一个常用的技术,其原理是植物细胞壁主要由纤维素、半纤维素和果胶质组成,因而使用纤维素酶、半纤维素酶和果胶酶能降解细胞壁成分,除去细胞壁。
许多化学、物理学和生物学方法可诱导原主质体融合,现在被广泛采用并证明行之有效的融合方法是聚乙二醇(PEG)法。
高Ca高pH法和电融合法:PEG作为一种高分子化合物,20〜50%的浓度能对原生质体产生瞬间冲击效应,原生质体很快发生收缩与粘连,随后用高Ca高pH法进行清洗.使原生质体融合得以完成。
PEG诱导融合的机理:PEG由于含有醛键而具负极性,与水、蛋白质和碳水化合物等一些正极化基团能形成氢键,当PEG分子足够长时,可昨为邻近原生质表面之间的分子桥而使之粘连。
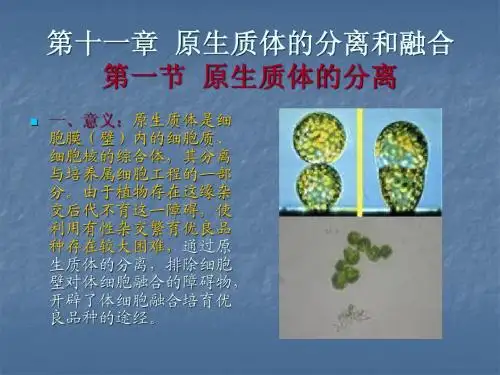

实验六植物原生质体的分离与融合第一部分:综合性实验紫叶甘蓝与园葱原生质体的分离与融合一、实验原理及意义植物原生质体由于已去除了细胞壁,它能够像动物细胞一样,在人为的条件下互相融合,获得细胞杂种植株。
如果用近缘种内或种间的原生质体融合,可以获得稳定的、具有双亲两套染色体的细胞杂种植株,它们往往可育,可以直接作为育种的种质材料;如果用远缘不亲和物种间的原生质体融合,可以获得常规有性杂交得不到的无性杂种植株,不仅克服了远缘杂交不亲和性,而且可以扩大植物的变异范围,拓宽种质来源,选育出新种质,甚至产生新种。
要分离植物原生质体,必须去掉由果胶质、纤维素和半纤维素及木质素等构成的细胞壁。
目前普遍采用酶分离法来获得原生质体。
1.酶:分离原生质体最常用的酶有纤维素酶、半纤维素酶和果胶酶。
2.渗透稳定剂:植物细胞壁对细胞有良好的保护作用。
去除细胞壁之后如果溶液中的渗透压和细胞内的渗透压不同,原生质体有可能涨破或收缩。
因此在酶液、洗液和培养液中渗透压应大致和原生质体内的相同。
3.植物材料:一般来说,植物各个器官,如:根、茎、叶、花、果实、种子及愈伤细胞和悬浮细胞等都可作为分离原生质体的材料。
但是,要获得高质量的原生质体,则须选用生长旺盛、生命力强的组织作材料。
材料的生理状况是原生质体质量的决定性因素之一。
4.酶溶液的pH值:对原生质体的产量和生活力影响很大。
一般为5~7。
酶的活性与pH值有关。
Onoznka纤维素酶R-10最适宜pH值为5~6。
不过实际上酶溶液的pH值经常调节4.7~6.0之间。
对于不同的材料、不同型号的酶其所要求的最适值是不同的,应通过实验确定。
5.温度:对酶解效率和植物原生质体的活力都有影响。
酶:40~50摄氏度,适于植物材料的温度一般都在25℃,所以一般在25℃左右进行酶解。
二、试剂的配制1、pH5.7的磷酸钾缓冲液10 mL:A液:称取0.272g KH2PO4(0.2mol/L,溶于蒸馏水中,定容至10 mL。
原生质体的分离、融合与培养一、实验目的1.了解植物原生质体分离、融合和培养的基本原理。
2.掌握植物原生质体分离、融合和培养的基本过程。
3.了解并掌握利用PEG原生质体融合的原理和方法。
二、实验原理植物原生质体是除去细胞壁后为原生质所包围的“裸露细胞”,是开展基础研究的理想材料。
其中酶解法分离原生质体是一个常用的技术,其原理是植物细胞壁主要由纤维素、半纤维素和果胶质组成,因而使用纤维素酶、半纤维素酶和果胶酶能降解细胞壁成分,除去细胞壁。
许多化学、物理学和生物学方法可诱导原主质体融合,现在被广泛采用并证明行之有效的融合方法是聚乙二醇(PEG)法、高Ca高pH法和电融合法。
PEG诱导融合的机理:PEG由于含有醚键而具负极性,与水、蛋白质和碳水化合物等一些正极化基团能形成氢键,当PEG分子足够长时,可阼为邻近原生质表面之间的分子桥而使之粘连。
PEG也能连接Ca2+等阳离子,Ca2+可在一些负极化基团和PEG之间形成桥,因而促进粘连。
在洗涤过程中,连接在原生质体膜上的PEG分子可被洗脱.这样将引起电荷的紊乱和再分布.从而引起原生质体融合:高Ca高pH由于增加了质膜的流动性,因而也大大提高了融合频率,洗涤时的渗透压冲击对融合也可能起作用。
三、实验材料、试剂与仪器1.材料新鲜的菠菜叶片2.试剂(1)酶液:依次加入 1.25%纤维素酶、0.3%果胶酶、0.04%甘露醇、20mmol/LKCl和20mmol/L2-吗啉乙磺酸(MES),55℃水浴10min,冷却至室温,再加10mmol/LCaCL2、5mmol/Lβ-巯基乙醇和0.1%BSA,0.45um微孔滤膜过滤,溶液呈透明橙色。
(2)PEG溶液:4GpPEG4000\3mL去离子水、2.5mL0.8mol/L甘露醇和1mL1mol/L CaCL2。
(3)MMg溶液:0.4mol/L甘露醇、15mmol/LMgCl2、mmol/LCaCl2和4mmol/LMES。
细胞生物学综合性实验课程名称: 细胞生物学实验姓名:班级:学号:时间: 年月日植物原生质体的分离、纯化及融合1 材料、试剂与方法1.1材料菠菜叶片,唐古特白刺愈伤组织,金盏菊花瓣。
1.2 试剂5%次氯酸钠,无菌水,酶液A,0.2mol/L的Cacl2.2H2O溶液,20%蔗糖溶液,0.16 mol/L的Cacl2.2H2O溶液,酶液B,12%蔗糖溶液,PEG溶液,高PH高钙稀释液。
1.3方法1.3.1菠菜叶片和金盏菊花瓣的消毒处理称取金盏菊花瓣1.5g或菠菜叶1g,用自来水冲洗;分别用5%次氯酸钠溶液浸泡10分钟,再用无菌水洗4次。
1.3.2 原生质体的分离1.将消毒后的金盏菊花瓣用镊子撕成细丝。
2.酶解:加5ml酶液A,封口,保持28℃,3-6小时。
3.过滤及离心:600r/min离心5min,弃去上清液保留沉淀。
1.3.3 原生质体的纯化1.将沉淀用2ml 0.2mol/L的Cacl2.2H2O溶液悬浮。
2.用注射器缓缓向离心管底部6ml 20%蔗糖溶液,600r/min离心5min,得到原生质带。
3.用注射器吸出管底杂质和蔗糖及上部Cacl2.2H2O溶液。
4.留下的原生质带用5ml 0.2mol/L的Cacl2.2H2O溶液悬浮, 600r/min离心5min。
5.用3ml 0.16mol/L的Cacl2.2H2O溶液悬浮。
1.3.4 原生质体的融合1.将菠菜叶和金盏菊的原生质体悬液等量混合。
2.用吸管将混合的原生质体混合液滴在培养皿中,7-8滴每皿,静置10min,使其贴壁。
3.用吸管将等量的PEG溶液滴在原生质液滴上,静置10-15min 观察细胞的粘连。
4.用刻度吸管向原生质液滴慢慢加入高PH高钙稀释液。
第一次0.5ml,第二次1ml,第三四次各2ml,每次间隔5min。
5.平皿微倾斜,吸取上清液,缓缓加入4ml高PH高钙稀释液,静置5min后弃去上清液。
6.加入MS培养基4ml, 静置5min后弃去上清液。
苜蓿原生质体分离与体细胞融合条件的研究苜蓿(Medicago sativa)是一种重要的牧草植物,广泛应用于畜牧业和土壤改良。
为了进一步提高苜蓿的品质和产量,研究人员一直致力于开展基因编辑和转基因改良的研究。
然而,在进行遗传改良之前,第一步是需要成功地获得苜蓿的原生质体,以及实现体细胞融合。
本文将探讨苜蓿原生质体的分离方法以及体细胞融合的条件研究。
首先,苜蓿原生质体的分离是进行体细胞融合的重要步骤之一。
常规的方法是通过组织培养技术来获得苜蓿的原生质体。
首先,选择苜蓿幼苗的茎、叶或芽作为外植体,表面消毒后切割成小段。
然后,使用无菌条件下的液体培养基,添加适量的激素(如植物生长素和植物激素),并将外植体培养在培养基中。
经过适当的处理和培养时间后,原生质体会从外植体的细胞中分离出来。
这些原生质体可以进一步用于体细胞融合的实验。
其次,体细胞融合是利用不同细胞的融合来获得新的遗传特征。
在苜蓿中,常见的融合方法是利用聚合醇(如聚乙二醇)诱导细胞融合。
首先,需要将获得的原生质体分散在适当的培养基中,并与另一种相关物种的原生质体混合。
然后,将聚乙二醇加入培养基中,通过电脑系统控制融合条件,使得两种细胞融合成功。
接下来,将混合样品进行适当的处理,以分离和筛选出融合细胞。
这些融合细胞具有双倍体的特征,并且存在着不同物种间的基因交流,可以用于进一步的遗传改良研究。
然而,在进行苜蓿原生质体的分离和体细胞融合之前,需要对条件进行一系列的优化研究。
例如,培养基的成分和激素浓度对原生质体分离和融合的效果有重要影响。
研究人员通常通过不同浓度和组合的激素来测试其对原生质体和融合细胞的影响,并选择最适宜的条件。
此外,温度、光照和pH值等环境因素也需要进行优化,以提高原生质体的分离率和细胞融合的成功率。
除了条件的优化,不同苜蓿品种之间可能存在差异,也需要进行基因型和环境交互作用的研究。
不同品种之间的差异可能导致原生质体分离和体细胞融合的效果不同。