亚慢性毒性试验
- 格式:ppt
- 大小:1.20 MB
- 文档页数:50



动物医学进展,2021,42(1):82-87ProgressinVeterinary Medicine通肾颗粒的亚慢性毒性试验王军1,王雅倩2,侯会霞2,边小利3,王虹雅2,陈胡羚2,张芬芳2,,孙蓉2,李引乾2*(1.陕西汉中市动物疾病预防控制中心,陕西汉中723000;.西北农林科技大学动物医学院,陕西杨凌712100;3.陕西省府谷县麻镇畜牧兽医工作站,陕西府谷7194003;.陕西省眉县畜牧兽医工作站,陕西眉县722300)摘要:采用大鼠亚慢性毒性试验评价通肾颗粒的毒性。
将SD大鼠随机分为4组,3个试验组分别以12、6、3g/kg对大鼠进行灌胃,对照组给予等体积生理盐水,连续6周,观察记录大鼠的反应。
结果显示,SD 大鼠的健康状况指标如血常规和生化等无不良变化,内脏器官也没有不良变化,但会对大鼠的生长发育产生一定的抑制作用。
关键词:通肾颗粒;大鼠;亚慢性毒性试验中图分类号:S853.74;S852.31文献标识码:A文章编号:1007-5038(2021)01-0082-06肾炎(nephritis)是临床上以水肿、肾区疼痛、尿量改变、尿液含有多量上皮细胞和管型为特征的肾小球、肾小管或肾脏间质组织发生炎症的病理过程[1。
发病多与感染、毒物刺激和变态反应有关2。
临床治疗以消炎利尿、抑制免疫反应和清热利湿、止血凉血为主[4。
通肾颗粒由黄芪、苦参、白茅根、金银花等中药组成,具有可清热燥湿,清热利尿和清热解毒之功效,临床上用于治疗以水肿、尿少、尿血、腰收稿日期20190521基金项目:陕西省重点研发计划项目(2018NY-005)作者简介:王军(1963—),男,云南昆明人,高级兽医师,主要从事畜牧兽医技术推广工作。
*通讯作者Isolation and Identification of Fungal Endophyte in Aconitum gymnandrum LIU Xin-yu1,HUANG En-xia1,ZHANG Shu-hang1,ZHANG Yu1,ZHU Yan-li1,LIU Yi-ing1, WANG Jing-ong2,,SUN Lu1,SONG Run-jie1,ZHAO Bao-yu1,LU Hao1(1.CoUege of VebeHnary Medicine,Northwest A&F UniversiLy<,Yangling,Shaanxi712100,China;2.Barley ImprovemenL and Yak Breeding Key LaboraLory of Tibet Autonomous Region, Lhasa,Tibet,85000, China;3.InsHuU of PraLacuIbural Science,Tibet Academy of Agriculiural and Animal Husbandry Sciencss,Lhasa,Tibet,50000, China) Abstract:In order to investigate the species and population distribution of fungal endophyte in Acoeitum gymnndTum collected from Tianzhu of Gansu province,endophytic fungal isolation was conducted by sur-facedisinfection,speciesandITSsequenceanalysistechniquesforspeciesidentificationofisolatedstrains,andsystematicevolutionanalysisusedby MEGA505software Theresultsshowedthattherewereabun-dantfungalendophytesin Aconitumgymnandrum,33fungalendophyteswereisolatedfromroots,stems,leaves,flowers and seeds,after identification,they were belonged to2classes,orders,families and4gen-era;thetotalrelativeisolatiofrequency was9394%Endophyticfungihavethehighestfrequencyofleaf infection,thesecondisthestem,leastintheseed;theirspecies Penici ium sp hadthehighestrelativeiso-lationfrequencyandwasthedominantspeciesoffungalendophytesin Aconitumgymnandrum,theirspe-cieswerefoundina l theabovetissuesandtheirdistributionwasthemostextensive Accordingtophylo-genetic analysis,these isolated strains were divided into population I,population n and population川. Theseresultscanfurtherenrichthediversityoffungalendophytesof Aconitum andlayafoundationforthe researchofsecondary metabolitesofendophyticfungiin AconitumgymnandrumKey words:A co eU u m gymeaedrum;fungal endophyte;isolation and identification;P s HS iSum王军等:通肾颗粒的亚慢性毒性试验83部疼痛等为主症的肾炎。
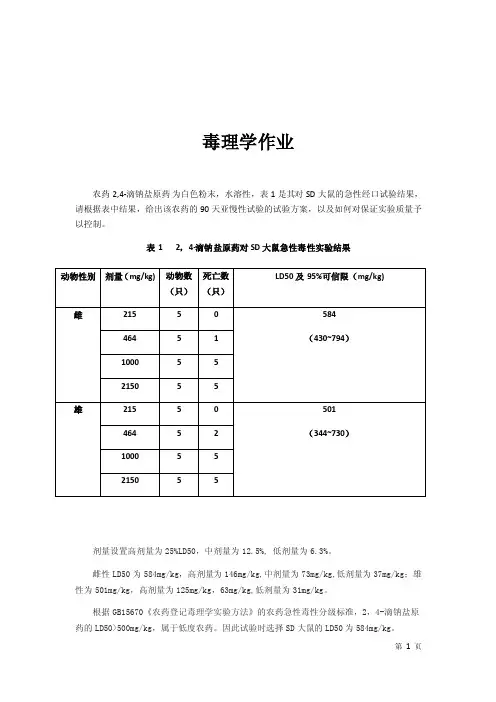
毒理学作业农药2,4-滴钠盐原药为白色粉末,水溶性,表1是其对SD大鼠的急性经口试验结果,请根据表中结果,给出该农药的90天亚慢性试验的试验方案,以及如何对保证实验质量予以控制。
表1 2,4-滴钠盐原药对SD大鼠急性毒性实验结果剂量设置高剂量为25%LD50,中剂量为12.5%, 低剂量为6.3%。
雌性LD50为584mg/kg,高剂量为146mg/kg,中剂量为73mg/kg,低剂量为37mg/kg;雄性为501mg/kg,高剂量为125mg/kg,63mg/kg,低剂量为31mg/kg。
根据GB15670《农药登记毒理学实验方法》的农药急性毒性分级标准,2,4-滴钠盐原药的LD50>500mg/kg,属于低度农药。
因此试验时选择SD大鼠的LD50为584mg/kg。
农药2,4-滴钠盐原药SD大鼠亚慢性毒性试验目的;研究喂饲农药2,4-滴钠盐原药对大鼠的亚慢性毒性。
方法:取初断乳 SD大鼠80只,雌雄各半按照体重随机分为4组。
将2,4-滴钠盐原药按146、73、37mg/kg mg/kg剂量分别拌入饲料内经口喂饲染毒90d。
观察:大鼠外观体征、体质量、进食情况等。
在实验中期和末期采血检测检测血液学。
试验末期检测血生化指标以及尿常规检查。
实验结束时处死实验动物,计算脏器指数,并对主要脏器进行病理组织学观察。
1 材料和方法1.1 受试物农药2,4-滴钠盐原药,白色粉末,水溶性,由某地某农药公司提供。
SPF级初断乳大鼠80只,雌雄各半,体质量50~100 g,由XXX实验动物研究所繁育场提供,动物合格证号为医动字第XX-XXXX号。
1.2 饲养与管理SPF 环境条件下,同组同性别两只一笼喂养,自由进食和饮水。
环境温度 21~25℃,相对湿度 40%~60%。
严格控制昼夜交替。
1.3实验方法试验前将雌、雄大鼠各半按体重随机分为3个剂量组和1个对照组,每组20只,将2,4-滴钠盐原药按146、73、37mg/kg mg/kg剂量分别均匀混入饲料中制成颗粒饲料辐照灭菌后分别供高、中、低剂量组动物食用,连续每日一次喂养90d;对照组给予不加受试物的正常饲料。


第1篇一、实验目的本研究旨在通过动物安全药理实验,对某新型药物进行安全性评价,包括急性毒性、亚慢性毒性、慢性毒性以及遗传毒性等方面,为该药物的临床应用提供科学依据。
二、实验材料1. 实验动物:健康昆明小鼠,体重18-22g,雌雄各半。
2. 药物:某新型药物,纯度≥98%,由某制药企业提供。
3. 试剂与仪器:生理盐水、苦味酸、戊巴比妥钠、注射器、灌胃针、电子天平、手术剪、止血钳、平皿、托盘、烧杯等。
三、实验方法1. 急性毒性实验(1)实验分组:将实验动物随机分为5组,每组10只,分别为对照组、低剂量组、中剂量组、高剂量组和最大耐受量组。
(2)给药方式:除对照组外,其他各组分别灌胃给药,剂量分别为0.5、1.0、2.0、4.0g/kg体重。
(3)观察指标:观察实验动物在给药后24小时内出现的死亡、中毒症状及体征。
2. 亚慢性毒性实验(1)实验分组:将实验动物随机分为5组,每组10只,分别为对照组、低剂量组、中剂量组、高剂量组和最大耐受量组。
(2)给药方式:除对照组外,其他各组分别灌胃给药,剂量分别为0.5、1.0、2.0、4.0g/kg体重,连续给药90天。
(3)观察指标:观察实验动物在给药期间及停药后30天内出现的死亡、中毒症状及体征,并进行血液学、血液生化、脏器系数等指标检测。
3. 慢性毒性实验(1)实验分组:将实验动物随机分为5组,每组10只,分别为对照组、低剂量组、中剂量组、高剂量组和最大耐受量组。
(2)给药方式:除对照组外,其他各组分别灌胃给药,剂量分别为0.5、1.0、2.0、4.0g/kg体重,连续给药6个月。
(3)观察指标:观察实验动物在给药期间及停药后30天内出现的死亡、中毒症状及体征,并进行血液学、血液生化、脏器系数、病理学等指标检测。
4. 遗传毒性实验(1)实验分组:将实验动物随机分为2组,每组10只,分别为实验组(给药组)和对照组。
(2)给药方式:实验组灌胃给药,剂量为2.0g/kg体重,连续给药90天。

![食品安全学第七章食品安全性毒理学评价[五篇范例]](https://uimg.taocdn.com/bb231a3b77c66137ee06eff9aef8941ea66e4b55.webp)
食品安全学第七章食品安全性毒理学评价[五篇范例]第一篇:食品安全学第七章食品安全性毒理学评价第七章食品安全性毒理学评价目的与要求:←了解食品毒理学、食品毒物、LD50等概念;了解食品毒理学、食品安全性毒理学评价程序.学习重点:毒理学、食品安全性毒理学评价过程和各阶段的主要目的.前言←应用食品毒理学的方法对食品进行安全性评价, 为我们正确认识和安全使用食品添加剂(包括营养强化剂)、开发食品新资源和新资源食品及保健食品的开发提供了可靠的技术保证,为我们正确评价和控制食品容器和包装材料、辐照食品、食品及食品工具与设备用洗涤消毒剂、农药残留及兽药残留的安全性提供了可靠的操作方法。
←食品中有毒物质的毒理学数据主要从动物毒理学实验中获得.第一节食品毒理学原理一、食品毒理学基本概念←1.食品毒理学(food toxicology):应用毒理学方法研究食品中外源化学物的性质,来源与形成,它们的不良作用与可能的有益作用及其机制,并确定这些物质的安全限量和评定食品安全性的科学。
毒理学定义是研究外源性化学物质对生物体的危害的科学。
一、食品毒理学基本概念它是研究外源性化学物及物理和生物因素对生物有机体的有害作用及其作用机理,预测其对人体和生态环境的危害,对毒性作用进行定性和定量评价,包括毒性反应、严重程度、发生频率和毒性作用机制,为确定安全限值和采取防治措施提供科学依据的一门学科。
毒理学按照其研究目的及所研究的化学物质特性和用途可分为工业毒理学、军事毒理学、环境毒理学、药物毒理学、法医毒理学和放射毒理学等。
一、食品毒理学基本概念←2.毒物:在一定条件下,较小剂量就能够对生物体产生损害作用或使生物体出现异常反应的外源化学物称为毒物。
食物中的毒物来源有:天然的或食品变质后产生的毒素、环境污染物、农兽药残留、生物毒素等,以及食品接触所造成的污染。
←3.外源化学物(xenobiotics):是存在于外界环境中,而能被机体接触并进入体内的化学物;它不是人体的组成成分,也不是人体所需的营养物质。

第 1 题:亚慢性毒性试验中一般化验指标有(a )。
A.血象、肝肾功能B.病理学检查C.灵敏指标的检查D.特异指标的检查E.特异基因的测试第2 题:接触化合物的途径不同,其毒性大小的顺序是(e )。
A.静脉注射>经呼吸道B.静脉注射>腹腔注射C.腹腔注射>经口D.经口>经皮E.以上都是第3 题:目前常用的化学物质有( e )。
A.500 万种B.300 万种C.100 万种D.10 万种E.67 万种第 4 题:急性亚慢性慢性毒性试验分别选择动物年龄为(a )。
A.初成年性刚成熟初断乳B.初断乳性刚成熟初成年C.初断乳初成年性刚成熟D.初成年初断乳性刚成熟E.性刚成熟初断乳初成年第5 题:急性经口染毒,为了准确地将受试物染入消化道中,多采用(a )。
A.灌胃B.喂饲C.吞咽胶囊D.鼻饲E.饮水第6 题:最小有作用剂量是( e )。
A.一种化合物按一定方式与人接触出现了亚临床症状的最小剂量B.一种化合物按一定方式与人接触造成显微镜下可观察到的损伤的最小剂量C.一种化合物按一定方式与人接触引起免疫功能减低的最小剂量D.DNA 大段损伤的最小剂量E.一种化合物按一定时间内按一定方式与机体接触使某项指标开始出现异常变化的最低剂量第7 题:亚慢性毒性试验对动物的要求是( b )。
A.成年动物B.大鼠100g 左右小鼠15g 左右C.大、小鼠,狗,家兔均可用D.必须为啮齿类或非啮齿类动物E.仅使用单一性别第8 题:碱基转换的后果是出现( e )。
A.同义密码B.错义密码C.终止密码D.氨基酸改变E.以上都对第9 题:苯环上的一个氢被烷基取代,其毒性发生改变(a )。
A.苯对造血功能主要是抑制作用,而甲苯为麻醉作用B.苯主要从呼吸道排泄,对呼吸系统有毒性作用,而甲苯没有C.苯中毒产生过量的儿茶酚胺刺激心肌细胞发生心室颤动,而甲苯没有D.甲苯的肝脏中氧化,对肝有损害作用,而甲苯没有E.苯为致癌物,甲苯为工业毒物第10 题:化学结构与毒效应(d )。

第7章⼀般毒性作⽤及其实验与评鉴⽅法第六章⼀般毒性作⽤及其试验与评价⽅法⼀般毒性作⽤:是指毒物对动物机体产⽣的综合毒性效应,也称基本毒性作⽤根据接触毒物的时间长短可将产⽣的毒性作⽤分为急性毒性、亚慢性毒性和慢性毒性。
第⼀节急性毒性作⽤及其试验与评价⽅法⼀、急性毒性试验的概念急性毒性试验是指动物机体⼀次或24h内多次接触受试物后在短期内所产⽜的毒性效应及反应。
观察内容⼀般包括⾏为变化、外观改变以及致死效应。
观察时间⼀般为7d,观察范围可为7~28d(迟发毒性效应)。
凡经⼝或经注射给毒,“⼀次”的含义是指瞬间将受试物输⼊试验动物体内;若经呼吸或⽪肤给毒,“⼀次”则指在⼀个特定的时间内,使试验动物持续接受受试物的过程。
“24h内多次接触受试物”的概念是指当受试物毒性很低,⼀次接触还不能达到充分了解该受试物的毒性作⽤,或⼀次不能导⼊设计剂量的受试物时,需在24h内分次染毒。
⼆、急性毒性试验的⽬的(1)测定和计算出受试物的致死量及其他急性毒试参数,主要获得受试物对某种实验动物以某种接触途径的LD50值;(2)了解受试物对动物机体的急性毒性特征,靶器官和剂量⼀反应关系;(3)研究受试物在动物体内的动⼒学变化规律;(4)为下⼀步的亚慢性、慢性毒性试验及其他毒理学试验的剂量设计和观察指标选择提供依据。
三、急性毒性试验⽅法1.实验动物的选择和要求(1)品种、品系的选择实验动物选择的原则是以哺乳动物为主,选择两种或两种以上的动物,包括啮齿类(rodentspecies)和⾮啮齿类(nonrodenl species),其中⾄少有⼀种⾮啮齿类动物。
啮齿类多选⽤⼩⿏和⼤⿏,⾮啮齿类常选⽤⽝或猴。
(2)性别和年龄或体重的要求对于实验动物的性别⼀般要求雌雄(早6)各半。
如果试验仅为某些特殊试验研究⽬标,也可选⽤单⼀性别。
如致畸试验可仅选雌性动物,对精⼦毒性试验可仅选雄性动物。
急性毒性试验通常要求刚成年的动物。
⼀般按体重选购,通常要求⼩⿏18~25g、⼤⿏180~240g、豚⿏.200~250g、家兔2~2.5kg、猫1.5~2kg、⽝4~6kg(⽝⼀般为1岁左右)。

毒理学评价的四个阶段和内容通常包括以下:
1. 急性毒性试验(Acute Toxicity Testing):
这是毒理学评价的第一阶段,主要目的是确定物质在短时间内(通常是一次或几次接触后)对生物体产生的有害效应。
内容包括:经口、皮肤接触和吸入途径的急性毒性试验,计算LD50(半数致死剂量),即导致一半实验动物死亡的剂量。
2. 遗传毒性试验(Genotoxicity Testing):
这个阶段评估物质是否能够引起遗传物质(DNA)的损伤,这可能导致突变、癌症或其他遗传疾病。
内容包括:Ames试验(细菌回复突变试验)、染色体畸变试验和微核试验等。
3. 亚慢性毒性试验(Subchronic T oxicity Testing):
在这个阶段,物质的毒性效应在较长时间内(几周到几个月)被研究。
内容包括:重复剂量毒性试验,观察动物的行为变化、体重变化、血液学参数、生化指标、器官重量和病理学改变等。
4. 慢性毒性试验和致癌性试验(Chronic T oxicity and Carcinogenicity Testing):
这是最长的一个试验阶段,通常持续数月到数年,旨在评估物质长期暴露对生物体的影响,包括潜在的致癌性。
内容包括:生命周期研究,观察生长发育、生殖能力、寿命以及肿瘤发生率等。
在这些试验中,除了直接的毒性效应外,还会考虑物质的代谢途径、蓄积效
应、剂量-反应关系以及敏感群体(如孕妇、儿童和老人)的特殊反应。
这些信息对于全面评估物质的安全性和风险管理至关重要。
值得注意的是,具体的试验设计和要求可能会根据监管机构的指导原则和物质的特性进行调整。
口腔医疗器械生物学评价第19 部分:亚急性和亚慢性全身毒性试验:植入途径1范围本文件规定了口腔医疗器械亚急性和亚慢性植入途径的全身毒性试验方法。
本文件适用于评价口腔医疗器械植入途径的亚急性和亚慢性全身毒性试验。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 16886.6 医疗器械生物学评价第6 部分:植入后局部反应试验GB/T 16886.11 医疗器械生物学评价第11 部分:全身毒性试验GB/T 16886.12 医疗器械生物学评价第12 部分:样品制备与参照样品3目的与原则3.1目的本试验将口腔医疗器械植入动物体内一定时间(如28d,90d),测定其对试验动物的影响,以判定其是否具有潜在的亚急性或亚慢性全身毒性作用。
3.2试验原则在评价口腔医疗器械全身毒性特征的过程中,是否进行植入途径亚急性或亚慢性全身毒性试验应结合试验样品的临床应用途径和其特性决定,如可降解性能等。
本试验植入途径开展亚急性全身毒性试验周期一般为 28 天,亚慢性全身毒性试验周期一般为 90 天,其他试验周期的选择应进行论证或说明。
对体内可降解/可吸收试验样品的试验周期设定,应充分考虑试验样品在体内的降解行为。
植入剂量应结合试验样品临床的最大使用剂量并考虑一定的安全系数,同时也应充分考虑实验动物可耐受的植入剂量。
试验样品的植入部位和接触的组织应尽量与临床使用部位和接触的组织一致。
对植入组织的选择应当有正当的理由。
常用的植入部位为皮下组织植入、肌肉植入和骨植入,如选用其他植入部位应进行论证。
必要时可选择多种途径的结合使用,但应进行必要说明。
宜结合试验样品状态、接触途径、阴性对照和/或假手术处理对照进行亚急性/亚慢性全身毒性试验,涉及的对照样品应模拟试验样品制备和处置步骤。
亚慢性毒性作用及其试验方法一、概念和试验目的(一) 概念亚慢性毒性是指实验动物连续多日接触较大剂量的外来化合物所出现的中毒效应。
所谓较大剂量,是指小于急性LD50的剂量。
(二) 试验目的亚慢性毒性试验的目的,主要是探讨亚慢性毒性的阈剂量或阈浓度和在亚慢性试验期间未观察到毒效应的剂量水平,且为慢性试验寻找接触剂量及观察指标。
二、亚慢性毒性试验设计(一) 亚慢性试验期限亚慢性毒性试验的期限“多日”的确切天数,至今尚无完全统一的认识。
一般认为在环境毒理学与食品毒理学中所要求的连续接触为3~6个月,而在工业毒理学中认为1~3月即可。
这是考虑到人类接触大气、水和食品污染物的持续时间一般较久,而在工业生产过程中接触化合物仅限于人一生中的工作年龄阶段,且每日工作不超过8小时之故。
现有学者主张进行实验动物90天喂饲试验为亚慢性毒性试验,即将受试物混合物饲料或饮水中,动物自然摄取连续90天。
这是由于有研究报道认为动物连续接触外来化合物3个月,其毒性效应往往与再延长接触时间所表现的毒性效应基本相同,故不必再延长接触期限。
相应地主张呼吸道接触可进行30天或90天试验,每天6小时,每周5天。
经皮肤试验进行30天。
(二)实验动物和染毒途径1、实验动物的选择亚慢性毒性作用研究一般要求选拔两种实验动物,一种为啮齿类,另一种为非啮齿类,如大鼠和狗,以便全面了解受试物的毒性阿特征。
由于亚慢性毒性试验期较长,所以选择被动物的体重(年龄)应较小,如小鼠应为15g左右,大鼠100g左右。
2、染毒途径亚慢性毒性试验接触外来化合物途径的选择,应考虑两点:一是尽量模拟人类在环境中接触该化合物的途径或方式,二是应与预期进行慢性毒性试验的接触途径相一致。
具体接触途径主要有经口、经呼吸道和经皮肤三种。
(三)剂量选择与剂量分组亚慢性试验的上限剂量,需控制在实验动物接触受试化合物的整个过程中,不发生死亡或仅有个别动物死亡,但有明显的中毒效应,或靶器官出现典型的损伤。