(完整word版)免疫荧光介绍
- 格式:doc
- 大小:459.01 KB
- 文档页数:31

免疫荧光介绍免疫荧光技术(Immunofluorescence technique )又称荧光抗体技术,是标记免疫技术中发展最早的一种。
它是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术。
很早以来就有一些学者试图将抗体分子与一些示踪物质结合,利用抗原抗体反应进行组织或细胞内抗原物质的定位。
它是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光基团,再用这种荧光抗体(或抗原)作为探针检查细胞或组织内的相应抗原(或抗体)。
利用荧光显微镜可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质和定位。
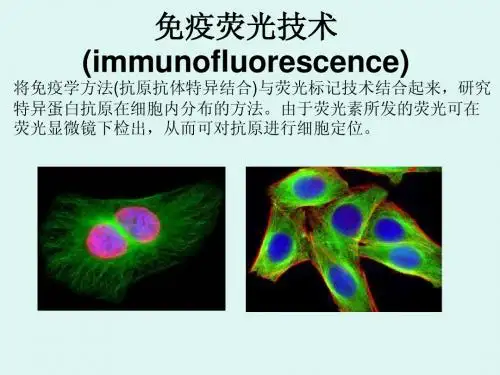
一、基本原理及特点:免疫荧光技术是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素,制成荧光抗体,再用这种荧光抗体(或抗原)作为探针检测组织或细胞内的相应抗原(或抗体)。
在组织或细胞内形成的抗原抗体复合物上含有标记的荧光素,利用荧光显微镜观察标本,荧光素受外来激发光的照射而发生明亮的荧光(黄绿色或橘红色),可以看见荧光所在的组织细胞,从而确定抗原或抗体的性质、定位,以及利用定量技术测定含量。
该技术的主要特点是:特异性强、敏感性高、速度快。
主要缺点是:非特异性染色问题尚未完全解决,结果判定的客观性不足,技术程序也还比较复杂。
荧光免疫法按反应体系及定量方法不同,还可进一步分做若干种。
与放射免疫法相比,荧光免疫法无放射性污染,并且大多操作简便,便于推广。
国外生产的TDM用试剂盒,有相当一部分即属于此类,并且还有专供TDM荧光偏振免疫分析用的自动分析仪生产。
由于一般荧光测定中的本底较高等问题,荧光免疫技术用于定量测定有一定困难。
新发展了几种特殊的荧光免疫测定,与酶免疫测定和放射免疫分析一样,在临床检验中应用。
免疫荧光实验的主要步骤包括细胞片制备、固定及通透(或称为透化)、封闭、抗体孵育及荧光检测等。
细胞片制备(通俗的说法是细胞爬片)是免疫荧光实验的第一步,细胞片的质量对实验的成败至关重要,原因很简单,如果发生细胞掉片,一切都无从谈起。

请问你曾经被IHC、ICC和IF所困扰过吗?作者:北京义翘神州在实验中,有没有一种感觉,就是对免疫组化(IHC),免疫细胞(ICC),以及免疫荧光(IF)傻傻分不清,那么今天我们就来讨论一下这三者的区别,先贴图上来以便有个大致的区分。
从图中我们可以看出,免疫检测技术可以根据报告标签的不同,分为免疫化学和免疫荧光两类,而根据样品类型不同,可以分为组织和细胞检测技术。
因此,才会延伸出三个相近的概念。
为了更好的区分这三个概念,我们还可以根据他们的英文词根来分析一下,他们的英文名分别是免疫组织化学Immunohistochemistry (IHC),免疫细胞化学Immunocytochemistry (ICC),免疫荧光Immunofluorescence (IF)。
词根分析:Immuno-指的是免疫技术(例如,抗体和抗原的结合)Histo-指的是组织(细胞以及它周围的细胞外基质)Cyto—指的是细胞(不包含细胞外的基质)Chemistry-在这里指的是化学检测方法(例如,颜色的变化)Fluorescence-对被激发的荧光团的检测通过对词根的解释,相信你在心中不再迷茫了吧。
这三个应用技术都属于免疫技术,都是将抗原与抗体的结合可视化,即通过一定的方法可以直接看到实验结果。
而常用的方法就是化学显色和荧光显色.如果报告标签是酶促的,就是免疫化学,如果是荧光的,就是免疫荧光。
其实我们纠结免疫荧光的一个原因还在于免疫荧光的英文名字Immunofluorescence (IF),但若是写成免疫组织荧光(IHF)或是免疫细胞荧光(ICF),那我们是不是就豁然开朗了。
虽然这两个词汇在英文文献中应用的还不是很广泛,但绝对不是我自己杜撰的哦,已经有些学者在使用了,规范化应该也只是时间的问题。
可能文字描述还是有些晦涩难懂,那我们就直接上图吧。
先不看下面答案,仅从几张图片,你能明白哪张图代表哪种应用吗?A免疫组织化学:兔EGFR单克隆抗体(10001-R043-50)—人胎盘B 免疫细胞化学:兔α微管蛋白单克隆抗体抗—MEF1细胞C免疫荧光组织:兔Cdk5单克隆抗体—鸡脑组织D免疫荧光细胞:兔JNK2/MAPK9(10745—R004-50)单克隆抗体—人Hela细胞A图和B图是免疫化学(Immunochemistry),这种应用是抗体检测目标蛋白,发生了化学反应,然后显色,根据样本类型的不同,又可以分为免疫组织化学(A)和免疫细胞化学(B)。

一、免疫荧光技术概述免疫荧光技术是一种通过荧光显微镜观察细胞或组织中特定分子的方法。
它利用抗体与待检测分子结合后,再加上荧光标记的二抗或荧光标记的直抗,通过荧光显微镜观察标记分子的位置和数量。
免疫荧光技术在细胞生物学和免疫学研究中得到了广泛应用,为研究生物分子的定位、表达和相互作用提供了重要技术支持。
二、免疫荧光技术的原理1. 抗体结合在免疫荧光技术中,首先需要用特异性抗体与待检测的分子结合。
这些抗体可以是单克隆抗体,也可以是多克隆抗体,通过它们与目标分子的结合,实现对待检测分子的高度特异性识别。
2. 荧光标记待检测分子与抗体结合后,需要加入荧光标记的二抗或直抗,使得待检测分子与荧光物质结合形成复合物。
通常使用的荧光分子有FITC、TRITC、Alexa Fluor等,它们在不同激发波长下显示出不同的荧光颜色。
3. 观察和分析最后通过荧光显微镜观察标记的细胞或组织样品,根据荧光信号的强度和分布情况,可以判断待检测分子的位置和数量,从而了解其在细胞内的表达和功能。
三、免疫荧光技术的应用1. 细胞膜标记免疫荧光技术可用于标记细胞膜上的特定蛋白,例如细胞黏附蛋白、受体蛋白等,从而观察它们在细胞膜上的分布情况和动态变化,揭示细胞膜的结构和功能。
2. 细胞器定位通过标记特定的蛋白或抗体,免疫荧光技术可以用于观察细胞器的定位,如线粒体、内质网、高尔基体等,帮助研究者了解细胞器在细胞内的分布和相互作用。
3. 蛋白相互作用免疫荧光技术也被广泛应用于研究蛋白之间的相互作用关系,通过标记不同的蛋白并观察它们在细胞内的共定位情况,可以揭示蛋白间的相互作用网络和信号传导路径。
4. 细胞功能研究通过观察细胞内荧光标记物的动态变化,免疫荧光技术可以帮助研究者了解细胞的代谢活动、信号转导和细胞周期等重要的生物学过程。
四、免疫荧光技术的发展和趋势1. 自动化和高通量随着技术的发展,免疫荧光技术已经向自动化和高通量方向发展。
自动化的设备和流程使得实验操作更加标准和高效,而高通量的技术则可以同时观察大量样品,加快研究进程。

免疫荧光法(免疫细胞化学)免疫荧光法(免疫细胞化学)免疫荧光法,也称为免疫细胞化学,是一种用于检测和定位特定分子在细胞或组织中的分布的技术。
该方法利用荧光标记的抗体与目标分子结合,通过显微镜观察荧光信号的发射来确定其位置。
本文将介绍免疫荧光法的基本原理,实验步骤和应用领域。
一、基本原理免疫荧光法依赖于抗原与抗体的特异性结合。
在免疫细胞化学中,荧光标记的抗体与靶分子结合后,可以通过激发荧光,从而使得靶分子在细胞或组织中可见。
这种荧光标记可以通过直接结合或间接结合实现。
直接结合法是将荧光染料直接与抗体结合,制备成荧光标记的抗体。
这种方法操作简单,适合用于单一标记物的检测,但可能导致染色反应无法控制甚至给靶分子造成损伤。
间接结合法则是利用第二抗体与一抗体结合,然后再将第二抗体与荧光标记结合。
这种方法可以使用多个不同的抗体,并能将多个目标同时检测,具有高度特异性和灵敏度。
但是,操作过程相对繁琐,需要较长时间。
二、实验步骤1. 样本制备:取得所需检测的细胞或组织样本,处理好固定和预处理的步骤。
例如,细胞需经过固定、渗透、洗涤等操作,组织则需进行切片和脱水等步骤。
预处理的目的是为了提高抗体的结合效率和信号强度。
2. 抗体染色:将标记了荧光的一抗体或一抗体与标记物结合的复合物加到预处理好的样本上,充分孵育,以实现抗原和抗体结合。
3. 清洗:将标本进行适当的冲洗,使未结合的抗体、标记物等被去除。
4. 结果观察:将标本放置在荧光显微镜下观察,通过不同波长的光源激发和发射荧光信号。
5. 形态学观察:根据样本的特点、形态学特征及标记染色的荧光信号,判断目标分子的定位和表达情况。
三、应用领域免疫荧光法在生物医学和生命科学领域中得到了广泛应用。
以下是其主要应用领域的一些例子:1. 免疫细胞凝集试验:用于检测抗原与抗体间的反应,如血型鉴定等。
2. 免疫组织化学:通过检测和定位特定分子在组织中的分布,来研究疾病的发生和发展机制,如肿瘤标记物的检测等。

免疫荧光的技术介绍免疫荧光技术是一种基于抗原-抗体反应的荧光标记技术,常用于生物医学研究领域中的细胞、组织以及溶液等样本的分析和检测。
以下是关于免疫荧光技术的详细介绍:1.技术原理免疫荧光技术利用抗原-抗体反应的特异性,将荧光标记物与抗体结合,从而实现对样本中特定抗原的精确检测。
抗原-抗体反应具有高度的特异性和灵敏性,使得免疫荧光技术成为一种具有高分辨率和高灵敏度的分析方法。
2.常用样本类型免疫荧光技术适用于多种类型的样本,包括细胞、组织、溶液等。
其中,细胞样本可以是单细胞悬液、细胞培养物或组织切片等;组织样本可以是病理切片、器官组织等;溶液样本则可以是血清、尿液、脑脊液等体液成分。
在制备样本时,需要保持样本的稳定性和活性,以便进行后续的实验操作。
3.标记方法免疫荧光技术的标记方法主要包括荧光素、生物素、抗生物素等。
其中,荧光素是最常用的标记物之一,其具有高荧光量子产率、良好的光稳定性以及优良的生物相容性等特点。
生物素和抗生物素则是一对亲和素和抗亲和素的标记物,可以用于放大免疫反应的信号,提高检测的灵敏度。
此外,标记过程中的关键控制参数包括抗体浓度、孵育时间、温度和pH值等,需要根据实验的具体情况进行优化和调整。
4.荧光显微镜观察在进行免疫荧光实验时,需要使用荧光显微镜对样本进行观察和拍照。
荧光显微镜的基本构造包括激发光源、滤光片、目镜和物镜等部分。
在观察时,需要选择适当的激发光源和滤光片,以最大程度地激发荧光信号并抑制背景噪声。
同时,需要调节物镜和目镜的焦距,以便清晰地观察到样本中的荧光信号。
拍照时,需要选择合适的曝光时间和增益,以便真实地记录样本中的荧光信号。
5.数据分析与解释对于观察到的荧光信号,可以使用相关的图像分析软件进行定性和定量分析。
这些软件通常具备多种图像处理功能,如背景噪声的去除、信号强度的测量、目标区域的识别等。
结合文献资料,可以对数据分析结果进行深入探讨,从而得出有关样本中抗原分布和含量的有价值的信息。

免疫荧光技术的实验方法及其分类一、免疫标记法及其分类1.荧光免疫法原理是应用一对单克隆抗体的夹心法。
底物用磷酸-4-甲基伞形酮,检测产物发出的荧光,荧光强度与Mb浓度呈正比,可在8min内得出结果。
结果以Mb每小时释放的速率表示(△Mb)表示。
该法重复性好,线性范围宽,具有快速、敏感、准确的特点。
以双抗夹心法为例,首先将特异性抗体与固相载体连接,形成固相抗体。
除去未结合抗体,然后加受检标本,使其中的蛋白抗原与固相抗体形成抗原抗体复合物。
洗涤除去未结合物,接着加入荧光标记的抗体,使之与抗原特异性结合,形成抗体—抗原—抗体复合物。
最后根据荧光强度,即可对蛋白抗原进行定量。
传统的荧光免疫法受本底荧光的干扰较大,时间分辨荧光免疫测定法是以具有特长寿命的稀土金属如铕,作为标记物,加入正常液后激发测定,能有效去除短寿命本底荧光的干扰。
2.放射免疫法放射免疫法是以过量的未标记抗原与放射性物质标记的抗原,竞争性地与抗体结合,形成有放射性的抗原—抗体复合物与无放射性的抗原—抗体复合物,并有过剩的标记抗原与未标记的抗原。
然后通过离心沉淀等方法,将抗原—抗体复合物与游离抗原分离,分别测定其放射性强度与标准曲线比较,即可对未标记的待测抗原进行定量。
RIA法测定血清蛋白灵敏度高、特异性强,可准确定量到ng/ml水平。
但早期的方法操作麻烦,耗时长,且有放射性污染。
近年来,随着单克隆抗体的应用,RIA的灵敏度又有了较大提高,且操作大为简化,并已有商品试剂盒供应,使用方便。
3.酶联免疫法(ELISA)ELISA法有竞争法和夹心法两种。
竞争法是基于标准或血清Mb和微孑L板上包被的Mb竞争性地与单克隆抗体相结合的原理而建立,该法的最低检测限为10μg/L,线性范围达1 000ug/L。
夹心ELISA法与EIA具有良好的相关性(r=0.92)。
ELISA法具有灵敏度高,特异性强,精密度好,操作简单,适用于多份标本的检测,不需特殊仪器设备等优点,易于推广普及。

免疫荧光法(免疫细胞化学)免疫荧光法,又称免疫细胞化学,是一种常用于检测生物组织或细胞中特定抗原的方法。
该方法基于抗体和抗原的特异性结合,通过标记荧光物质使抗原在显微镜下可见,从而实现对抗原的定位和分析。
免疫荧光法在医学诊断、生物研究和疾病治疗方面具有广泛的应用。
免疫荧光法主要有间接免疫荧光法和直接免疫荧光法两种常用的技术路线。
在间接免疫荧光法中,首先与待检测物质结合的主抗体通过蛋白A或其他特异性标记物结合于抗体上,然后将荧光染料标记的二抗与主抗体结合。
而在直接免疫荧光法中,待检测物质直接与荧光染料标记的主抗体结合。
免疫荧光法具有以下特点和优势。
首先,该方法可以实现高度特异性的抗原-抗体结合,提供了对生物组织或细胞中特定分子的具体定位。
其次,免疫荧光法能够同时检测多个抗原,通过使用不同的荧光染料标记不同的抗体。
这种多重染色技术为研究者提供了同时观察多种分子相互作用和定位的能力,有助于深入了解生物进程。
此外,免疫荧光法对样本的要求较低,可以应用于多种类型的样本,包括细胞培养、组织切片和体液等。
免疫荧光法在多个领域中发挥重要作用。
在医学诊断中,它常用于检测感染病原体、肿瘤标志物和自身免疫性疾病等。
例如,通过特定抗体的荧光染色,医生可以确定细菌或病毒是否存在,并根据染色的位置和强度进行病理诊断。
在生物研究中,免疫荧光法广泛应用于蛋白质定位、细胞信号传导和分子相互作用的研究。
此外,免疫荧光法还常被用于疫苗研发和疾病治疗中,通过精确定位抗原和荧光下标记药物,为新药的研发打下基础。
总之,免疫荧光法作为一种重要的实验技术,凭借其高度特异性、多重染色和样本适应性等优势,为生物学研究、医学诊断和药物开发提供了强有力的工具。
不断的技术创新和方法改进将进一步推动免疫荧光法在各个领域的应用,并为深入理解生物系统和疾病机理提供重要支持。

免疫荧光总结范文免疫荧光(Immunofluorescence)是一种常用的免疫学实验技术,通过特异性抗体与目标分子的结合,利用荧光染料标记抗体,实现对目标分子的定位与检测。
免疫荧光技术广泛应用于生物医学研究、临床诊断、药物开发等领域,其高度灵敏、高度特异的特点使其成为生命科学研究中的重要工具。
免疫荧光的原理基于特异性抗体与抗原的结合,抗体与抗原形成复合物后,通过二抗(第二抗体)与标记的荧光物质(如荧光染料)反应,使得目标分子带有荧光标记,从而可以利用荧光显微镜等设备观察与检测。
免疫荧光技术具有许多优势。
首先,免疫荧光技术具有极高的灵敏度,可以检测到极低浓度的目标分子。
其次,免疫荧光技术具有高度特异性,可以区分不同的分子。
再者,免疫荧光技术可以实现对目标分子在细胞或组织中的定位和分布的观察,从而研究其在生物过程中的功能及作用。
此外,免疫荧光技术还可以用于多重荧光染色,通过标记不同颜色的荧光染料进行同步观察多个目标分子或多个细胞结构,有助于研究多个因子之间的相互作用以及分子和细胞内部的相关关系。
免疫荧光技术的应用领域非常广泛。
在生物医学研究中,可以用于检测抗体与抗原之间的结合情况,研究蛋白质表达、分布以及相关的细胞和器官的功能与代谢过程。
在临床诊断中,免疫荧光技术可以用于检测病原体、肿瘤细胞、免疫球蛋白等相关的生物标记物,对疾病的早期诊断和治疗起到重要的作用。
在药物开发过程中,免疫荧光技术可以用来研究新药的递送、药物-受体相互作用等药物动力学与药理学问题。
尽管免疫荧光技术有许多优点,但仍然存在一些局限性。
首先,由于荧光信号容易衰减,对样本的光照、图像捕获和处理要求严格,以保证结果的准确性。
其次,免疫荧光技术对仪器设备的要求较高,需要配备高分辨率、高灵敏度的荧光显微镜等设备。
此外,荧光染料的选择与免疫染色条件的优化也对结果产生影响,需要根据不同的研究目的进行调整和优化。
总之,免疫荧光技术是一种重要的实验手段,在生物医学研究中发挥着重要作用。

免疫荧光SOP一.总纲(一)技术原理免疫荧光技术(immunofluorescence,IF)。
基本原理是抗原与抗体特异性结合,具体为带荧光标记的抗体在组织细胞上与抗原特异性结合,在荧光显微镜下,对抗原进行定性、定位和定量检测的技术。
(二)研究进展二.实验操作免疫荧光基本操作流程如下:(一)切片脱蜡水化脱蜡水化的目的是将石蜡包裹住的抗原暴露于与抗体结合的水环境中,便于两者结合。
若脱蜡和水化不全,则易出现局灶性反应和浸洗不全,而产生非特异性背景着色。
1.实验操作如下:(1)烤片:将石蜡切片置于烤箱中烤片60min;(2)脱蜡:入二甲苯5min×3;(3)水合:100%乙醇,5min×2;95%乙醇5min;70%乙醇5min;ddH2O浸洗5min×2。
2.技术要点:(1)注意无水乙醇和二甲苯的新旧程度,若出现雾状,则需及时更换;(2)60℃烘箱烤片时间勿过久(二)抗原修复与封闭液封闭由于固定液和石蜡导致组织蛋白的氨基酸残基在分子内或分子间形成醛基,或发生蛋白交联,导致蛋白质三级结构或四级结构改变,出现空间位阻,从而封闭抗原决定簇,阻碍抗体与抗原的结合。
因此,需要进行抗原修复暴露抗原。
修复方法有很多种,常见的为高温高压修复法。
封闭目的为细胞表面(特别是淋巴造血组织、淋巴细胞、单核细胞等)存在Fc受体,可与抗体(Ig)结合,形成非特异性染色。
主要是与二抗的非特异性结合。
可用5%二抗来源动物种属的正常血清或5%BSA,可避免抗体蛋白吸附于组织切片中高电荷的胶原和结缔组织成分上,用于封闭组织切片的蛋白疏水基团。
1.实验操作如下:抗原修复以高温高压修复为例。
实验材料:柠檬酸盐组织抗原修复液(福州迈新),EDTA高温抗原修复(福州迈新),电压力锅(美的MY-12CH402A)A.柠檬酸盐高压抗原修复:(1)将商品化的柠檬酸盐缓冲液按说明书进行稀释,并调节pH至6.0;(2)将装有抗原修复液的修复盒置于已装有自来水的高压锅中,大火加热至沸腾;(3)将水化后的切片置于修复液中,盖上锅盖,扣上压力阀,继续加热中喷气,此时开始计时5min,压力锅断开电源,开气阀开盖;(4)取出修复盒自然冷却至室温。

免疫荧光技术实验目的用免疫荧光技术显示和检查细胞或组织内抗原或半抗原物质。
实验原理用荧光抗体示踪或检查相应抗原的方法称荧光抗体法;用已知的荧光抗原标记物示踪或检查相应抗体的方法称荧光抗原法。
这两种方法总称免疫荧光技术,因为荧光色素不但能与抗体球蛋白结合,用于检测或定位各种抗原,也可以与其他蛋白质结合,用于检测或定位抗体,但是在实际工作中荧光抗原技术很少应用,所以人们习惯称为荧光抗体技术,或称为免疫荧光技术。
以荧光抗体方法较常用。
(一)直接免疫荧光将标记的特异性荧光抗体,直接加在抗原标本上,经一定的温度和时间的染色,用PBS洗去未参加反应的多余荧光抗体,镜检。
实验试剂PBS、荧光标记的抗体溶液。
实验设备和材料可以避光的器皿(放反应物)。
操作步骤(1)滴加PBS于待检标本片上,10 min后弃去,使标本保持一定湿度。
(2)滴加适当稀释的荧光标记的抗体溶液,使其完全覆盖标本,避光,保温一定时间(参考:30 min)。
(3)取出玻片,置玻片架上,先用PBS冲洗后,再用的PBS浸泡洗涤,每次3-5 min,不时振荡。
(4)取出玻片,用滤纸吸去多余水分,但不使标本干燥,加一滴缓冲甘油,以盖玻片覆盖。
(5)立即用荧光显微镜观察(二)间接免疫荧光染色程序分为两步,第一步,用未知未标记的抗体(待检标本)加到已知抗原标本上,37℃保温1~2 h,使抗原抗体充分结合,然后洗涤,除去未结合的抗体。
第二步,加上荧光标记的抗球蛋白抗体或抗IgG、IgM抗体。
如果第一步发生了抗原抗体反应,标记的抗球蛋白抗体就会和已结合抗原的抗体进一步结合,从而可鉴定未知抗体。
实验试剂PBS、荧光标记的抗体溶液、4%多聚甲醛、PBST(含2%BSA)。
实验设备和材料可以避光的器皿(放反应物)。
操作步骤(以24孔板为例)(1)每孔用500 uL预冷的PBS洗细胞2次,之后每孔加250 uL 4%多聚甲醛,室温固定15 min。
(2)去除多聚甲醛,每孔用500 uL PBST洗细胞3次。
免疫荧光方法范文免疫荧光方法以免疫学原理为基础,利用抗原与抗体之间的特异性结合来完成检测。
一般情况下,抗体会与特定抗原结合形成免疫复合物。
免疫荧光方法通过标记这些抗体,使其能够发出荧光信号,从而在显微镜下观察到抗原的分布和定位。
在免疫荧光方法中,有两种主要的标记物,即间接标记和直接标记。
间接标记是将荧光染料标记在二抗(抗原抗体结合后与特异抗体结合的抗体)上,通过与一抗(与目标抗原特异结合的抗体)结合来标记目标抗原。
而直接标记是将荧光染料直接标记在一抗上,通过与目标抗原特异结合来标记。
免疫荧光方法的步骤主要包括样品固定、膜穿透、抗原检测和荧光显微镜观察等。
首先,样品需要进行固定处理,以保持细胞或组织的形态结构和抗原的稳定性。
常用的固定剂包括乙醇、甲醛和Tween-20等。
其次,为了使抗体可以进入细胞或组织内部与抗原结合,需要进行膜穿透处理。
这可以通过化学方法(如胰蛋白酶消化)或物理方法(如超声波处理)来实现。
接下来,加入与特定抗原结合的抗体,通过与抗原结合形成免疫复合物。
最后,使用荧光显微镜观察标记在抗体上的荧光信号,即可得到抗原的分布和定位信息。
免疫荧光方法具有许多优点。
首先,它具有高度的特异性,可以检测到非常低浓度的抗原。
其次,由于荧光信号可以通过荧光显微镜直接观察,因此可以得到定量、高分辨率的结果。
此外,荧光染料一般具有很强的耐久性,因此可以长时间保存样品的荧光信号。
免疫荧光方法在许多领域有着广泛的应用。
在医学诊断中,它常被用于检测和定位病原体或肿瘤标记物。
在生物学研究中,它可以用于观察细胞的特定结构、分子的定位和交互等。
在药物研发中,免疫荧光方法可以用于衡量药物的靶向性和药物在生物体内的分布。
总之,免疫荧光方法是一种重要的生物学技术,在医学诊断、生物学研究和药物研发等领域具有广泛的应用前景。
随着技术的不断发展和改进,免疫荧光方法将在细胞和分子生物学研究中发挥更加重要的作用。
细胞免疫荧光步骤1.在24 孔板里加 500 微升培养基,放爬片,接种细胞(做实验以 30-50%汇合度较好。
10000-30000 左右2.给药处理 24h。
3.P BS 洗三遍。
4.4%冷的多聚甲醛固定 15 分钟,PBS 洗三遍,每次 5min,摇床。
(避光)5.0.5%Triton X-100(PBS 配)破膜 15min,PBS 洗三遍,每次 5min,摇床。
6.5%BSA(牛血清白蛋白,PBS 配)封闭 60 分钟,不用洗。
7.加一抗孵育(5%BSA 配),4℃摇床过夜。
8.收集一抗,PBS 洗三遍,每次 5min,摇床。
孵育二抗 Alexa Fluor488(1:1000 ),室温 60min(避光)9.回收二抗,PBS 洗三遍,摇床,每次 5min。
10.0.5ug/mLDAPI(5%BSA 配,2 滴/ml)染核 15min。
(避光)11.PBS 洗三遍,每次 5min,摇床。
12.取载玻片,滴加 10uL 抗荧光衰减封片剂,将爬片有细胞面盖在封片剂上,指甲油封片子的对角线。
All steps usually at RT.1) Remove culture medium and fix cells (a common fixative is 4%formaldehyde in PBS, for 15 minutes)2) Wash well in PBS (3 x 5 minutes is typical)3) Permeabilize the cells (a common permeabilization reagent is 0.2%Triton X-100 in PBS for 30 minutes)4) Wash well in PBS5) (optional: Block for non-specific dye binding using the Image-iT FXImage Enhancer Solution, I36933)6) Block for non-specific antibody binding 30-60 minutes (a commonblocking solution would be 3-6% bovine serum albumin / 5% normalgoat serum / PBS, or commercial blocking reagents like our BlockAid, product B10710)7) Incubate in primary antibody for 30-60 minutes, in blockingsolution or overnight at 4 degrees (antibody concentrations vary, but usually between 0.5-10ug/mL)8) Wash well in PBS9) Incubate in secondary antibody for 30-60 minutes, in 3-6% bovineserum albumin / PBS (a good starting antibody concentration is 5ug/mL)10) Wash well in PBS11) Counterstain as needed (such as with DAPI, D1306)12) M ount in appropriate mounting medium (for fluorescent secondaries, agood antifade solution is best, such as ProLong Gold, P36934, orSlowFade Gold, S36937)。