原花青素的分离纯化实验方案(修改)
- 格式:docx
- 大小:14.99 KB
- 文档页数:3

原花青素的提取、分离及抗氧化性、稳定性的研究本文以葡萄籽、葡萄叶子为原料,对其原花青素的提取工艺进行了研究。
在提取葡萄籽中的原花青素时采用50%乙醇,料液比1/40,于60℃下热回流浸提2个小时,提取2~3次最优提取工艺,此工艺提取得到的原花青素提取物得率为22.01%,产品纯度为51.17%;提取葡萄叶子时采用70%乙醇,料液比1/50,于80℃下热回流浸提3个小时,提取1~2次的最优提取工艺,此工艺得到的原花青素得率为34.14%,纯度为13.66%。
对上述提取物进一步纯化,葡萄籽提取物选用AB-8大孔吸附树脂,50%乙醇为洗脱剂,流速控制在4mL/min左右,葡萄籽原花青素总的提取得率为9.09%,产品纯度能达到94~95%;葡萄叶子提取物选用D-101大孔吸附树脂,70%乙醇为洗脱剂,流速控制在4mL/min左右,其原花青素提取得率为18.21%,纯度为25.63%。
采用超滤法对大孔吸附后的葡萄籽精提物进行低聚体的提纯,其过膜后的单体儿茶素含量有明显增加,P5000约为过膜前的6.6倍,P1000为过膜前的7.7倍。
其中压力对超滤通量的影响较大,而温度影响较小,一般选择20~30psig,室温下操作即可,避免在操作过程中长时间将过滤液暴露于强光及空气中。
利用Sephadex LH20将P5000样继续分离,使含量较高的一种二聚体得到了富集。
原花青素的抗氧化(FRAP)、清除DPPH自由基实验表明,葡萄叶子原花青素抗氧化、清除自由基活性均强于抗坏血酸,稍强于葡萄叶子提取物,而与原花青素的低聚体、高聚体相差不大。
原花青素在不同温度、光照、氧气的条件下1~2天内具有较好的稳定性。
经长期(10天)紫外光照射不稳定,含量下降甚至消失,溶液颜色逐渐加深,但其抗氧化、清除自由基能力无显著性变化(p>0.05)。
抗坏血酸对紫外照射引起的原花青素不稳定能起到保护作用,并且存在剂量依赖效应。
类似于口服液等的原花青素溶液产品较适用微波法灭菌。

一种葡萄籽原花青素高效提取分离方法我折腾了好久一种葡萄籽原花青素高效提取分离方法,总算找到点门道。
最开始的时候我真的是瞎摸索。
我就想着把葡萄籽弄碎,然后就用那种很普通的溶剂泡着,觉得就能把原花青素提取出来了。
结果呢,提取出来的量特别少,而且纯度也不咋地。
我当时就知道,肯定是哪里有问题。
后来我看书上说,可能是葡萄籽破碎程度不够。
我就下狠手,把葡萄籽弄得特别碎,几乎成粉末了。
然后换了几种溶剂来试。
先用乙醇试,感觉比之前那次稍微好点了,但还是不符合我想要的高效的标准。
我就想啊,是不是加热会好点呢?就像煮豆子一样,加热能让东西更好地融合。
我就对泡着葡萄籽粉末的乙醇溶液加热。
但是加热的温度不好掌握啊。
有一次温度太高了,都把溶液煮冒烟儿了,结果原花青素可能给破坏掉了一部分。
那一次算是失败透顶了,提取出来的不但没多,还少了呢。
我就开始慢慢调整温度。
也不确定什么样的温度才是最适合的。
就一点点试,像摸着石头过河一样。
最后发现大概在多少多少度的时候,提取出来的量和纯度都有提高了。
但是这里边还有杂质呢。
我又想办法分离这个杂质。
我试过用那种过滤的方法,就像过滤茶叶末儿似的,但是不太好使。
后来我用了不知道哪个资料看到的离心法。
就是放到离心机里转啊转的。
转了不同的速度。
一开始速度不对的时候,根本就分离不干净。
就慢慢调整速度,当然这个过程也失败了好多次,有时候转完了发现还是很多杂质混在原花青素溶液里。
最后终于调到一个合适的速度,把大部分杂质都给甩出去了。
但我心里还是有点犯嘀咕,总觉得可能还不是最完美的。
可能还有别的更好的溶剂组合或者操作步骤能让这个提取分离更高效。
但我现在这个方法从我的实验来看,相对比之前用过的那些方法是好很多了。
如果谁要试的话,一定得在葡萄籽破碎、溶剂选择、加热温度还有离心速度上好好把控,不然很容易失败啊。
我这一路摸索过来,就感觉这是个特别细致的活儿,一点都不能马虎。

花青素提取实验报告花青素提取实验报告植物中的花青素是一类具有丰富颜色的天然色素,广泛存在于花朵、果实、叶子等植物组织中。
花青素不仅为植物赋予了吸引力的色彩,还具有很多生物活性,如抗氧化、抗炎、抗癌等。
因此,对花青素的提取和研究具有重要意义。
本实验旨在探究不同溶剂对花青素提取效果的影响,并比较不同植物材料中花青素的含量差异。
实验选取了红花、紫苏和紫甘蓝三种常见的植物材料作为研究对象。
实验步骤如下:1. 材料准备:准备红花、紫苏和紫甘蓝三种植物材料,并将其分别洗净、切碎备用。
2. 提取溶剂选择:选取乙醇、醋酸乙酯和水三种常用溶剂作为提取试剂,分别标注为A、B和C。
3. 提取过程:将每种植物材料分别加入三个烧杯中,每个烧杯中加入适量的提取溶剂,浸泡一段时间后,用搅拌棒搅拌均匀。
4. 过滤:将提取液用滤纸过滤,去除固体颗粒。
5. 浓缩:将过滤后的提取液分别倒入烧杯中,放在加热板上进行浓缩,直至溶剂蒸发完全。
6. 称量:将浓缩后的花青素溶液称量并记录。
7. 分光光度计测定:将每个烧杯中的花青素溶液分别转移到试管中,使用分光光度计测定吸光度。
8. 计算花青素含量:根据吸光度值,利用标准曲线计算出花青素的含量。
实验结果如下:在本实验中,我们选取了红花、紫苏和紫甘蓝三种植物材料进行花青素提取实验。
通过比较不同溶剂对花青素提取效果的影响,我们发现乙醇溶剂(A)对三种植物材料中花青素的提取效果最好。
在红花提取实验中,乙醇溶剂(A)的吸光度值最高,表明乙醇溶剂对红花中花青素的提取效果最佳。
紫苏和紫甘蓝的提取实验结果也是如此。
这可能是因为乙醇具有较好的溶解性,能够更好地溶解植物组织中的花青素。
此外,我们还发现不同植物材料中花青素的含量存在差异。
红花中花青素含量最高,紫苏次之,紫甘蓝最低。
这可能与不同植物材料的生长环境、基因差异等因素有关。
通过本实验,我们深入了解了花青素的提取过程以及不同溶剂对提取效果的影响。
同时,我们也发现了不同植物材料中花青素含量的差异。

大孔树脂分离纯化葡萄籽原花青素的研究梁敏;何丽娜;董新荣;崔夫知【摘要】本文研究了大孔树脂分离纯化葡萄籽提取物中原花青素的方法.先对5种大孔吸附树脂用静态筛选方法选择HPD100和HPD400树脂,进一步以动态吸附与解吸附实验比较了两种树脂对葡萄籽提取物原花青素的吸附与洗脱效果.结果表明:HPD100、HPD400树脂对葡萄籽提取物中原花青素的动态饱和吸附量分别为101.2和92.1mg·g-1,乙醇洗脱的总洗脱率分别为96.5%和92.0%;其中30%乙醇洗脱样品中原花青素含量分别为74.8%和85.0%;50%乙醇洗脱样品中原花青素含量分别为70.0%和73.9%.与HPD100相比较,HPD400更适合葡萄籽原花青素的分离与富集.【期刊名称】《化学工程师》【年(卷),期】2015(029)003【总页数】5页(P65-69)【关键词】葡萄籽;原花青素;大孔树脂;分离【作者】梁敏;何丽娜;董新荣;崔夫知【作者单位】湖南农业大学理学院,湖南长沙410128;湖南农业大学理学院,湖南长沙410128;湖南农业大学理学院,湖南长沙410128;湖南农业大学理学院,湖南长沙410128【正文语种】中文【中图分类】R284.2;O652.62原花青素(Procyanidins,PC)是一类自然界广泛存在的植物多酚类物质,具有良好的抗氧化作用,其清除自由基的能力是VC的50倍,VE的20倍[1]。
此外,还具有抗突变、抗心血管疾病、抗癌、延缓衰老等活性[2-4],因而引起了极大的关注。
葡萄籽是原花青素的重要来源。
我国是葡萄生产大国,大量葡萄用来酿酒,产生的大量籽具有综合利用的价值。
葡萄籽提取物需要分离纯化以提高原花青素的含量,其分离方法很多,其中大孔树脂吸附法由于操作简单、以再生利用、产品纯度高等特点受到人们的广泛关注。
曹明华[5]以O3F3大孔吸附树脂作为吸附剂,葡萄籽提取物以水溶解后上样,吸附树脂再以40%的乙醇溶液脱,葡萄籽中原花青素的纯度可达到85.8%,回收率可达到86.6%。

板栗壳中原花青素大孔吸附树脂分离纯化工艺优化随着人们对健康的关注度不断提高,越来越多的天然植物和植物提取物被广泛应用于食品、医药和化妆品等领域。
其中,板栗壳中的原花青素是一种具有抗氧化、抗癌、抗炎、降血压等多种生物活性的天然大分子化合物,具有广泛的应用价值。
为了开发和利用板栗壳中的原花青素,需要建立一个高效的分离纯化工艺,以提高产量和纯度。
本文将介绍一种基于大孔吸附树脂的板栗壳中原花青素分离纯化工艺,并结合实验数据进行优化。
1. 建立分离纯化工艺的重要性板栗壳中的原花青素是一种多酚类化合物,具有较强的吸附和结合能力,同时也存在着多种与之相似的杂质。
因此,建立一种高效的分离纯化工艺是十分必要的。
目前,板栗壳中原花青素的分离纯化方法主要有溶剂萃取、黄龙云实验法、聚乙烯醇/盐酸盐法等。
这些方法虽然能够从板栗壳中提取到原花青素,但是其操作复杂、成本高昂、产率低,且提纯程度也有一定的限制。
2. 大孔吸附树脂的基本原理大孔吸附树脂是一种具有高效分离纯化能力的吸附剂,其基本原理是利用分子间相互作用力(如静电作用、氢键作用)对杂质进行选择性吸附,以实现对目标分子的分离纯化。
大孔吸附树脂在选择性吸附杂质的同时,也可以将目标分子的极性、结构等特征纳入考虑范畴中,从而实现对目标分子的更精确选择性吸附。
3. 大孔吸附树脂分离纯化原花青素的实验过程从板栗壳中提取原花青素后,将经过预处理的板栗原花青素水溶液连续通过列装有大孔吸附树脂的柱子,使目标分子与吸附树脂发生相互作用。
随着操作流程的进行,杂质被选择性吸附在吸附树脂的内部孔道中,而目标分子则留在流出液中。
随着反复操作的进行,目标分子会不断被从吸附树脂上剥离出来,形成纯净的分离物。
4. 实验优化结果分析通过实验不断优化,我们最终得到了以大孔吸附树脂为基础的板栗壳中原花青素分离纯化工艺。
通过实验数据统计分析,我们得到了以下结果:(1)阳离子树脂CM-Sephadex C-25对板栗壳中原花青素的吸附效果最佳;(2)pH值在7.0~8.0的范围内,可获得最好的吸附效率和纯化效果;(3)采用15%乙醇水溶液进行洗脱,可获得较好的洗脱效果和高的回收率。

花青素的提取、测定仪器材料试剂:仪器:旋转蒸发仪,真空泵,分光光度计,真空干燥箱,水浴锅,天平材料:新鲜的紫葡萄和青葡萄试剂:无水乙醇,盐酸,铁氰化钾,三氯乙酸,硫酸亚铁实验步骤一、花青素的提取:1、挑选新鲜的紫葡萄薄洗净晾干,分离出果肉、果皮、籽粒2、将分离晾干的紫色葡萄果皮,80℃下干燥1h。
3、称取2g磨成粉末4、用含有1%盐酸的乙醇溶液浸提2次,合并提取液5、讲合并提取液进行抽滤6、60℃减压浓缩7、真空干燥8、得粗提取液2、提取条件的优化:p 水平A提取温度 /℃B乙醇浓度/%C提取时间/minD料液比/(g/ml)p 1 50 50 60 1:10 p 2 60 60 90 1:20 p 3 70 70 120 1:30A B C D 结果实验序号1 1 1 1 12 1 2 2 23 1 3 3 34 2 1 2 35 2 2 3 16 2 3 1 27 3 1 3 28 3 2 1 39 3 3 2 1K1K2K3Q确定最佳提取方案然后对果皮、果肉、籽粒进行提取,测定最佳提取部位。
3、纯化纸层析法提纯1.取准备好的滤纸条(2×20cm),将其一端剪去两侧,中间留一长约1.5cm,宽约0.5cm的窄条,并在滤纸剪口上方折叠出一条直线,作为画滤液细线的基准线。
2.用毛细吸管沾少许滤液在折线上描绘4~5次,注意要画得匀、直、细,每次画完细线要等其自然变干后再画第二根线。
3.在大试管中加入常用的展开剂有V(丁醇∶V(乙酸∶V(水=4∶1∶5,V(正丁醇∶V(2mol/LHCl=1∶1,V(乙酸∶V(浓HCl∶V(水=15∶3∶82,1%盐酸,V(浓HCl∶V(水=3∶97等(即层析液)。
然后将滤纸条固定于软木塞上,插入试管内,使窄端浸入溶剂中(色素点要略高于液面,滤纸条边缘不可碰到试管壁),盖紧软木塞,直立于阴暗处进行层析。
4.展开后剪下色斑,以酸化甲(乙醇洗涤、浓缩,即可得到样品。


葡萄籽中分离提取原花青素的研究花青素是一类多酚类化合物,其具有高效的清除自由基的功能,是一种新型、高效、低毒的天然抗氧化剂。
本实验通过浸提的方法从葡萄籽中提取原花青素,考察了不同溶剂、浸提时间、浸提温度、乙醇体积分数和料液比等单因素对浸提效果的影响,确定了最佳的单因素水平。
研究结果表明:本项目产品投资费用少,操作费用低,产品附加值高;原料为废物利用,变废为宝符合国家相关产业政策;几乎没有“三废”排放,使用的溶剂全部回收利用,废渣可以作为造纸或者饲料综合利用。
标签:花青素;葡萄籽;提取;正交实验1 概述原花青素是广泛存在于植物中的一类天然多酚类化合物,多以糖苷的形式存在,也称花色苷。
属于缩合鞣质或黄烷醇类。
最早而最丰富的花青素是从红葡萄渣中提取的葡萄皮红。
它于1879年在意大利上市。
由于原花青素的多种功效,由葡萄籽提取的原花青素已被我国卫生部批准为保健原料。
目前对原花青素的提取研究及保健作用研究已非常成熟。
已经将其应用到工业化产业,开发出多种原花青素的保健产品和化妆产品。
原花青素的产品已被广大消费者普遍接受。
2 葡萄籽中花青素的提取本实验通过浸提的方法从葡萄籽中提取原花青素,考察了不同溶剂、浸提时间、浸提温度、乙醇体积分数和料液比等单因素对浸提效果的影响,确定了最佳的单因素水平。
并通过设计正交实验,得出原花青素提取最佳工艺条件。
2.1 实验方法2.1.1 葡萄籽中原花青素的提取本实验采用甘肃紫轩酒业葡萄酒厂生产葡萄酒产生的葡萄籽下脚料作为本实验的原材料。
在生产葡萄酒压榨葡萄汁的糟粕和葡萄酒生产前和发酵后压榨的榨粕,所得的这些榨渣中,以换成干品计,约有50%的葡萄皮,45%的葡萄籽和少量的梗等,将该榨渣经粗选分离出葡萄籽,作为提取的原料。
所得的葡萄籽用粉碎机粉碎后,过20目筛,于磨口三角瓶中,经石油醚脱脂脱水份,得脱脂葡萄籽粉,用一浸提液在50℃的恒温水浴中回流浸提,离心后取上清液,反复提取若干次,最后洗涤残渣,将上清液和洗涤液合并,加入固体无水硫酸钠脱水,倾出上层溶液,在真空度为0.095MPa,温度为40℃的条件下真空浓缩,浓缩液冷却至室温,得到原花青素粗提液,干燥,制得粗提物。
一、实验目的1.了解原花色素及其分离提纯的常用方法。
2.学会用乙醇抽提法提取分离花色素和比色法测定其含量。
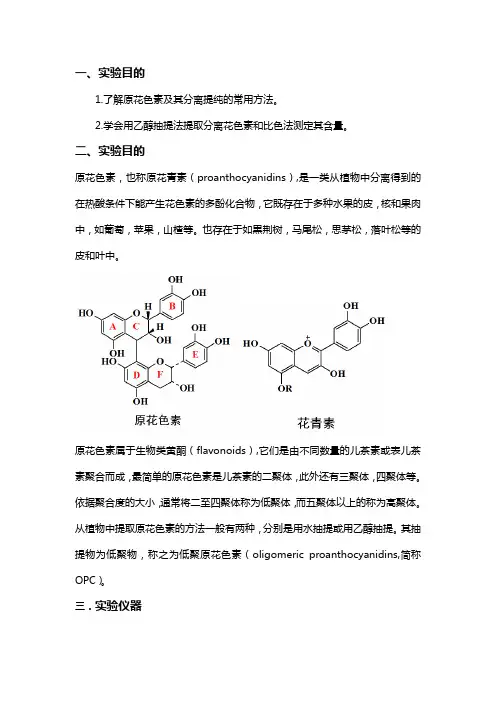
二、实验目的原花色素,也称原花青素(proanthocyanidins),是一类从植物中分离得到的在热酸条件下能产生花色素的多酚化合物,它既存在于多种水果的皮,核和果肉中,如葡萄,苹果,山楂等。
也存在于如黒荆树,马尾松,思茅松,落叶松等的皮和叶中。
原花色素属于生物类黄酮(flavonoids),它们是由不同数量的儿茶素或表儿茶素聚合而成,最简单的原花色素是儿茶素的二聚体,此外还有三聚体,四聚体等。
依据聚合度的大小,通常将二至四聚体称为低聚体,而五聚体以上的称为高聚体。
从植物中提取原花色素的方法一般有两种,分别是用水抽提或用乙醇抽提。
其抽提物为低聚物,称之为低聚原花色素(oligomeric proanthocyanidins,简称OPC)。
三.实验仪器1.试剂:花色素标准样品;甲醇;0.1%HCL-95%乙醇(V:V=70:30);无水乙醇;石油醚;乙酸乙酯;HCL-正丁醇(浓HCL5.0ml加入正丁醇95.0ml,混合即可);2%硫酸铁氨(硫酸铁氨2.0g溶于2.0mol/L HCL 100.0ml即可)2.器材:冷冻干燥机;旋转蒸发仪;分光光度计;水浴锅;电炉;电子分析天平3.材料:新鲜勒杜鹃花四、实验操作(一)勒杜鹃原花色素的提取1.材料处理:称取新鲜勒杜鹃10.0g,剪碎,置于锥形瓶中,加入3倍体积的石油醚,室温浸泡,脱去脂质物质和叶绿素,过滤,将勒杜鹃样品晾干,备用。
a)花色素的提取:提取剂0.1%HCL-95%乙醇(V:V=70:30)料液比(m:V=1:150),提取时间30分钟,控制提取温度60℃,提取次数2次,即提取液分2次加入。
2.花色素的纯化:由于样品中还是会含有其他杂质,如:蛋白质,维生素(水溶性维生素易溶于水而不易溶于非极性有机溶剂;脂溶性维生素易溶于非极性有机溶剂,而不易溶于水。
生研1002班姚远学号:2010001225葡萄籽中原花青素(OPC)的提取与纯化一、原花青素简介原花青素是一种水溶性色素,可以随着细胞液的酸碱改变颜色。
细胞液呈酸性则偏红,细胞液呈碱性则偏蓝。
花青素(Anthocyanins)是构成花瓣和果实颜色的主要色素之一。
花青素为植物二级代谢产物,在生理上扮演重要的角色。
花瓣和果实的颜色可吸引动物进行授粉和种子传播。
常见于花、果实的组织中及茎叶的表皮细胞与下表皮层。
花青素属于酚类化合物中的类黄酮类(Flavonoids)。
基本结构包含二个苯环,并由3碳的单位连结(C6-C3-C6)。
花青素经由苯基丙酸路径和类黄酮生合成途径生成,由许多酵素调控催化。
以天竺葵色素(Pelargonidin)、矢车菊素(Cyanidin)、花翠素(Delphinidin)、芍药花苷配基(Peonidin)、矮牵牛苷配基(Petunidin)及锦葵色素(Malvidin)六种非配醣体(Aglycone)为主。
花青素因所带羟基数(-OH)、甲基化(Methylation)、醣基化(Glycosylation)数目、醣种类和连接位置等因素而呈现不同颜色。
[9]颜色的表现因生化环境条件的改变,如受花青素浓度、共色作用、液胞中pH値的影响(Clifford)。
橙色和黄色是胡萝卜素的作用。
1910年在胡萝卜中发现了β-胡萝卜素,以后共发现另外2种胡萝卜素异构体,分别是:α、β、γ三种异构体。
1958年β-胡萝卜素获得专利,目前主要从海洋中提取,也可人工合成。
[1]食品中几种重要花青素的结构自然界有超过300种不同的花青素。
他们来源于不同种水果和蔬菜如紫甘薯、越橘、酸果蔓、蓝莓、葡萄、接骨木红、黑加仑、紫胡罗卜和红甘蓝、颜色从红到蓝。
这些花青素主要包含飞燕草素(Delchindin)、矢车菊素(Cyanidin)、牵牛花色素(Petunidin)、芍药花色素(Peonidin)。
花青素颜色随PH值发生变化,从当PH值为3时的覆盆子红到当PH值为5时的深蓝莓红。

原花青素提取
原花青素是一种天然的色素,存在于一些水果、蔬菜和植物中,如蓝莓、紫薯、紫甘蓝、红心莲雾等。
原花青素具有抗氧化、抗炎、抗癌等多种生物活性,对人体的健康和预防疾病具有重要的作用。
原花青素的提取方法主要有以下几种:
1. 溶剂提取法:使用适当的溶剂(例如乙醇、甲醇、丙酮等)将植物材料中的原花青素溶解出来,然后进行过滤、浓缩、沉淀等步骤,最后得到纯化的原花青素。
2. 水溶性聚合物提取法:将适量的植物材料浸泡在水溶性聚合物(如聚乙烯吡咯烷酮)溶液中,利用聚合物与原花青素之间的亲和性,将原花青素吸附到聚合物上,然后经过水洗、离心等步骤,最后从聚合物中脱附得到原花青素。
3. 超声波提取法:利用超声波的震荡作用,加速溶剂与原花青素之间的质量转移,使得原花青素更容易被溶解和提取出来。
该方法操作简单、高效,可以快速得到较高纯度的原花青素。
值得注意的是,不同的提取方法可能适用于不同的植物材料和实验要求,选择合适的提取方法可以提高提取效率和纯度。
同时,提取过程中还应注意对材料的保护,避免影响原花青素的质量和活性。
大孔树脂分离纯化葡萄籽原花青素的研究近几年,葡萄果实及其衍生物因其众多的健康保健功能而备受关注,其中最突出的特性之一便是抗氧化性。
相对于其他果实,葡萄果实中原花青素含量和抗氧化活性最为突出,因此近来一直受到广泛的研究关注。
葡萄籽原花青素具有良好的营养价值和保健作用,用于制备营养和保健产品,但高分子粘滞物质的存在使将其以纯化形式从葡萄籽中萃取出来变得复杂且耗时。
大孔树脂是一种新型的碳基交换材料,可以有效地分离、纯化和富集复杂的原料中的有效成分。
本文旨在研究通过大孔树脂纯化葡萄籽原花青素的有效性和可行性。
经过胶体着色技术、核磁共振成像技术、色谱技术等测试,结果表明,大孔树脂纯化葡萄籽原花青素的效率高达95%,原花青素纯度达到90%以上。
此外,大孔树脂纯化葡萄籽原花青素的特性,如抗氧化活性、安定性和色泽等,均满足了质量控制的要求。
这表明,大孔树脂分离纯化葡萄籽原花青素是可行的,既可以迅速提高产品质量,又可以为消费者提供更安全、更有效的产品。
大孔树脂分离纯化葡萄籽原花青素还具有优势,能够选择性地纯化黄酮类化合物,保持其活性,并可以减少储存损失、改善品质和生产效率。
因此,大孔树脂分离纯化葡萄籽原花青素不仅可以有效降低成本,而且可以提高效率,满足消费者的不同需求。
总的来说,大孔树脂分离纯化葡萄籽原花青素具有显著的科学价值,为研究原花青素萃取技术提供了新的方法,也为开发新型抗氧化剂、营养保健产品奠定了基础。
与其他技术相比,本研究显示大孔树脂分离纯化葡萄籽原花青素安全、高效、经济,具有重要的应用价值,可以满足消费者对原花青素保健功能的需求。
本研究结果表明,大孔树脂纯化葡萄籽中的原花青素是有效的,且具有良好的效果。
未来的研究可以进一步深入探索大孔树脂纯化葡萄籽原花青素的机理,以及外界因素如温度、pH值、质量浓度和籽粒粒径对原花青素纯化过程的影响,以提高原花青素的纯化效率,为葡萄籽原花青素的开发和应用提供参考。
综上所述,本研究的结果表明,大孔树脂可作为一种纯化葡萄籽原花青素的有效工具,可有效提高产品质量和满足消费者的安全需求,具有广阔的应用前景。
花青素的提取、测定仪器材料试剂:仪器:旋转蒸发仪,真空泵,分光光度计,真空干燥箱,水浴锅,天平材料:新鲜的紫葡萄和青葡萄试剂:无水乙醇,盐酸,铁氰化钾,三氯乙酸,硫酸亚铁实验步骤一、花青素的提取:1、挑选新鲜的紫葡萄薄洗净晾干,分离出果肉、果皮、籽粒2、将分离晾干的紫色葡萄果皮,80℃下干燥1h。
3、称取2g磨成粉末4、用含有1%盐酸的乙醇溶液浸提2次,合并提取液5、讲合并提取液进行抽滤6、60℃减压浓缩7、真空干燥8、得粗提取液二、提取条件的优化:--完整版学习资料分享----确定最佳提取方案然后对果皮、果肉、籽粒进行提取,测定最佳提取部位。
三、纯化纸层析法提纯1.取准备好的滤纸条(2×20cm),将其一端剪去两侧,中间留一长约1.5cm,宽约0.5cm的窄条,并在滤纸剪口上方折叠出一条直线,作为画滤液细线的基准线。
2.用毛细吸管沾少许滤液在折线上描绘4~5次,注意要画得匀、直、细,每次画完细线要等其自然变干后再画第二根线。
3.在大试管中加入常用的展开剂有V(丁醇)∶V(乙酸)∶V(水)=4∶1∶5,V(正丁醇)∶V(2mol/LHCl)=1∶1,V(乙酸)∶V(浓HCl)∶V(水)=15∶3∶82,1%盐酸,V(浓HCl)∶V(水)=3∶97等(即层析液)。
然后将滤纸条固定于软木塞上,插入试管内,使窄端浸入溶剂中(色素点要略高于液面,滤纸条边缘不可碰到试管壁),盖紧软木塞,直立于阴暗处进行层析。
4.展开后剪下色斑,以酸化甲(乙)醇洗涤、浓缩,即可得到样品。
四、花青素的测定1.采用普鲁士蓝法测定花青素的还原能力。
取一定浓度的样品溶液1 mL,加入磷酸盐缓冲液和1%K3Fe(CN)6各2.5 mL,混合均匀,混合液50 ℃保温20 min,快速冷却,加入10 %的三氯乙酸溶液2.5 mL,离心10 min。
取上清液2.5 mL,加入等量蒸馏水和0.1%的FeCl3 1mL,摇匀,10min后700nm下测定吸光值A700,以抗坏血酸为对照。
大孔树脂分离纯化葡萄籽原花青素的研究
葡萄籽原花青素具有很强的生物活性,可以抗氧化、降低血压和
血脂,抗肿瘤等一系列的作用。
但由于其分散性差而无法直接用于工
业生产。
因此,近年来,大孔树脂是应用于葡萄籽原花青素分离纯化
的一种有效的技术。
在这项研究中,首先,通过采用不同酸度、体积颗粒大小和有机
浓度及分散体系温度等参数对葡萄籽甾醇进行了≤1 mol/L 的多步提取,以获取较高的葡萄籽原花青素提取效率。
然后,研究人员采用了
多因子正交试验(活性炭、活性炭黏着剂),探索最佳萃取条件。
最后,经过各种操作技术的优化,选择了理想的超级分子过滤模板(SMS)和强迫流程(FP),对所得的萃取液在离子交换树脂上完成了大规模
的纯化,从而有效提取出高纯度的葡萄籽原花青素。
本研究表明,通过综合采用多种分离技术,如多步提取、多因子
正交试验、超级分子过滤模板和强迫流程,大孔树脂可有效分离和纯
化葡萄籽原花青素 / 阿魏酸。
研究为葡萄籽原花青素的研发利用奠定
了基础。
原花色素分离纯化及鉴定原花色素的提取纯化和鉴定(一)山楂原花色素的提取(二)原花色素的测定(盐酸-正丁醇法)原理原花色素,也称原花青素(proanthocyanidins),是一类从植物中分离得到的在热酸条件下能产生花色素的多酚化合物,它既存在于多种水果的皮,核和果肉中,如葡萄,苹果,山楂等。
也存在于如黒荆树,马尾松,思茅松,落叶松等的皮和叶中。
原花色素属于生物类黄酮(flavonoids),它们是由不同数量的儿茶素或表儿茶素聚合而成,最简单的原花色素是儿茶素的二聚体,此外还有三聚体,四聚体等。
依据聚合度的大小,通常将二至四聚体称为低聚体,而五聚体以上的称为高聚体。
从植物中提取原花色素的方法一般有两种,分别是用水抽提或用乙醇抽提。
其抽提物为低聚物,称之为低聚原花色素(oligomeric proanthocyanidins,简称OPC)。
生理功能:1.最好的心脏保护剂。
抵御引发心血管病的诱变因素的冲击。
强化血管,有消肿化瘀的功效。
减少毛细血管的阻力和改善渗透性,使细胞更容易吸收养分与排除废物。
2.高校抗氧化能力。
清除氧自由基的能力比其他天然抗氧化剂如胡萝卜,维生素C和E,儿茶素等强很多。
3.产生组胺的抑制剂,减轻炎症。
抗过敏,皮肤保健,抗衰老。
利用低聚原花色素溶于水的特点,用热水煮沸抽提原花色素,再用大孔吸附树脂吸附,洗脱得到原花色素。
D101树脂是一种球状,非极性教练聚合物吸附剂,具有相当大的比表面积和适当的孔径,对皂苷类,黄酮类,生物碱等物质有特殊的选择性,适用于从水溶液中提取泪滴性质的有机物质。
原花色素的检测方法:1.紫外分光光度法:利用原花色素在波长280nm处具有最大吸收的特点。
该方法简便易行,但提取物成分多样,标准难定。
2.香草醛检测法:原花色素在酸性条件下,其组成单元儿茶素的A 环上的羟基和香草醛发生缩合反应,在浓酸的作用下形成的产物变为有色的正离子。
3.铁盐催化比色法4.薄层层析法5.HPLC法6.HPLC-MS质谱法试剂:1)1mg/ml原花色素标准品(实验室提供)精确称取10.0mg原花色素标准品用甲醇溶解,与10.0ml容量瓶中定容至刻度。
原花青素的分离纯化
一、实验目的
对上一步提取的原花青素进行分离纯化,熟悉实验相关仪器设备及过程
二、仪器、材料及试剂
原花青素提取液、原花青素标准品、大孔树脂、75%乙醇、60%乙醇(作解吸剂)、50%乙醇(作洗脱剂)、盐酸(磷酸或乙酸)、分析天平、带筛板的玻璃柱(可无筛板,但是要脱脂棉或者用酸式滴定管改装(尝试性),同样需要脱脂棉)、紫外分光光度计(286nm)(可用可见光分光光度计(536nm)代替)、真空干燥箱(用真空泵+密封的抽滤瓶(尝试)代替)、PH计、铁架台、漏斗(小号)、小试管若干(不少于5支)、试管架、烧杯若干(不少于3个)、玻璃棒、滴管、锥形瓶
三、实验步骤
大孔树脂的预处理:
新购树脂含有未聚合单体、致孔剂、分散剂等残留的杂质成分,使用前必须加以处理。
将新购大孔树脂用乙醇浸泡24h,充分溶胀,取一定量湿法装柱,先用适当浓度的乙醇清洗至洗出液加等量蒸馏水无白色浑浊为止,再用蒸馏水洗至无醇味且水液澄清,备用。
通过乙醇(或甲醇)与水交替反复洗脱,可除去树脂中的残留物,一般洗脱溶剂用量为树脂体积的2~3倍,交替洗脱2~3次,最终以水洗脱后即可使用。
大孔树脂动态饱和吸附曲线图的绘制:
1、将试验中需要用到的50%乙醇、60%乙醇的PH用盐酸调至5,在波长为286nm(如果采用可见光分光光度计则为536nm)测定原花青素提取液的吸光值(以75%的乙醇溶液为对照)
2、取一定量的大孔树脂于烧杯中缓慢倒入50%的乙醇溶液(同时搅拌),搅拌至可流动的糊状,取一支干净的带筛板的玻璃柱,将糊状大孔树脂加入玻璃柱,用手指轻轻敲打玻璃柱,使大孔树脂均匀铺在玻璃柱底部(用烧杯接住此时流出的液体),用50%的乙醇在柱上流动清洗,不时检查流出液,直至与水混合不呈白色浑浊为止(乙醇:水一1:5)。
然后以大量蒸馏水洗去乙醇(必须洗净乙醇,否则将影响吸附效果),待用。
将样品液直接或拌入树脂中加到已处理好的大孔吸附树脂柱柱顶,拌样时样液和树脂的比例为1:(2~3)。
(乙醇湿法装柱)
3、沿玻璃柱壁缓慢加入洗脱剂(50%的乙醇溶液,PH为5),使其覆盖在大孔树脂上方,厚度约为0.5cm,用滴管吸取原花青素提取液沿玻璃柱壁加入玻璃柱,再沿玻璃柱壁缓慢加入流动相(洗脱剂),使原花青素提取液流入大孔树脂床,并用试管在下方接收流出液
4、每5ml(大约)接收一份流出液,测定吸光值,重复此流程直至流出液的吸光值相近,根据所测数据绘制大孔树脂动态饱和吸附曲线图
饱和大孔树脂的解吸:
5、向玻璃柱缓慢加入60%的乙醇溶液(PH为5)进行解吸,用
锥形瓶接收流出液,当流出液为无色时停止接收
6、将接收的流出液(取少量用于测定吸光值)用真空干燥箱减压浓缩至干,得到固体粉状物,所得产物即为原花青素,并利用所测得的吸光值计算原花青素精制品的纯度
四、结果记录
1、大孔树脂动态饱和吸附曲线图
1.1、表格
1.2、吸附曲线图
2、原花青素精制品的纯度计算
假设原花青素标准品的纯度为100%,则相同浓度下的原花青素精制品溶液和原花青素标准品溶液所测得的吸光值之比则为原花青素精制品的纯度。
即:
A(原花青素精制品)/A(原花青素标准品)×100%。