铝及其化合物物
- 格式:ppt
- 大小:1.58 MB
- 文档页数:70

铝及其化合物1. 简介铝 (Aluminum) 是一种重要的金属元素,原子序数为13,化学符号为Al。
它属于13族元素,位于周期表的p区。
铝是地壳中含量最丰富的金属之一,存在于自然界中的矿石、土壤和岩石中。
2. 物理性质铝是一种具有银白色光泽的轻质金属,具有良好的导电性和导热性。
它的密度相对较低,为2.7 g/cm³,比许多其他金属都要轻。
铝的熔点为660.32℃,沸点为2519℃。
它具有良好的可塑性和可加工性,可以通过冶金工艺进行挤压、拉伸、铸造和轧制等加工过程。
3. 化学性质3.1 抗腐蚀性铝具有良好的抗腐蚀性,因为它能形成致密的氧化物膜表面,可以有效防止进一步的氧化和腐蚀。
3.2 反应性铝与空气中的氧气反应会生成一层薄的氧化铝表面,这一层氧化层可以保护铝的内部不被进一步氧化。
然而,在酸性介质中,铝会被溶解并产生氢气。
铝对碱性介质相对稳定,不会与碱发生剧烈反应。
4. 铝的主要用途4.1 建筑和建材铝是一种轻质金属,因此在建筑和建材领域有广泛的应用。
它可以用于制造铝合金门窗、铝制屋顶和外墙装饰板等。
4.2 包装由于铝的良好腐蚀性和可塑性,它被广泛用于食品和药品的包装材料。
例如,铝制罐头、箔纸和药品包装。
4.3 电力传输铝具有良好的导电性能,用于制造电力传输线路和电缆。
相比同等导电性能的铜导线,铝导线更轻便、成本更低。
4.4 汽车工业铝合金在汽车工业中的应用越来越广泛,可以降低汽车整体重量,提高燃油效率和降低尾气排放。
5. 铝的一些常见化合物5.1 氧化铝 (Al2O3)氧化铝是铝的一种重要化合物,也是一种常见的陶瓷材料。
它具有高熔点、高硬度和良好的绝缘性能,广泛应用于制陶、耐火材料和电子器件等领域。
5.2 氯化铝 (AlCl3)氯化铝是一种重要的无机化合物,通常以无水物的形式存在。
它是一种强酸性物质,可用作催化剂、腐蚀剂和氯化铝铝熔剂的原料。
5.3 硫酸铝 (Al2(SO4)3)硫酸铝是一种白色结晶固体,可溶于水。


铝及其化合物
的危害
铝及其化合物对人体有害,其危害有以下几点:
一是可能引发慢性毒性。
长期暴露于铝及其化合物就可能引发慢性毒性。
医学研究发现,铝会引起血液流变性,影响维生素D的吸收,引
起贫血和骨质疏松症,并可能与脑疾病、癌症等有关。
二是可能对神经系统有害。
研究发现,铝及其化合物会损害血-脑屏障,影响神经细胞传递信息的正常情况,引起精神状态异常、记忆、注意
力集中力弱化等。
三是可能对细胞遗传水平有害。
长期暴露于铝及其化合物可能会通过
改变某些细胞里的基因,导致突变、发育异常和遗传病的发生,因此
铝对细胞遗传水平有潜在的危害。
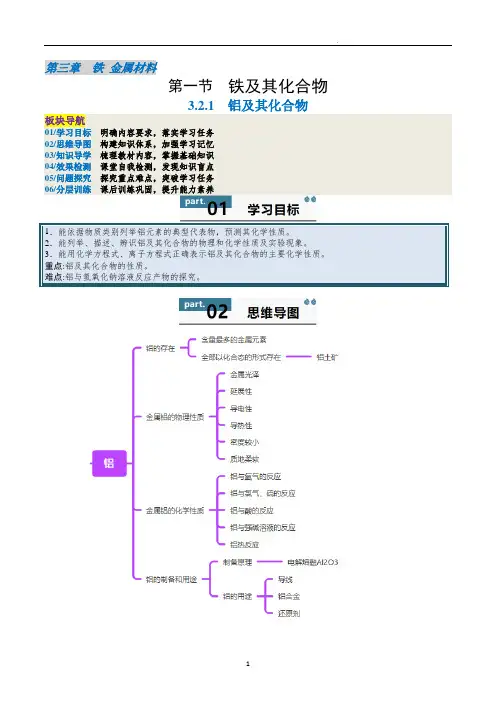
第三章铁金属材料第一节铁及其化合物3.2.1 铝及其化合物板块导航01/学习目标明确内容要求,落实学习任务02/思维导图构建知识体系,加强学习记忆03/知识导学梳理教材内容,掌握基础知识04/效果检测课堂自我检测,发现知识盲点05/问题探究探究重点难点,突破学习任务06/分层训练课后训练巩固,提升能力素养1.能依据物质类别列举铝元素的典型代表物,预测其化学性质。
2.能列举、描述、辨识铝及其化合物的物理和化学性质及实验现象。
3.能用化学方程式、离子方程式正确表示铝及其化合物的主要化学性质。
重点:铝及其化合物的性质。
难点:铝与氢氧化钠溶液反应产物的探究。
1.铝的存在:铝是地壳中含量最多的金属元素。
在自然界中铝元素全部以化合态的形式存在,以铝土矿的形式存在,主要成分是Al2O3,含少量Fe2O3和SiO2。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质(1)铝与氧气的反应①铝粉可以在纯氧中燃烧,发出耀眼的白光,生成氧化铝,4Al +3O 2=====点燃2Al 2O 3。
①常温下铝在空气中极易与氧气反应,表面生成一层致密的薄膜,能阻止氧气与铝进一步反应。
(2)铝与氯气、硫的反应:2Al +3Cl 2=====点燃2AlCl 3、2Al +3SAl 2S 3(3)铝与酸的反应——【实验3-4】 实验装置实验原理Al 2O 3+6HCl=2AlCl 3+3H 2O ;2Al+6HCl=2AlCl 3+3H 2↑ 实验用品盐酸、铝片;试管、酒精灯、木条。
实验步骤 在一支试管中加入5mL 盐酸,再向试管中放入一小块铝片。
观察实验现象。
过一段时间后,将点燃的木条放在试管口,你观察到什么现象?实验现象 开始无现象,一段时间后铝片逐渐溶解,然后冒铝片表面有大量气泡产生,试管壁有发热现象。
一段时间后,将点燃的木条放在试管口,可听到爆鸣声,后气体燃烧发出淡蓝色火焰实验结论 氧化铝和铝均能和盐酸反应。
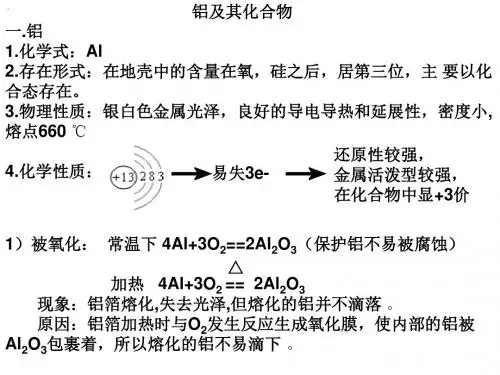

铝及其化合物(一)铝的性质1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。
有良好的导电、导热性和延展性。
2、化学性质:铝是较活泼的金属①通常与氧气易反应,生成致密的氧化物起保护作用。
4Al + 3O2 == 2Al2O3。
同时也容易与Cl2、S等非金属单质反应。
②与酸反应:强氧化性酸,如浓硫酸和浓硝酸在常温下,使铝发生钝化现象;加热时,能反应,但无氢气放出;非强氧化性酸反应时放出氢气。
(2Al+6H+=2Al3++3H2↑)③与强碱溶液反应:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑(2Al+2OH-+2H2O=2AlO2-+3H2↑ )④与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
⑤铝热反应:铝与某些金属氧化物的反应(如V、Cr、Mn、Fe的氧化物)叫做铝热反应2Al + Fe2O3高温Al2O3 + 2FeAl 和Fe2O3的混合物叫做铝热剂,利用铝热反应焊接钢轨。
(二)氧化铝(Al2O3)白色固体,熔点高(2054℃),沸点2980℃,常作为耐火材料;是两性氧化物。
我们常见到的宝石的主要成分是氧化铝。
有各种不同颜色的原因是在宝石中含有一些金属氧化物的表现,如红宝石因含有少量的铬元素而显红色,蓝宝石因含有少量的铁和钛元素而显蓝色。
工业生产中的矿石刚玉主要成分是α-氧化铝,硬度仅次于金刚石,用途广泛。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物Al2O3 + 6HCl == 2AlCl3 + 3H2O ,Al2O3 + 2NaOH == 2NaAlO2 + H2OAl2O3是工业冶炼铝的原料,由于氧化铝的熔点高,电解时,难熔化,因此铝的冶炼直到1886年美国科学家霍尔发现在氧化铝中加入冰晶石(Na3AlF6 ),使氧化铝的熔点降至1000度左右,通电铝的冶炼才快速发展起来,铝及其合金才被广泛的应用。
2Al2O3 4Al + 3O2↑(三)氢氧化铝(Al(OH)3)白色难溶于水的胶状沉淀,是两性氢氧化物。

铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。

△ 点燃铝 及 其 化 合 物一、铝的结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA 族最外层有三个电子,在化学反应中,容易失去最外层的三个电子,显+3价。
铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中。
二、铝单质的性质1、物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2、化学性质: 与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3思考:在金属活泼性顺序中铝排在铁的前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?解释: 铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
与化合物反应: 化合物----酸、碱、盐、氧化物(1)与酸: 2Al+6HCl ====== 2AlCl 3+H 2↑2Al+3H 2SO 4 ====== A l 2(SO 4)3+ 3H 2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(2)与碱反应:2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:(2)Al(OH)3+NaOH ======== NaAlO 2+2H 2O(3)盐:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(4)Fe 2O 3:即 铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3 [现象]:耀眼的光芒、放出大量的热、有熔融物生成。
镁条为引燃剂,氯酸钾为助燃剂用途:焊接钢轨冶炼某些难熔金属,如:V 、Cr、等化合价降低,被还原,得6e —(1)化合价升高,被氧化,失6e —高温 高温[试一试]:写出Al 分别与Fe 3O 4 、V 2O 5 的反应方程式8 Al + 3 Fe 3O 4 ====== 4 Al 2O 3+ 9 Fe10 Al + 3 V 2O 5 ====== 6 V+ 5 Al 2O 3三、铝的重要化合物1、氧化铝(Al 2O 3)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。



铝及其化合物的有关反应:1、单质铝铝与氧气的反应:4Al+3O2=点燃=2Al2O3铝与氯气的反应:2Al+3Cl2 ==2AlCl3铝与硫的反应:2Al+3S △Al2S3铝热反应: 2Al+Fe2O3△Al2O3+ 2Fe单质铝与盐酸的反应:2Al+6HCl==2AlCl3+3H2↑离子方程式:2Al+6H+=2Al3++3H2↑单质铝与氢氧化钠的反应:2Al+2 NaOH+2 H2O==2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑2、氧化铝氧化铝与盐酸的反应:Al2O3+6HCl==2AlCl3+3 H2O氧化铝与氢氧化钠的反应:Al2O3+2 NaOH== 2NaAlO2+ H2O3、氢氧化铝氢氧化铝与盐酸的反应:2Al(OH)3+6HCl==2AlCl3+3 H2O氢氧化铝与氢氧化钠的反应:Al(OH)3+ NaOH== NaAlO2+2H2O加热氢氧化铝的反应:2Al(OH)3△Al2O3+3 H2O4、铝盐(AlCl3)的反应氯化铝与适量的氢氧化钠反应:AlCl3+3 NaOH== Al(OH)3↓+3NaCl氯化铝与过量的氢氧化钠反应:AlCl3+4 NaOH== NaAlO2+2H2O+3NaCl 向氯化铝溶液中滴加氢氧化钠溶液至过量:Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2O总反应:Al3++4OH-=AlO2-+2H2O向氢氧化钠溶液中滴加氯化铝溶液至过量:Al3++4OH-=AlO2-+2H2O3AlO2-+Al3++6H2O=4Al(OH)3↓明矾净水原理: Al3++3H2O Al(OH)3(胶体)+3H+5、铝盐(AlCl3)用铝盐制备氢氧化铝的方法:氯化铝与氨水的反应:AlCl3+3 NH3·H2O== Al(OH)3↓+3NH4Cl 离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+5、偏铝酸盐(NaAlO2)用偏铝酸盐制备氢氧化铝的方法:偏铝酸钠与适量的盐酸的反应:NaAlO2+ HCl+H2O == Al(OH)3↓+NaClAlO2-+H++H2O=Al(OH)3↓偏铝酸钠与过量盐酸的反应:NaAlO2+4 HCl==AlCl3+2 H2O+NaClAlO2-+4H+=Al3++2H2O向偏铝酸钠溶液通入少量二氧化碳的反应:2NaAlO2+ CO2+3H2O== 2Al(OH)3↓+Na2CO32AlO2-+ CO2+3H2O== 2Al(OH)3↓+CO32-向偏铝酸钠溶液通入过量二氧化碳的反应:NaAlO2+ CO2+2H2O== Al(OH)3↓+NaHCO3AlO2-+ CO2+2H2O== Al(OH)3↓+HCO3-用铝盐和偏铝酸盐制备氢氧化铝的反应:氯化铝与偏铝酸钠的反应:AlCl3 +3NaAlO2+6 H2O== 4Al(OH)3↓+3NaClAl3++3AlO2-+6 H2O== 4Al(OH)3↓。
铝及其化合物方程式一、铝及其化合物方程式汇总铝是一种超级有趣的金属呢,它和它的化合物有好多超酷的方程式哦。
1. 铝与氧气反应方程式:4Al + 3O₂ = 2Al₂O₃。
这个反应在生活中很常见的啦,铝制品在空气中会慢慢被氧化,表面形成一层致密的氧化铝薄膜,就像给铝穿上了一层保护膜一样,这样里面的铝就不会继续被腐蚀啦。
2. 铝与盐酸反应方程式:2Al+6HCl = 2AlCl₃+3H₂↑。
想象一下,铝条放进盐酸里,就开始咕噜咕噜冒气泡,那些气泡就是氢气呢。
铝的活泼性比较强,能把盐酸中的氢置换出来,就像一个很热情的小伙伴,把氢从盐酸这个“小团体”里拉出来一起玩耍。
3. 铝与氢氧化钠溶液反应方程式:2Al + 2NaOH+2H₂O = 2NaAlO₂+3H₂↑。
这个反应有点特别哦,铝既能和酸反应又能和碱反应,是不是很神奇?氢氧化钠溶液里的铝就像个调皮的小精灵,在碱和水的环境里欢快地反应,产生偏铝酸钠和氢气。
4. 氧化铝与盐酸反应方程式:Al₂O₃+6HCl = 2AlCl₃+3H₂O。
氧化铝是两性氧化物,它遇到盐酸这个酸性物质,就乖乖地反应,生成氯化铝和水。
5. 氧化铝与氢氧化钠溶液反应方程式:Al₂O₃+2NaOH = 2NaAlO₂+H₂O。
氧化铝在氢氧化钠溶液里也很听话呢,反应生成偏铝酸钠和水,这也体现了它两性氧化物的特点。
6. 氢氧化铝与盐酸反应方程式:Al(OH)₃+3HCl = AlCl₃+3H₂O。
氢氧化铝是两性氢氧化物,当它遇到盐酸的时候,就像两个小伙伴凑在一起,反应生成氯化铝和水。
7. 氢氧化铝与氢氧化钠溶液反应方程式:Al(OH)₃+NaOH = NaAlO₂+2H₂O。
它遇到氢氧化钠溶液也会反应,生成偏铝酸钠和水。
8. 硫酸铝与氨水反应方程式:Al₂(SO₄)₃+6NH₃·H₂O = 2Al(OH)₃↓+3(NH₄)₂SO₄。
这个反应可以用来制取氢氧化铝哦,硫酸铝溶液里加入氨水,就会慢慢出现白色的氢氧化铝沉淀,就像下雪一样,白色的小颗粒慢慢在溶液里出现。
铝及其重要化合物一、铝1.物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
2.化学性质:(1)与非金属单质的反应:①铝与O 2反应:Al+3O 22Al 2O 3(在纯氧中,剧烈燃烧,发出耀眼的白光)②铝与S 反应:2Al+3SAl 2S3③铝与Cl 2反应:2Al +3Cl 2=====点燃2AlCl 3(2)与金属氧化物的反应(铝热反应):2Al+Fe 2O 32Fe+Al 2O 3 ;4Al+3MnO 23Mn+2Al 2O 3(3)铝与非氧化性酸反应:2Al + 6HCl =2Al Cl 3 + 3H 2↑ 2Al + 3H 2SO 4 =Al 2(SO 4)3 + 3H 2↑(4)铝与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化。
在加热条件下可与浓硫酸、浓硝酸反应但无H 2产生。
(5)铝与氢氧化钠溶液的反应:铝和碱溶液反应,不是直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
2Al +6H 2O=2Al(OH)3+3H 2↑, Al(OH)3+NaOH=2NaAlO 2+2H 2O总反应化学方程式为:2Al +2H 2O +2NaOH=2NaAlO 2+3H 2↑,其中氧化剂只是H 2O ,而不是NaOH 。
3.制备:工业上采用电解法:2Al 2O 3=====电解4Al +3O 2↑4.用途:纯铝用作导线(不能用作电缆线),铝合金用于制造汽车、飞机、生活用品等。
二、氧化铝(1)物理性质:高熔点,高沸点,高硬度,难溶于水的白色固体。
(2)化学性质:氧化铝难溶于水,却能溶于酸或强碱溶液中。
Al 2O 3 + 6HCl =2AlCl 3 + 3H 2O Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O因此说Al 2O 3是两性氧化物(既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物。