西北工业大学普通化学练习题
- 格式:doc
- 大小:150.00 KB
- 文档页数:8
![普通化学试题[1]](https://img.taocdn.com/s1/m/5a3be2d7d15abe23482f4dcf.png)

2025届陕西省西安市西北工业大学高二化学第一学期期中综合测试试题注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折暴、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、下列事实不能用勒夏特列原理解释的是()A.光照新制的氯水时,溶液的pH逐渐减小 B.加催化剂,使N2和H2在一定条件下转化为NH3C.可用浓氨水和氢氧化钠固体快速制取氨气 D.增大压强,有利于SO2与O2反应生成SO32、反应2Al+MoO3高温Mo+Al2O3可用于制备金属钼(Mo)。
下列有关说法正确的是()A.Al是还原剂B.MoO3被氧化C.Al 得到电子D.MoO3发生氧化反应3、下列事实不能用勒夏特列原理(平衡移动原理)解释的是()①铁在潮湿的空气中容易生锈②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深③实验室可用排饱和食盐水的方法收集氯气④钠与氯化钾共融制备钾Na(l)+KCl(l) K(g)+NaCl(l)⑤开启啤酒瓶后,瓶中马上泛起大量泡沫A.③④B.①②C.①⑤D.①②⑤4、称取两份等质量的铝粉,分别加入等体积等物质量浓度的浓NaOH溶液与盐酸溶液。
若最终铝全部溶解,则放出H2的体积比(同温同压下)是A.1:1 B.1:2 C.1:3 D.3:15、50 g某物质在80 ℃时完全溶解在100 g水中,随后逐渐降温,溶液中析出溶质的质量随温度的变化如图所示,则( )A.该物质的溶解度为50 gB.20 ℃时,溶液质量为150 gC.40 ℃时,溶液中溶质的质量为15 gD.在0~60 ℃范围内的溶液均为饱和溶液6、pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是A.A、B两种酸溶液物质的量浓度一定相等B.稀释相同倍数,A酸溶液的c(H+)比B酸溶液大C.a=5时,A是弱酸,B是强酸D.若A、B都是弱酸,则5>a>27、下列关于氢元素的说法中不正确的是( )A.氢元素是宇宙中最丰富的元素B.氢原子核外电子的电子云轮廓图是球形C.氢元素与其他元素形成的化合物都是共价化合物D.氢原子光谱是氢原子的电子跃迁产生的8、下列分散系中,能产生丁达尔效应的是A.硫酸铜溶液B.氢氧化铁胶体C.溴水D.稀硫酸9、将BaO2放入密闭真空容器中,反应2BaO2(s)2BaO(s)+O2(g)达到平衡。
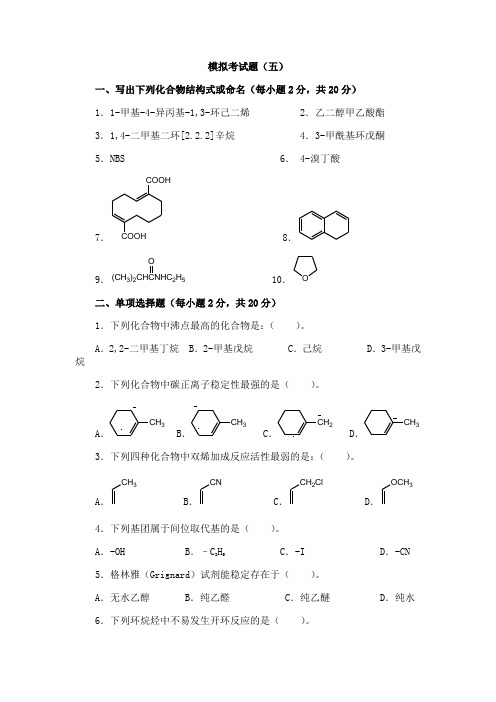
模拟考试题(五)一、写出下列化合物结构式或命名(每小题2分,共20分) 1.1-甲基-4-异丙基-1,3-环己二烯 2.乙二醇甲乙酸酯 3.1,4-二甲基二环[2.2.2]辛烷 4.3-甲酰基环戊酮 5.NBS 6. 4-溴丁酸7.COOHCOOH8.9.(CH 3)2CHCNHC 2H 5O10.O二、单项选择题(每小题2分,共20分)1.下列化合物中沸点最高的化合物是:( )。
A .2,2-二甲基丁烷B .2-甲基戊烷C .己烷D .3-甲基戊烷2.下列化合物中碳正离子稳定性最强的是( )。
A .CH 3B .CH 3C .CH 2D .CH 33.下列四种化合物中双烯加成反应活性最弱的是:( )。
A .CH 3B .CNC .CH 2ClD .OCH 34.下列基团属于间位取代基的是( )。
A .-OHB .–C 2H 5 C .-ID .-CN 5.格林雅(Grignard )试剂能稳定存在于( )。
A .无水乙醇B .纯乙醛C .纯乙醚D .纯水 6.下列环烷烃中不易发生开环反应的是( )。
A .环丙烷B .甲基环丙烷C .环戊烷D .环丁烷 7.下列化合物没有手性碳的是( )。
A .CH 3CHClCOOHB .CH 3CH 2CHClCH 3C .CH 2ClCH 2COOHD .CH 3CHDCH (CH 3)CH 2CH 3 8.下列化合物中酸性最强的是( )。
A .CH 3COOHB .C 6H 5COOH C .(COOH )2D .CH 2(COOH )2 9.鉴别伯、仲、叔卤代烷的有效试剂是( )。
A .FeCl 3溶液B .BaCO 3溶液C .AgNO 3乙醇溶液D .ZnCl 2/HCl 溶液 10.在催化剂作用下,乙烯氧化制环氧乙烷的氧化剂是( )。
A .高锰酸钾 B .氧气 C .重铬酸钾 D .臭氧 三、完成下列反应(每小题5分,共30分) 1.CH 3BrNaNH 23( )( )2.CF 3CCH 3CH 2ONa NaNH 23( )CH( )C 2H 5OH( )3.NaOH( )OH 32( )( )4.OC 2H 5( )( )5.O O O32NaOH( )2NaNO /HCl ( )0℃( )6.OOO( )四、推测结构(每小题5分,共10分)1.化合物A (C 9H 10O 3),它不溶于水、稀HCl 及稀NaHCO 3溶液,但能溶于NaOH 液。

西工大有机化学试题及答案一、选择题(每题2分,共20分)1. 下列化合物中,哪一个是芳香化合物?A. 甲烷B. 乙醇C. 苯D. 丙酮答案:C2. 哪个反应是亲电加成反应?A. 氢氧化钠与乙酸的反应B. 溴与烯烃的反应C. 氢气与烯烃的加成D. 酯化反应答案:B3. 下列哪个是有机化学中的保护基团?A. 甲基B. 乙酰基C. 羟基D. 羧基答案:B4. 以下哪个化合物是手性分子?A. 乙醇B. 甲烷C. 2-丁醇D. 2,3-丁二醇答案:C5. 哪个是有机合成中常用的还原剂?A. 硝酸B. 氢氧化钠C. 氢气D. 氯气答案:C6. 哪个反应是消除反应?A. 醇的脱水反应B. 酯的水解反应C. 酯的合成反应D. 醇的氧化反应答案:A7. 哪个是有机化学中的亲核试剂?A. 溴B. 氢氧化钠C. 硝酸D. 硫酸答案:B8. 下列哪个是有机化学中的偶极反应?A. 亲核取代反应B. 亲电取代反应C. 自由基取代反应D. 亲核加成反应答案:C9. 哪个是有机化学中的保护基团?A. 甲基B. 乙酰基C. 羟基D. 羧基答案:B10. 哪个反应是有机合成中常用的氧化反应?A. 醇的脱水反应B. 醇的氧化反应C. 烯烃的加成反应D. 酯的水解反应答案:B二、填空题(每空2分,共20分)1. 芳香化合物的特点是含有_______电子的共轭体系。
答案:π2. 亲电加成反应中,亲电试剂首先与_______反应。
答案:不饱和化合物3. 保护基团的作用是在有机合成过程中保护特定的官能团,防止其在反应中被_______。
答案:转化4. 手性分子是指具有_______的分子。
答案:非超posable镜像5. 还原剂在有机合成中的作用是将_______官能团转化为还原态的官能团。
答案:氧化态6. 亲核试剂是带有_______的分子或离子,它们倾向于与电子不足的原子反应。
答案:孤对电子7. 偶极反应是指反应物具有_______的化学反应。

一、单选题(共50 道试题,共100 分)1.烷基正离子稳定性最大的是()。
A.叔烷基自由基B.伯烷基自由基C.仲烷基自由基D.甲基自由基正确答案:20269078972.下列是邻、对位定位基的是()。
A.-COOCH<SUB>3</SUB>B.-N<SUP>+</SUP>R<SUB>3</SUB>C.-NO<SUB>2</SUB>D.-Br3.下列化合物进行硝化反应时速度最小的是()。
A.甲苯B.硝基苯C.氯苯D.苯甲酸4. 下列化合物中哪些可能有顺反异构体?()A.CHCl=CHClB.CH<sub>2</sub>=CCl<sub>2</sub>C.1-戊烯D.2-甲基-2-丁烯5.乙醇和二甲醚是什么异构体?()A.碳架异构B.位置异构C.官能团异构D.互变异构6.下列化合物发生亲核加成反应时活性最小的是()。
A.苯甲醛B.三氯乙醛C.甲醛D.苯乙酮7.下列物种中,属于Lewis酸的是()。
A.AlCl<sub>4</sub><sup>-</sup>B.NH<sub>3</sub>C.BF<sub>3</sub>D.H<sub>2</sub>8.鉴别伯、仲、叔胺的有效试剂是()。
A.FeCl<sub>3</sub>溶液B.NaNO<sub>2</sub>/HCl溶液C.AgNO<sub>3</sub>乙醇溶液D.ZnCl<sub>2</sub>/HCl溶液9.卡宾可以通过下列哪种方法生成?()A.重氮甲烷光分解B.乙烯氧化分解C.乙烯酮热分解D.甲烷氧化生成10.下列化合物能与高碘酸反应的是()。

2024届陕西省西北工业大学附中化学高一第一学期期中综合测试模拟试题注意事项1.考生要认真填写考场号和座位序号。
2.试题所有答案必须填涂或书写在答题卡上,在试卷上作答无效。
第一部分必须用2B 铅笔作答;第二部分必须用黑色字迹的签字笔作答。
3.考试结束后,考生须将试卷和答题卡放在桌面上,待监考员收回。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、设N A为阿伏加德罗常数的数值,下列说法正确的是A.常温常压下,48g O2和O3的混合气体中含有氧原子数为3N AB.17 g氨气所含质子数目为11N AC.标准状况下22.4L的四氯化碳,含有四氯化碳分子数为N AD.物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为1 N A2、短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素在考古时常用来鉴定一些文物的年代;B和氢组成的一种气体能使湿润的红色石蕊试纸变蓝;C、D为金属元素,且D原子最外层电子数等于其K层电子数;往E单质的水溶液中滴加少量紫色石蕊试液,观察到先变红后褪色。
下列说法正确的是A.14A与12A有相同的质子数,属于同一种核素B.某物质焰色反应呈黄色,该物质一定是含C的盐C.C单质与水反应后的溶液中滴加酚酞,溶液变红D.E单质在化学反应中只能作氧化剂3、浓度为2.00 mol/L的盐酸溶液1L,欲使其浓度变为4.00mol/L,下列方法可行的是()A.蒸发掉0.5L水B.标况下通入44.8L HCl气体C.将溶液加热蒸发浓缩至0.5L D.加入10mol/L盐酸0.6L,再将溶液稀释至2L4、下列物质与危险化学品标志的对应关系正确的是( )A.氯化钠B.乙醇C.木炭D.氢氧化钠5、下列反应既是置换反应又是氧化还原反应的是A.2F2+2H2O== 4HF+O2B.Cl2+H2O== HCl+HClOC .3NO 2+H 2O== 2HNO 3+ NOD .2Na 2O 2+2H 2O== 4NaOH +O 2↑6、现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是( )A .分液、萃取、蒸馏B .分液、蒸馏、萃取C .萃取、蒸馏、分液D .蒸馏、萃取、分液7、下列反应中属于氧化还原反应,但不属于四种基本反应类型的是 ( ) A .CuO + H 2 Cu + H 2O B .Fe 2O 3 + 3CO2Fe + 2CO 2C .2KMnO 4K 2MnO 4 + MnO 2 + O 2↑ D .NaOH + HCl = NaCl + H 2O8、已知4KMnO 与浓盐酸在常温下能反应产生2Cl 。
试题标准答案及评分标准课程名称普通化学(A 卷)一、选择题(每题2分,共30分)1 D;2 B;3 A;4 A;5 E;6 B;7 D;8 A;9 C; 10 A; 11 B; 12 B; 13 B; 14 C; 15 A二、填空题(每空1分,共25分)①逆向进行, Q=135.4> Kθ;②T>464.5 K, 1.6 ⨯10-6;③C6H12O6(葡萄糖)溶液,CaCl2溶液;④>0, >0;⑤(△S=89.93J·mol-1)向生成CO的方向进行, 向生成CO的方向进行;⑥MnO4-, Fe, MnO4- Br2, MnO4-;⑦-41.8, -41.8;⑧υ=kc2(NO)c(Cl2), 3, 则为原来的1/8;⑨ 1.285⨯10-3mol·dm-1, 8.49⨯10-7mol·dm-1, 增大; ⑩Fe, MnO4-, Fe Sn2+ I-;三、配平化学反应方程式(每题3分,共6分)(1)4H2O2(aq) + Cl2O7(aq) + 2OH- (aq) = 4O2(g) + 2ClO2-(aq) + 5H2O(l)(2)2MnO4-(aq) + 16H+(aq) + 10Cl-(aq) = 2Mn2+(aq) + 8H2O(l) + 5Cl2 (g)四、判断题(每题1分,共10分)1 ⨯ 2√ 3√ 4⨯ 5√ 6⨯ 7√ 8√ 9√ 10⨯五、计算题(第1小题9分,第2、3小题10分,共29分)1.⑴△r H mθ = -553.5 + (-393.5) - (-1216.3) = 269.3 (kJ·mol-1)△r S mθ = 70.42 + 213.6 - 112.1 = 171.92 (J·mol-1·K-1) (1分)△r G mθ(500K) = △r H mθ - T·△r S mθ = 269.3⨯103 - 500 ⨯ 171.92 = 183340 (J·mol-1) (2分)lnKθ(500K) = -△r G mθ(500K)/RT = -183340÷(8.314 ⨯ 500) = -44.10Kθ(500K) = 7.0 ⨯ 10-20(1分)⑵△r G m = △r G mθ + RTlnQ p = △r G mθ + RTln{p(CO2)/pθ} (1分)= 183340 + 8.314 ⨯ 500 ⨯ ln(90/100) = 182902 (J·mol-1)>0 (1分)所以反应向左进行;或:Q p = p(CO2)/pθ = 0.9 > Kθ,所以向左进行(1分)⑶△r G mθ(500K) = △r H mθ - T·△r S mθ,由△r G mθ≦0 得到反应正向进行的最低温度:T = △r H mθ /△r S mθ = 269.3 ⨯ 103÷ 171.92 (2分)= 1566.4(K) (1分)2.解:(1)HAc == H++ Ac-Ka = C(H+)·C(Ac-) /C(HAc);(4分)C(H+) = Ka·C(HAc) / C(Ac-) = 1.8 ⨯ 10-5⨯0.110÷0.150 = 1.32⨯ 10-5;(1分)pH = 4.88 (1分)(2)C(H+) = Ka·C(HAc) / C(Ac-) = 1.8 ⨯ 10-5⨯0.090÷0.170 = 9.53⨯ 10-6;pH = 5.02 (2分)(3)C(H+) = KaC(HAc) / C(Ac-) = 1.8 ⨯ 10-5⨯0.130÷0.130 = 1.8⨯ 10-5;pH = 4.74 (2分)3.(10分)一原电池由Ag+(aq)/Ag(s)(ϕθ = 0.78V)和Sn4+(aq)/ Sn2+(aq) (ϕθ = 0.21V)两半电池组成.解:(1)Eθ =ϕθ(Ag+/Ag) - ϕθ(Sn4+/ Sn2+) = 0.78V - 0.21V = 0.57V;(2分)(2)正极反应:Ag+(aq) + e = 2Ag(s) (1分)负极反应:Sn2+(aq) = Sn4+(aq) + 2e;(1分)(-)Pt⎪ Sn2+(aq),Sn4+(aq)⎪⎪ Ag+(aq)⎪Ag(+)(1分)(3)△r G mθ = - nFEθ = -2 ⨯ 96500 ⨯ 0.57 = -110010 (J·mol-1) (2分)(4)ϕ(Ag+/Ag) = ϕθ(Ag+/Ag) + 0.0592·lgC(Ag+) = 0.78 + 0.0592 ⨯ lg0.01 = 0.6616 (V) ϕ (Sn4+/ Sn2+) = ϕθ(Sn4+/ Sn2+) + 0.0592÷2⨯lg{C(Sn4+)/C(Sn2+)}= 0.21 + 0.0296 ⨯ lg(2.0/0.2) = 0.2396(V)E = ϕ(Ag+/Ag) - ϕ(Sn4+/ Sn2+) = 0.6616V - 0.2396V = 0.422V (3分)或:E = Eθ + 0.0592÷2⨯lg{ C2(Ag+)·C(Sn2+)/ C(Sn4+)} = 0.57 + 0.0592÷2 ⨯ lg(0.012⨯ 0.2/2) = 0.422 (V) (3分)。
第 1 页 共 2 页第 2 页 共 2 页化学实验(二)试卷A适用专业: 考试日期:试卷所需时间:120分钟 闭卷 试卷总分 :100分 一、 问答题:(共6题,1、2、3、题每题20分,4题10分,5、6题每题15分,共100分)1、简述用固体NaOH 配制1L 浓度约为0.1mol ·L -1的NaOH 标准溶液的过程(要求写出配制方法及简单步骤,有关滴定反应方程式,指示剂和计算公式)2、利用所学的分析方法测定试样中Ca 2+的含量。
(要求:至少写出两种方法。
写出方法原理,有关滴定反应方程式,指示剂和计算公式)3、利用所学的分析方法测定试样中的SO 42-含量。
(要求:至少写出两种方法。
写出方法原理,有关滴定反应方程式,指示剂和计算公式)4、K 2Cr 2O 7法测定亚铁时,以二苯胺磺酸钠为指示剂,加入磷酸的作用?终点的颜色?5、写出以基准物质K 2Cr 2O 7标定Na 2S 2O 3时的反应方程式。
过早的加入淀粉对分析结果有何影响?6、用碘量法测定胆矾中的铜时,为什么要在溶解样品时加入H 2SO 4酸化?加入KI 为什么必须过量?院系: 专业班级: 姓名: 学号: 装 订 线第 3 页 共 4 页化学实验(二)试卷A 卷答案一.问答题:1. 称取NaOH 约4g 溶解于烧杯中。
采用草酸来标定其浓度,采用酚酞为指示剂。
2NaOH + H 2C 2O 4 =NaC 2O 4 + 2H 2O)NaOH ()O H O C H ()O H O C H ()NaOH (24222422V M m c ⋅⋅=2.(1)络合滴定法测定钙的含量时,用NaOH 调节溶液的pH 至12,加入钙指示剂,用EDTA 标准溶液滴定至由红色变为纯蓝色,即达终点。
用去EDTA 标准溶液的体积V .Ca 2++H2Y 2-CaY 2-+2H +CaIn -+H2Y2-CaY 2-+HIn 2-+H +(红色) (纯蓝色)C(Ca 2+)=(CV)EDTA /V (s)(2)氧化还原滴定法Ca 2+不能KMnO 4与直接反应,可采用间接滴定法进行测定,溶液中慢慢加入5%(NH 4)2C 2O 4,生成CaC 2O 4沉淀,沉淀经过滤洗涤,再加H 2SO 4溶液使沉淀溶解。