大学普通化学习题集物质结构类
- 格式:ppt
- 大小:260.50 KB
- 文档页数:57

一、判断题(对的在括号内填“√”,错的填“×”)(1)已知下列过程的热化学方程式为UF 6(l) = UF 6(g);11.30-⋅=∆mol kJ H mr θ,则此温度时蒸发1mol UF 6(l),会放出热30.1 kJ 。
( )(2)在定温定压条件下,下列两个生成液态水的化学方程式所表达的反应放出的热量是一相同的值。
( ))1()(21(g)H 222O H g O =+ )1(2)()(H 2222O H g O g =+ (3)功和热是在系统和环境之间的两种能量传递方式,在系统内部不讨论功和热。
( )4)对反应系统 )()()()(C 22g H g CO g O H s +=+,11,3.131)15.298(-⋅=∆mol kJ K H m r θ。
由于化学方程式两边物质的化学计量数的总和相等,所以增加总压力对平衡无影响。
( )(5)反应的级数取决于反应方程式中反应物的化学计量数。
( )(6)催化剂能改变反应历程,降低反应的活化能,但不能改变反应的θm r G ∆。
( ) (7)两种分子酸HX 溶液和HY 溶液有同样的pH ,则这两种酸的浓度)3-⋅dm mol (相同。
( )(8)2PbI 和3CaCO 吨的溶度积均近似为-910,从而可知在它们的饱和溶液中。
的者的+2Pb 浓度与后者的+2Ca 浓度近似相等。
( )(9)3MgCO 的溶度积61082.6-⨯=s K 这意味着所有含有团体3MgCO 的溶液中,)()(232-+=CO c Mg c ,而且62321082.6)()(--+⨯=⋅CO c Mg c 。
( )(10)当主量子数n =2时,角量子数l 只能取1。
( )(11)多电子原子轨道的能级只与主量子数n 有关。
( )(12)就主族元素单质的熔点来说,大致有这样的趋势:中部熔点较高,而左右两边的熔点较低。
( )(13)活泼金属元素的氧化物都是离子晶体,熔点较高;非金属元素的氧化物都是分子晶体,熔点较低。

专题15物质结构与性质综合题考点命题趋势考点1物质结构与性质综合题在当前的旧高考中,"物质结构与性质"属于选择性考试内容,以综合性客观题形式出现,随着新课程的落实,"物质结构与性质"已成为选择性必修课程,将成为新高考的必考内容,在新高考中,部分卷区不再设置"物质结构与性质"综合题,而是将其考查分散到选择题和其他综合题当中。
纵观近年来高考真题,物质结构与性质综合题基本上考的都是最基本、最典型、最主干的知识点。
以下是高考时时常考的知识点:原子结构与元素的性质方面,如原子电子排布式,元素原子的性质;化学键与物质的性质方面,如杂化轨道类型,分子(离子)空间构型;分子间作用力与物质的性质方面;如晶胞判断与计算。
试题均建构在以教材为主的中学化学基础知识之上,没有偏离教材体系和考试说明的要求,试题基本保持稳定。
试卷并不能把所有的知识面全部覆盖,也不能保证重要知识点可能反复出现。
1.(2024·北京卷)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是_________。
②4SnCl 的Sn Cl —键是由锡的_________轨道与氯的3p 轨道重叠形成。
键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有_________个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是_________。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ︒,由于固体之间反应慢,未明显发生反应。
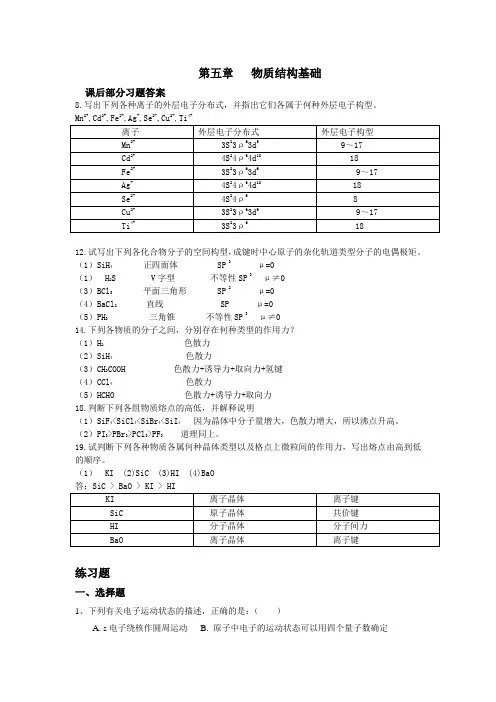
第五章物质结构基础课后部分习题答案8.写出下列各种离子的外层电子分布式,并指出它们各属于何种外层电子构型。
2+2+2++2-2+4+12.试写出下列各化合物分子的空间构型,成键时中心原子的杂化轨道类型分子的电偶极矩。
(1)SiH4正四面体 SP 3μ=0(1)H2S V字型不等性SP 3 μ≠0(3)BCl3平面三角形 SP 2μ=0(4)BaCl2 直线 SP μ=0(5)PH3 三角锥不等性SP 3 μ≠014.下列各物质的分子之间,分别存在何种类型的作用力?(1)H2 色散力(2)SiH4 色散力(3)CH3COOH 色散力+诱导力+取向力+氢键(4)CCl4 色散力(5)HCHO 色散力+诱导力+取向力18.判断下列各组物质熔点的高低,并解释说明(1)SiF4<SiCl4<SiBr4<SiI4因为晶体中分子量增大,色散力增大,所以沸点升高。
(2)PI3>PBr3>PCl3>PF3道理同上。
19.试判断下列各种物质各属何种晶体类型以及格点上微粒间的作用力,写出熔点由高到低的顺序。
(1)KI (2)SiC (3)HI (4)BaO练习题一、选择题1、下列有关电子运动状态的描述,正确的是:()A. s电子绕核作圆周运动B. 原子中电子的运动状态可以用四个量子数确定C. p 电子绕核走“8”字D. 电子在固定的轨道上不停地自旋 2、核外电子运动的特征是:( )A. 绕核高速旋转B. 具有无穷大的动能C. 有确定的运转轨道D. 具有波粒二象性 3、近代原子结构理论中的原子轨道是指:( )A. 电子绕核运动的轨迹B. 波函的平方2||ψ C. 电子云 D. 波函数ψ4、主量子数为3的电子层中:( )A. 只有s 和p 轨道B. 只有s 、p 和d 轨道C. 只有s 轨道D. 有s 、p 、d 和f 轨道 5、下列各组量子数取值合理的是:( )A. n=2 l =1 m=0 m s =0B. n=7 l =1 m=0 m s =+21C. n=3 l =3 m=2 m s =-21 D. n=3 l =2 m=3 m s =-21 6、钠原子1s 轨道能级E 1s,Na 与氢原子1s 轨道能级E 1s,H 的相对高低为:( )A. E 1s,Na =E 1s,HB. E 1s,Na <E 1s,HC. E 1s,Na >E 1s,HD. 无法比较 7、下列用量子数描述的、可以容纳电子数最多的电子亚层是:( )A. n=2,l =1B. n=3,l =2C. n=4,l =3D. n=5,l =0 8、决定多电子原子系统原子轨道能级大小的量子数是:( )A. n 和mB. l 和mC. n 和m sD. n 和l 9、屏蔽效应所起作用是:( )A. 对核电荷的增强作用B. 对核电荷的抵消作用C. 正负离子间的吸引作用D. 电子层的排斥作用二、填空题1、波函数ψ是描述 数学函数式,它和 是同义词,|ψ|2的物理意义是 ,电子云是 的形象化表示。


第二章 饱和烃1、将下列化合物用系统命名法命名。
(1)CH 3CH CHCH CH 2CH 2CH 33CH CH 3CH 2331234567 2,3,5-三甲基-4-丙基庚烷(2)1234567CH 3CH CHCH CH 2CH 2CH 3CH 3CH CH 3CH 3CH 3 2,3-二甲基-4-异丙基庚烷(3)123456CH 3CH CHCH 2CHCH 33332,3,5-三甲基己烷2、下列化合物的系统命名是否正确?如有错误予以改正。
(1)CH 3CHCH 2CH 3C 2H 52-乙基丁烷 ╳ 3-甲基戊烷(2) CH 3CH 2CHCHCH 3CH 3CH 32,3-二甲基戊烷 √(3)CH 3CH 2CH 2CHCH 2CH 2CH 3CHCH 3CH 34-异丙基庚烷 √(4)CH 3CHCH 2CH CHCH 2CH 3332CH 3 4,6-二甲基-乙基庚烷 ╳ 2,4-二甲基-5-乙基庚烷(5)CH 3CH 2CH 2CHCH 2CH 3CHCH 333-异丙基庚烷 ╳ 2-甲基-3-乙基己烷(6)CH 3CH 2CH 2CHCH 2CHCH 2CH 2CH 3C 2H 5CH 2CH 2CH 36-乙基-4-丙基壬烷 ╳ 4-乙基-6-丙基壬烷3、 命名下列化合物(1) CH 32CHCH 2CH 3CH 2CH 32CH 2CH 3123456783-甲基-5-乙基辛烷(2) 12345678CCH 2CH 2CH 2CCH 3CH 33CH 33CH 3CH 3 2,3,3,7,7-五甲基辛烷(3)CH 3CH CHCH 2CHCH 2CH 3CH 3CH 3CH 2CHCH 3CH 3123456782,3,7-三甲基-5-乙基辛烷(4) CH 3CHCH 2CHCCH 2CH 2CH 2CHCHCH 3CH 3CH 3CH 3CH 3CH 3CH 391012345678112,4,5,5,9,10-六甲基十一烷4、 命名下列各化合物(1)CH 3C 2H 5CH(CH 3)2123456 (2)CH 3CH 3CH 3CH 31-甲基-2-乙基-3-异丙基环己烷 1,1,2,3-四甲基环丁烷(3)(4)正戊基环戊烷2-甲基-3-环丙基庚烷(5) (6)C 2H 5CH 2(CH 2)4CH 31-甲基-3-环丁基环戊烷 1-乙基-4-正己基环辛烷(7)CH 31234567(8)CH 312345678(9)CH 31234567896-甲基双环[3.2.0]庚烷 8-甲基双环[3.2.1]辛烷 8-甲基双环[4.3.0 ]壬烷(10)CH 3123456789(11)123456789CH 3CH 3CH 3(12)123456789C 2H 5CH 36-甲基螺[3.5]壬烷 1,3,7-三甲基螺[4.4]壬烷 1-甲基-7-乙基螺[4.5]癸烷5、 已知正丁烷沿C 2与C 3的键旋转可以写出四种典型的构象式,如果C 2和C 3之间不旋转,只沿C 1和C 2之间的σ键旋转时,可以写出几种典型构象式?试以Newman 投影式表示。

第1章热化学与能源一、判断题:1、热的物体比冷的物体含有更多的热量。
(×)2、热是一种传递中的能量。
(√)3、同一体系同一状态可能有多个热力学能。
(×)4、体系的焓值等于恒压反应热。
(×)5、最稳定单质的焓值等于零。
(×)6、由于C a C O3分解是吸热的,所以它的标准摩尔生成焓为负值。
(×)7、体系的焓等于体系的热量(×)8、实验测定得到的反应热数据都是恒压反应热。
(×)二、计算题:1、某汽缸中有气体1.20L,在97.3 kPa下气体从环境中吸收了800J的热量后,在恒压下体积膨胀到1.50L,试计算系统的内能变化ΔU。
ΔU = q + w = q – pΔV= 800 – 97.3×103 ×(1.50 - 1.20) 10-3= 770 J2、根据Δf H mΘ的值,计算下列反应的Δr H mΘ(298K ) 是多少:(1)4NH3(g)+ 3 O2(g)= 2N2(g)+ 6 H2O(g);4NH3(g)+ 3 O2 = 2N2 + 6 H2O(g)Δf H mΘ/ kJ·mol-1- 46.11 0 0 - 241.818Δr H mΘ= 6×(- 241.818)- 4×(- 46.11) = -1266 kJ·mol-1(2)CH4(g) + H2O(g)= CO(g)+ 3 H2(g)。
Δr H mΘ= 206 kJ·mol-1第2章化学反应的基本原理一、判断题:1、放热反应均是自发反应。
(×)2、ΔS为负值的反应均不能自发进行。
(×)3、冰在室温下自动融化成水,是熵增加起了主要作用。
(√)4、因为∆G TΘ= -RTlnKΘ,所以温度升高,平衡常数减小。
(×)5、质量作用定律适用于任何化学反应。
(×)6、反应速率常数取决于反应温度,与反应物浓度无关。


1993/1999/2000/2005同济大学普通化学试题同济大学1993年硕士生入学考试试题(普通化学A)一、名词解释(20分)1.简单反应、复杂反应2.同离子效应、盐效应3.外轨型配位化合物、内轨型配位化合物4.加聚反应、缩聚反应5.举例说明:三电子π键、离域π键二、选择题:(20分)1.铁原子的外层电子构型是4s?d6 在轨道中未成对电子数是()A 0B 2C 4D 62.反应2SO3(g)=2SO2(g)+O2(g)的K=32,如果[SO3]=[O2]=2.0mol/L 那么[SO2]等于()A 0.032mol/LB 8.0mol/LC 0.25mol/LD 2.7mol/L3.下列氯化物中,可以在室温下发生水解反应生成HCl气体的是()A CCl4B Al2Cl6C Fe2Cl6D PCl54.用酸化的重铬酸盐(Cr2O7 ̄)滴定亚铁离子溶液,应该用哪种指示剂最合适()A 二苯胺溶于磷酸中B 铬酸钾C 酚酞D 甲基橙5.欲除去CuSO4酸性溶液中的杂质Fe3+ 加入的最合适试剂是()A KSCNB 氨水C NaOHD H2S6.对一特定反应化学反应速度越快是由于该反应的()A 活化能越小B 活化能越大C ΔG越负D ΔH越负7.下列酸中酸性最强的是()A HClO4B HFC HCND HCl8.一个反应的活化能可通过下列中一法获得的斜率来确定()A LnK对TB LnK对1/TC LnK/T对1/TD T/LnK对1/T9.配位化合物K4[Fe(CN)6]的名称是()A 六氰合铁酸钾B 氰合铁(Ⅱ)酸钾C 六氰合铁(Ⅲ)酸钾D六氰合铁(Ⅱ)酸钾10.在下列晶体中,熔化是需要破坏共价键的是()A SiF4B AgC CsFD SiC三、填空(20分)1.C2H2分子中有——个σ键,另外有——键。
2.硫酸亚铁溶液中加入烧碱并通入氯气产生的沉淀物是————。
3.[Co(CN)6]?(原子序数Co27 ),已知其磁矩为零,其杂化轨道属于——类型,空间构型为————。

计算题1、反应2C(s,石墨)+2H2(g)+H2O(l)=C2H5OH(l)并不能实际发生。
由下列反应计算乙醇的ΔfH θm(298)。
(1) C2H5OH(l) + 3O2 (g)= 2CO2(g) + 3H2O(l) ΔrH θm(1)=-1366.7 kJ·mol-1(2) C(s ,石墨) + O2(g) = CO2(g) ΔrH θm(2)=-393.5 kJ·mol-1(3) H2(g) + 1/2O2(g) = H2O(l) ΔrH θm(3)=-285.8 kJ·mol-1解:2×(2)+3×(3)-(1)得:H2(g)+ 2C(s,石墨)+1/2 O2(g)= C2H5OH(l)ΔfH θm(C2H5OH ,l)= 2×ΔrH θm(2)+3×ΔrH θm (3)-ΔrH θm (1) =-277.7 (kJ·mol-1)2. 溶液中 c(Fe3+)=0.10mol·L-1,刚开始生成沉淀Fe(OH)3时的pH 是多少?Fe3+定性沉淀完全时pH 是多少?已知K θsp{Fe(OH)3}=2.64×10-39解: Fe(OH)3 = Fe3+ + 3OH-K θsp(Fe(OH)3)={c(Fe3+)/c θ}.{c(OH-)/c θ}3刚开始沉淀时所需c(OH-)为pH=14-(-lg2.98×10-13)=1.47定性沉淀完全时,c(Fe3+)=10-5 mol·L-1pH=14-(-lg6.42×10-12)=2.813. 写出下列原电池符号,并计算电动势(298.15K ),判断反应在298.15K 时的自发方向。
Zn(s) + Ni2+(0.080 mol·L-1) = Zn2+(0.020 mol·L-1) + Ni(s)已知:ϕθ(Ni2+/Ni) = -0.250V , ϕθ(Zn2+ / Zn) = -0.762V解: 原电池符号: Zn|Zn2+(0.020 mol·L-1)‖Ni2+ (0.080 mol·L-1)|Ni正极: 负极:ε>0,所以反应在298.15K 时正向自发进行。

第二章 化学反应的基本原理和大气污染1、是非题(对的在括号内填“+”号,错的填“-”号)(1)r S ∆ 为正值的反应均是自发反应。
(-) (2)某一给定反应达到平衡后,若平衡条件不变,分离除去某生成物,待达到新的平衡,则各反应物和生成物的分压或浓度分别保持原有定值。
(-)(3)对反应系统122()()()(),(298.15)131.3r m C s H O g CO g H g H K kJ mol θ-+=+∆= 。
由于化学方程式两边物质的化学计量数(绝对值)的总和相等,所以增加总压力对平衡无影响。
(-) (4)上述(3)中反应达到平衡后,若升高温度,则正反应速率v (正)增加,逆反应速率v (逆)减小,结果平衡向右移动。
(-)(5)反应的级数取决于反应方程式中反应物的化学计量数(绝对值)。
(-) (6)催化剂能改变反应历程,降低反应的活化能,但不能改变反应的rmG θ∆。
(+)(7)在常温常压下,空气中的N 2 和O 2 能长期存在而不化合生成NO 。
且热力学计算表明22()()2()N g O g NO g +=的(298.15)0r m G K θ∆ ,则N 2 和O 2混合气必定也是动力学稳定系统。
(+)(8)已知4CCl 不会与2H O 反应,但422()2()()4()CCl l H O l CO g HCl aq +=+的1(298.15)379.93r m G K kJ mol θ-∆=- ,则必定是热力学不稳定而动力学稳定的系统。
(+)2、选择题(将所有正确答案的标号填入空格内)(1)真实气体行为接近理想气体性质的外部条件是 (b )(a )低温高压 (b )高温低压 (c )低温低压 (d )高温高压 (2)某温度时,反应22()()2()H g Br g HBr g +=的标准平衡常数2410K θ-=⨯,则反应2211()()()22HBr g H g Br g =+的标准平衡常数K θ等于 (b )(a )21410-⨯ (b (c )2410-⨯ (3)升高温度可以增加反应速率,最主要是因为 (b )(a )增加了分子总数(b )增加了活化分子的百分数 (c )降低了反应的活化能 (d )促使平衡向吸热方向移动(4)已知汽车尾气无害化反应221()()()()2NO g CO g N g CO g +=+的(298.15)0r m H K θ∆≤,要有利于取得有毒气体NO 和CO 的最大转化率,可采取的措施是 ( c) (a )低温低压 (b )高温高压 (c )低温高压 (d )高温低压(5)温度升高而一定增大的量是 (bc )(a ) r m G θ∆ (b )吸热反应的平衡常数K θ(c )液体的饱和蒸气压 (d )反应的速率常数k(6)一个化学反应达到平衡时,下列说法中正确的是 ( a) (a )各物质的浓度或分压不随时间而变化(b )r m G θ∆=0(c )正、逆反应的速率常数相等(d )如果寻找到该反应的高效催化剂,可提高其平衡转化率3、填空题(1)对于反应: 1223()3()2();(298)92.2r m N g H g NH g H K kJ mol θ-+=∆=-若升高温度(约升高100 K),则下列各项将如何变化(填写:不变,基本不变,增大或减小。

普通化学原理(物质结构与基本化学原理)_西安交通大学中国大学mooc课后章节答案期末考试题库2023年1.凡是能形成氢键的物质,其熔、沸点比同类物质的都高。
答案:错误2.色散力只存在于非极性分子之间,而取向力只存在于极性分子之间。
答案:错误3.H2O 的熔点比HF高,所以O—H…O氢键的键能比F—H…F氢键的键能大。
答案:错误4.在化学热力学中所谓标准条件是指:在 298.15 K 下,系统中各气体物质的分压均为标准压力,或者溶液中溶质浓度均为标准浓度。
答案:错误5.物质的温度越高,熵值越大。
答案:错误6.在298K时,指定单质的【图片】=0,【图片】=0,【图片】=0。
答案:错误7.化学反应的焓变,是反应的热效应。
答案:错误8.对于一个定温反应,如果【图片】>【图片】,则该反应必定是熵增的反应。
答案:正确9.|ф|2代表电子在核外空间的概率密度。
答案:正确10.价键理论中,共价分子中形成的π键,不决定分子的几何构型。
答案:正确11.含有d电子的原子都是副族元素。
答案:错误12.原子中核外电子的运动具有波粒二象性,没有经典式的轨道,并需用统计规律来描述。
答案:正确13.所谓的“镧系收缩”是指镧系元素随着原子序数的增加,原子半径迅速增大的现象答案:错误14.在同一个多电子原子内,若两个电子n、l、m都相同,则其自旋状态一定相反答案:正确15.29号元素Cu的基态原子的核外电子排布式是1s22s22p63s23p63d94s2答案:错误16.N元素的第一电离能比其后的O元素的要高,这可以用“半充满”电子构型更稳定来解释答案:正确17.对24号元素Cr来说,价电子构型3d54s1为其激发态答案:错误18.n=2 时,描述电子运动状态的四个量子数最多有四组。
答案:错误19.下列各组粒子中,具有相同核外电子排布的是()。
答案:K+,S2-20.下列晶格能(离子键能)大小顺序中正确的是:答案:NaCl > KCl > RbCl21.如果某一级反应的半衰期为50年,下列描述正确的为:答案:反应进行50年后,反应物的浓度减半22.Qp、Qv之间的换算只适合气相反应,不适合有凝聚相参与的反应。
普通化学练习题普通化学练习题⼀、判断题1、⼀个溶液所有组分的摩尔分数总和为1()2、状态函数都具容量性质()3、化学反应中发⽣碰撞的分⼦,不⼀定是活化分⼦() 6、平衡状态是正逆反应都停⽌的状态()7、某胶体溶液在电渗时液体向负极移动,说明胶粒带正电() 8、⾃发进⾏的反应,其焓值总是下降的() 9、化学反应的级数越⾼,反应速率就越⼤() 10、胶粒只包含胶核和电势离⼦,不包括反离⼦()⼆、单选题1、下列配离⼦在强酸介质中肯定能稳定存在的是() A 、-2342)(O C Fe B 、+263)(NH Mn C 、-36AlF D 、-2AgCl2、⼟壤胶粒带负电,下列对它凝结能⼒最强的是()A 、42SO NaB 、3AlClC 、4MgSOD 、-])([63CN Fe K3下列过程系统熵值基本不变的是() A 、⽯灰⽯的分解B 、碳与氧⽣成⼆氧化碳 C 、固体硝酸钾溶解D 、液体⼄醇蒸发为⽓体4、由⽯墨到⾦刚⽯的转变过程,标准焓变为1.9千焦/摩,标准⽣成吉布斯⾃由能为2.9千焦/摩,⼆者相⽐⽆序度更⾼的是()A 、⽯墨B 、⾦刚⽯C 、⼆者都⼀样D 、⽆法判断5、反应C (s )+CO 2(g) = 2CO(g)的K p 的表达式写作()A 、)()(/)(22CO p C p CO pB 、)(/)(2CO p CO pC 、)()(/)(2CO p C p CO pD 、)(/)(22CO p CO p 6、升⾼温度反应速率增⼤的原因是( C ) A 、分⼦的活化能提⾼了B 、反应的活化能降低了 C 、活化分⼦数增多了D 、该反应是吸热反应 7、溶胶粒⼦进⾏电泳时( D )A 、胶粒向正极运动,电势离⼦和吸附离⼦向负极移动B 、胶粒向正极运动,扩散层向负极运动C 、胶团向⼀个极移动D 、胶粒向⼀极移动,扩散层向另⼀极移动8、下列给定热⼒学条件下,⾼温⾃发的过程是(B ) A 、0,0?>?S H C 、0,0?S H D 、0,0>?9、热⼒学第⼀定律数学表达式适⽤于(B )体系 A 、敞开B 、封闭C 、孤⽴ D 、任何10、下列哪种情况使平衡到达所需时间最短( D ) A 、ΘK 很⼩B 、ΘK 很⼤C 、ΘK 接近1 D 、⽆法判断11、某反应的温度系数为3,当反应体系温度升⾼100℃时,反应时是0℃时的(C )A 、30倍B 、100倍C 、310倍D 、90倍 12、基本单元的下列叙述错误的是(D ) A 、它可以是分⼦、原⼦、离⼦、电⼦及其它粒⼦B 、它可以是上述粒⼦⼿组合与分割C 、它可以是⼀个反应式,如:O H O H 22222=+D 、它必须是客观存在的粒⼦13、施肥过多引起烧苗是由于⼟壤溶液的(A )⽐植物细胞溶液⾼ A 、渗透压B 、蒸⽓压C 、冰点D 、沸点14、下列物质的浓度均为0.11-?L mol ,对负溶胶聚沉能⼒最⼤的是(A )A 、32)4(SO AlB 、43PO NaC 、2CaClD 、NaCl15、体系不做⾮体积功的等压过程,吸收的热与体系焓变的关系(A ) A 、H Qp ?=B 、H Qp ?>C 、H Qp ?< 16、某反应0,0>?>?S H ,则该反应(A )A 、⾼温⾃发,低温不⾃发B 、⾼温不⾃发,低温⾃发C 、任何温度均⾃发D 、任何温度均不⾃发17、D C B A +=+为基元反应,如果⼀种反应物的浓度减半,则反应速度将减半,根据是(A )A 、质量作⽤定律B 、勒夏特列原理C 、阿仑尼乌斯定律D 、微观可逆性原理三、填空题1、写出标准氢电极与铜电极组成的电池符号Pt )(-│)100(2kPa H │)1(1-+?L mol H ‖)1(12-+?L mol Cu │))((+s Cu2、⽤AgNO 3与KI 溶液制备AgI 溶胶,写出AgNO 3过量时胶团的结构式(--+-?3})(){(3xNO NO x n nAg AgI m )3、阿仑尼乌斯⽅程式的对数定律表达式为(),它反映了反应速率与()和()的定量关系。
大学普通化学习题1-5参考答案习题参考答案习题一一、判断题(对的,在括号内填“√”,错的填“×”)1. ===和===的相同。
( × )2. 功和热是在系统和环境之间的两种能量传递方式,在系统内部不讨论功和热。
(√ )3. 反应的就是反应的热效应。
(× )4. Fe(s)和的都为零。
( × )5. 盖斯定律认为化学反应的热效应与途径无关,是因为反应处在可逆条件下进行的缘故。
( × )6. 同一系统不同状态可能有相同的热力学能。
(× )7. 由于=,是状态函数,的数值只与系统的始、终态有关,而与变化的过程无关,故也是状态函数。
(×)8. 由于固体的分解反应是吸热的,故它的标准摩尔生成焓是负值。
( × )9. 当热量由系统传递给环境时,系统的内能必然减少。
(× )10. 因为,不是系统所具有的性质,而与过程有关,所以热力学过程中()的值也应由具体的过程决定。
(× )二、选择题(将正确的答案的标号填入空格内)1. 对于封闭体系,体系与环境间 ( B )A. 既有物质交换,又有能量交换B. 没有物质交换,只有能量交换C. 既没物质交换,又没能量交换D. 没有能量交换,只有物质交换2. 热力学第一定律的数学表达式只适用于 ( C )A. 理想气体B. 孤立体系C. 封闭体系D. 敞开体系3. 环境对系统作10kJ的功,且系统又从环境获得5kJ的热量,问系统内能变化是多少? ( D )A. kJB. kJC. +5kJD. +15kJ4. 已知2PbS(s) + 3=== 2PbO(s) + 2的=,则该反应的值是多少? ( D )A. 840.9B. 845.9C.D.5. 通常,反应热的精确实验数据是通过测定反应或过程的哪个物理量而获得的。
( D )A. B. C. D.6. 下列对于功和热的描述中,正确的是哪个? ( A )A. 都是途径函数,无确定的变化途径就无确定的数值B. 都是途径函数,对应于某一状态有一确定值C. 都是状态函数,变化量与途径无关D. 都是状态函数,始终态确定,其值也确定7. 在温度的标准状态下,若已知反应A→2B的标准摩尔反应焓,与反应2A→C的标准摩尔反应焓,则反应C→4B的标准摩尔反应焓与及的关系为=?( D )A. B.C. D.8. 对于热力学可逆过程,下列叙述不正确的是哪个? ( C)A. 变化速率无限小的过程B. 可做最大功的过程C. 循环过程D. 能使系统与环境都完全复原的过程9. 下述说法中,不正确的是哪个? ( D )A. 焓只有在某种特定条件下,才与系统吸热相等B. 焓是人为定义的一种具有能量量纲的热力学量C. 焓是状态函数D. 焓是系统能与环境进行热交换的能量10. 封闭系统经过一循环过程后,其下列哪组参数是正确的? ( C )A. =0,=0,=0,=0B. ≠0,≠0,=0,=C. =,=,=0D. ≠,=,=011. 以下说法正确的是哪个? ( B )A. 状态函数都具有加和性B. 系统的状态发生改变时,至少有一个状态函数发生了改变C. 因为=,=,所以恒容或恒压条件下,都是状态函数D. 虽然某系统分别经过可逆过程和不可逆过程都可达到相同的状态,但不可逆过程的熵变值不等于可逆过程的熵变值。
化学物质的结构与性质专项训练测试试题及答案一、物质的结构与性质的综合性考察1.硼(B)、铝及其化合物在化学中有重要的地位。
请回答下列问题:Ⅰ.(1)与B的基态原子电子排布式中成单电子数相同的第二周期元素还有______(填写元素符号)。
Ⅱ.硼酸(H3BO3)是白色片状晶体(层状结构如图1),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
(2)硼酸分子以范德华力、共价键和氢键形成环状结构,每个含有B原子的环中平均含有B原子的个数为______个。
其中B原子的杂化类型为______。
(3)加热时,硼酸的溶解度增大,主要原因是______。
(4)硼酸是一元弱酸,其分子式亦可写为B(OH)3,在水中电离时,硼酸结合水电离出来OH-的而呈酸性,写出硼酸的电离方程式______。
(5)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子的结构式或结构简式为______(标出配位键)。
Ⅲ.硼氢化钠是一种常用的还原剂。
其晶胞结构如图2所示:(6)该晶体中Na+的配位数为______。
(7)若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为______。
(8)LiAlH4也是一种特殊的还原剂,可将羧酸直接还原成醇:CH3COOH CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
Ⅳ.(9)硼化镁晶体在39K时呈超导性。
在硼化镁晶体中,镁原子和硼原子是分层排布的,如图3是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。
则硼化镁的化学式为______。
2.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___________摄取铁元素的原子光谱。
(2)FeCl3的熔点为306℃,沸点为315℃。
由此可知FeCl3属于______晶体。
FeSO4常作净水剂和补铁剂,SO42-的立体构型是____________。
《无机及分析化学》《普通化学》习题选解第1章 水溶液1-1. 排出下列稀溶液在310 K 时,渗透压由大到小的顺序(1) c (C 6H 12O 6) = 0.10 mol ·L -1 (2) c (NaCl) = 0.10 mol ·L -1(3) c (Na 2CO 3) = 0.10 mol ·L -1解:Cos(C 6H 12O 6)=c=0.10mol ·L -1 Cos(NaCl)=2c=0.20mol ·L -1Cos(Na 2CO 3)=3c=0.30mol ·L -1∴Cos(1)<Cos(2)<Cos(3) 又:π=CosRT 所以π(1)<π(2)<π(3)1-2. 某一元弱酸HA100mL ,其浓度为0.10mol ·L -1, 当加入0.10mol ·L -1的NaOH 溶液50mL 后,溶液的pH 为多少?此时该弱酸的解离度为多少?(已知HA 的K a =1.0×10-5)解: HA + NaOH = NaA + H 2O 代入数据 0.10×100 0.10×50 =10mmol =5mmol可知HA 过量5mmol ,产生NaA 5mmol,构成一个缓冲溶液。
由公式pH p lga n K n =+共轭碱共轭酸=5+lg(5/5)=5解离度+5(HA)[H ]110100%100%0.03%5150c α-⨯=⨯=⨯= 1-3. 欲配制pH=5.00的缓冲溶液500mL ,现有6 mol ·L -1的HAc34.0mL , 问需要加入NaAc ·3H-2O(M=136.1g ·mol -1)多少克?如何配制?解:根据公式-n(A )pH p lg (HA)a K n =+ 代入计算,NaAc 35.00 4.75lg 634.010n -=+⨯⨯ 得到:n NaAc =0.363mol, m(NaAc ·3H 2O)=0.363×136.1=49.4克配制方法:称取49.4克NaAc ·3H 2O ,溶解于100mL 烧杯中,转移到500mL 容量瓶中,稀释,定容,酸度计校正。