氧化槽液试验规定
- 格式:doc
- 大小:36.00 KB
- 文档页数:3

铝合金硬质阳极氧化
槽液分析
实
验
规
范
铝合金硬质阳极氧化槽液分析实验规范
1、测定项目:游离硫酸质量浓度,总硫酸质量浓度,铝离子质量浓度。
2、需用试剂:氟化钾,酚酞溶液(10g/L),氢氧化钠标准溶液(1mol/L)
3、分析步骤:
1)总酸质量浓度
取5.0ml槽液于250ml锥形瓶中,加50ml蒸馏水,摇均匀。
滴加4滴10g/L 酚酞溶液,用经过标定的约C(NaOH)=1mol/L的氢氧化钠标准溶液滴定至试液由无色变为粉红色即为终点。
读取消耗的氢氧化钠标准溶液的体积(V1),按下列公式计算其质量浓度:
ρ(H2SO4)=9.8×V1×C(NaOH)(g/L)
式中,C(NaOH)为NaOH标准溶液的物质的量浓度.
2)游离酸质量浓度
取5.0ml槽液于250ml锥形瓶中,加50ml蒸馏水,摇均匀。
滴加4滴10g/L 酚酞溶液,加入2g氟化钾标准溶液滴定至试液由无色变为粉红色即为终点,读取消耗的氢氧化钠标准溶液的体积(V2),按下列公式计算其质量浓度:
游离ρ(H2SO4)=9.8×V2×C(NaOH)(g/L)
3)铝离子质量浓度
根据游离硫酸消耗氢氧化纳标准溶液的体积V1和总硫酸消耗氢氧化钠标准溶液的体积V2,可计算硫酸氧化槽液中铝离子质量浓度。
ρ(AL3+)=1.8×(V1- V2)×C(NaOH)(g/L)
酚酞试剂:1g酚酞溶解于80ml酒精中,溶解后以水稀释至100ml。
然后装入特定容器中。
溴酚蓝指示剂:0.1g溴酚蓝溶解于3ml0.05mol/l的NaOH溶液中,以水稀释至100ml。

程序文件文件修订页1 目的:对各功能槽液进行分析、并控制药品添加。
2适用范围适应******有限公司阳极氧化生产线。
3名词解释3.1 NaOH 氢氧化钠 3.7 KF 氟化钾3.2 Na3PO4磷酸钠 3.8 KI 碘化钾3.3 Na2CO3碳酸钠 3.9 HCl 盐酸3.4 HNO3 硝酸 3.10 H2O2双氧水3.5 H2SO4硫酸3.6 Al3+ 铝离子4权责无5流程图无6作业內容6.1碱性除油槽液管理6.1.16.1.2应用试剂a、甲基橙指示剂:称取0.1克分析纯甲基橙,溶解在100ml热水中,如有不溶物应过滤。
b、酚酞指示剂:称取1克分析纯酚酞,溶解在100ml乙醇中。
c、1N硫酸标准溶液:见标准溶液的配制。
d、 1N氢氧化钠标准溶液:见标准溶液的配制。
6.1.3分析仪器5ml移液管,25cm玻璃棒,250ml锥形瓶,50ml滴定管6.1.4分析方法取镀液5ml于250ml锥形瓶中,加水150ml,加甲基橙指示剂2滴,用1N硫酸标准溶液滴定至红色为终点,记录硫酸耗用量V1ml,将溶液煮沸以除去二氧化碳,冷却后加酚酞指示剂数滴,用1N氢氧化钠标准溶液滴定至红色为终点,记录氢氧化钠耗用量V2ml。
另取镀液5ml于250ml锥形瓶中,加水150ml,加酚酞指示剂2-3滴,在不断搅拌下用1N硫酸标准溶液缓慢滴定至红色消失为终点,注意滴定速度不能太快,以免局部溶液酸度过高,使碳酸钠直接生成二氧化碳而损失,记录硫酸的消耗量为V3ml。
6.1.5计算方法NaOH(g/L)=(2C1V3- C1V1) ×40/5Na2CO3(g/L)=( C1V1- C2V2- C1V3) ×106Na3PO4= C2V2×380/5式中:C1------1N硫酸标准溶液的浓度(mol/l);C2------1N氢氧化钠溶液的浓度(mol/l);V1------以甲基橙为指示剂耗用硫酸标准溶液的体积数(ml);V2------耗用1N氢氧化钠标准溶液的体积数(ml);V3------以酚酞为指示剂耗用硫酸标准溶液的体积数(ml);6.2 酸性除油脱脂槽液管理6.2.16.2.2应用试剂a.酚酞指示剂:称取1克分析纯酚酞,溶解在100ml乙醇中。


氧化槽夜化验方法一、除油槽化验方法标准:除油槽的工作点:150-----200分析方法:取工作槽液20ml,放入250ml 锥形瓶中,加水约50ml,再加入酚酞指示剂2---3滴,用1N(1mol/l)氢氧化钠标准溶液滴定至粉红色为终点,记下消耗氢氧化钠体积数(ml).计算槽液工作点:w=10×N(NAON)×V(NAON)N(NAON):氢氧化钠的浓度V(NAON) :消耗氢氧化钠的体积数控制:当槽液的工作点低于150时,就要按配比添加除油剂和硫酸。
一、碱蚀槽化验方法碱槽控制标准:NAOH:45-6g/l,AL3+:≦120g/l.测试项目:游离碱、铝离子试剂:葡萄糖酸钠、氟化钾、酚酞1%、1N盐酸标准溶液分析方法:准确移取槽液25ml于250ml的锥形瓶中,加水50ml,加葡萄糖酸钠3g,酚酞1%4滴,用1N盐酸标准溶液滴至红色消失(V1),再加入3g氟化钾溶解完全,用1N盐酸标准溶液滴至红色消失(V2)。
计算:游离碱:NAOH(g/l)=20×(V1-V3/3)×N铝离子:AL3+(g/l)=4.5×(V2- V1)×N注:V3=V2-V1;N(HCL):盐酸的浓度;V(HCL) :消耗盐酸的体积数二、酸砂槽化验方法控制标准:工作点在9~11试剂:1%酚酞指示剂、1N NaOH标准溶液测试项目:工作点、氟化氢铵含量方法:用移液管吸取槽液10ml于250ml锥形瓶中,加纯水50—100ml摇匀,加1%酚酞指示剂3—4滴,用1N NaOH 标准溶液滴定,出现粉红色为终点。
计算槽液工作点:W=N(NAON)×V(NAON)N(NAON):氢氧化钠的浓度V(NAON) :消耗氢氧化钠的体积数计算:C(NH4HF2)= (g/l)四、氧化槽化验方法:测试项目:游离酸、总酸、铝离子使用试剂:氟化钾、酚酞1%、1N氢氧化钠标准溶液方法:准确移取槽液5mL 于250mL 锥形瓶中,加水50mL,滴加酚酞4滴,用1N 氢氧化钠滴至粉红色,记下氢氧化钠消耗的毫升数V 1.准确移取槽液5mL 于250mL 于锥形瓶中,加水50mL ,加氟化钾3g,,滴加酚酞4滴,用1N 氢氧化钠滴至粉红色,记下氢氧化钠消耗的毫升数V 2.计算:游离酸浓度(g / L )=9.8×V 2×N总酸浓度:(g / L )= 9.8×V 1×N铝离子浓度(g / L )= 1.8×(V 1—V 2)×N注:N (NAON):氢氧化钠的浓度V (NAON) :消耗氢氧化钠的体积数五、常温封闭槽化验方法:测定项目:PH 值,镍,氟,PH 值于酸度计测得①镍含量:准确移取槽液5ml,加水50mL,缓冲溶液(PH=10)10mL ,紫脲酸氨指示剂少许,用0.01N EDTA 标准溶液滴至紫红色为终点V .计算: 镍含量(g / L )=1000505869.0⨯⨯⨯V N 注:N —EDTA 当量浓度②氟含量:移取槽液25mL ,加入TISAB (总离子强度调节缓冲溶液)25mL,于酸度计测得mV ,再曲线图查得含量。

氧化槽液杂质铁离子和氯离子的测定一、铁离子的测定(一)方法一(EDTA滴定法)1.方法摘要先加入氯化铵,再加入氨水,在氨性溶液中生成氢氧化铁沉淀,过滤后,将氢氧化铁溶于盐酸中,以氨水调酸度至PH为2左右以磺基水杨酸为指示剂,用EDTA滴定Fe3++ 3OH-→ Fe(OH)3↓Fe(OH)3 + 3H+ → Fe3++3H2OFe3++H2Y2 -→ FeY- +2H+氧化槽液中常见的金属杂质如铜、锌、镍、六价铬等,在氨性溶液中不沉淀,加入氯化铵,以防止钙、镁离子和铁离子一起沉淀, (如有三价铬,虽然沉淀,加入过氧化氢被氧化成六价铬,三价铬沉淀重新溶解和氢氧化铁沉淀分离),铝虽然和铁一起生成去氧化物沉淀,但在PH=2时,铝和EDTA不起反应,不干扰铁的测定。
2.试剂(1)氨水相对密度0.89(2)盐酸 1+1(3)100g/L磺基水杨酸溶液(4)0.02mol/L EDTA标准溶液3.分析方法吸取氧化槽液10mL于500mL烧杯中,加水200mL,先加入5g氯化铵,再加入氨水至溶液对石蕊试纸呈显著碱性,在不断搅拌,缓慢加入过氧化氢10mL,加热煮沸,静置片刻,以松质滤纸过滤,弃去滤液及洗液。
用热的盐酸20mL将沉淀自滤纸上溶解,并以热蒸馏水将滤纸洗净,滤液及洗液收集与原烧杯中,加水150mL和第一次一样以氨水沉淀铁,用原滤纸过滤,以热蒸馏水洗3-4次,弃去滤液及洗液。
用热的盐酸10mL将自滤纸上溶解,并以热水将滤纸洗净,溶液及洗液置于原烧杯中,加水至约100mL,滴加氨水至刚果红试纸由蓝色变为灰蓝色(PH=2左右,也可用精密pH试纸检验)。
加热至50-60,加入至磺基水杨酸1mL,以0.02mol/L EDTA溶液滴定至黄色或无色(视含铁量而定)。
终点系渐变,近终点时滴定速度应慢。
4.计算含铁ρFe = (cV×55.85)10-4 (μg/mL)式中 c----EDTA标准溶液浓度,mol/L;V----耗用EDTA标准溶液体积,mL。

氧化槽操作法
1.废液较少情况,系统体积较小,氧化液的配制:用15~18m3
自来水兑两桶或两桶以上的硫酸,并根据原料中铁含量配相应的二氧化锰粉
工艺条件:1. 酸度控制180~220克/升
2.系统体积适中或过大,氧化液的配制:用15~18m3电解废
液或电解废液与酸浸液的组成的混合液,根据化验结果液中F e2+含量添加二氧化锰粉。
工艺条件:1.未加酸浸液溶液可不做化验,也不用添加二氧化锰粉
2.添加酸浸液的溶液氧化后溶液中F e2+≤0.3 g/L
3.酸度控制140~180克/升
注:1.严禁无化验结果随意添加锰粉
2.氧化槽过液后,要求五分钟后再配氧化液。

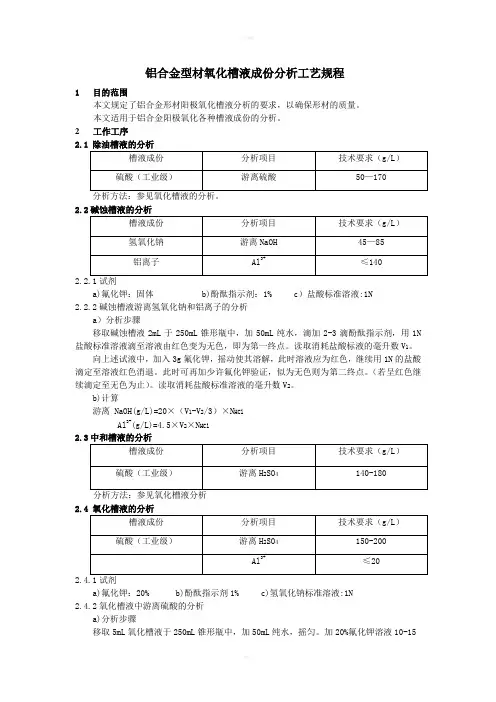
铝合金型材氧化槽液成份分析工艺规程1 目的范围本文规定了铝合金形材阳极氧化槽液分析的要求,以确保形材的质量。
本文适用于铝合金阳极氧化各种槽液成份的分析。
2工作工序分析方法:参见氧化槽液的分析。
a)氟化钾:固体 b)酚酞指示剂:1% c)盐酸标准溶液:1N2.2.2碱蚀槽液游离氢氧化钠和铝离子的分析a)分析步骤移取碱蚀槽液2mL于250mL锥形瓶中,加50mL纯水,滴加2-3滴酚酞指示剂,用1N 盐酸标准溶液滴至溶液由红色变为无色,即为第一终点。
读取消耗盐酸标液的毫升数V1。
向上述试液中,加入3g氟化钾,摇动使其溶解,此时溶液应为红色,继续用1N的盐酸滴定至溶液红色消退。
此时可再加少许氟化钾验证,似为无色则为第二终点。
(若呈红色继续滴定至无色为止)。
读取消耗盐酸标准溶液的毫升数V2。
b)计算游离 NaOH(g/L)=20×(V1-V2/3)×N HClAl3+(g/L)=4.5×V2×N HCl2.3中和槽液的分析分析方法:参见氧化槽液分析2.4 氧化槽液的分析2.4.1试剂a)氟化钾:20% b)酚酞指示剂1% c)氢氧化钠标准溶液:1N2.4.2氧化槽液中游离硫酸的分析a)分析步骤移取5mL氧化槽液于250mL锥形瓶中,加50mL纯水,摇匀。
加20%氟化钾溶液10-15mL,滴加3-4滴酚酞指示剂,用1N氢氧化钠标准溶液滴定至无色变为粉红色为终点。
读取消耗氢氧化钠标准溶液的毫升数V1。
b)计算游离H2SO4=9.8×V1×N naOH2.4.3总酸浓度的分析a)分析步骤移取5mL氧化槽液于250mL锥形瓶中,加50mL纯水,滴加3-4滴酚酞指示剂,用1N 氢氧化钠标准溶液滴定至试液由无色变为粉红色,且30秒不褪色为终点。
读取消耗氢氧化钠标准溶液的毫升数V2.b)计算总酸浓度(g/L)=9.8×V2×N naOH2.4.4铝离子的分析根据游离硫酸消耗氢氧化钠标准溶液的毫升数V1和总酸消耗氢氧化钠标准溶液的毫升数V2即可计算槽液中的铝离子浓度。

碱槽的化验1.试剂:(1)1N盐酸标液(2)葡糖糖酸钠(2)氟化钾(KF)(4)1%酚酞指示剂2.分析方法:吸槽液2ml→2g葡萄糖酸钠→50ml水→2滴酚酞→用1N HCL滴至红色消失为终点,记下读数V1毫升,然后1匙约4g KF 溶解,此时在显红色,继续用1N HCL 滴至消失为终点记下读数V2毫升。
3.计算总碱 NaOH=N×V1×0.04×1000 (1×V1×20 )铝离子 A13+=N×V2×0.009×1000 (1×V2×9÷2)游离子 NaOH=NaOH-(A1 3+1.48) 游离碱:总碱-(铝离子×1.48﹚N — HCL标液浓度V1 —滴定总碱时耗用的HCL标液的ml数V2 —滴定总碱和铝离子时耗用的HCL标液的ml数氧化、中和、除油槽的化验1.试剂(1)1N氢氧化钠标液(2)氟化钾(KF)(3)酚酞指示剂一. 硫酸总量的测定取5毫升试样于250毫升锥形瓶中,加入70毫升蒸馏水及数滴P.P(酚酞)指示剂,以1.0mol/1-NaOH滴定,当溶液由无色变为粉红色30秒钟内不退时为终点,并记录滴定所使用毫升数为V1。
计算:总硫酸(g/l)=N×V1×9.8二. 游离硫酸的测定铝含量在27g/1以内。
取5毫升试样于250毫升锥形瓶中,加入70毫升蒸馏水及数滴P.P(酚酞)指示剂,价3gKF,充分摇匀。
以1.0mol/1-NaOH滴定,当溶液有无色变为粉红色30秒钟内不退时为终点,并记录滴定所使用毫升数为V2.计算:游离硫磺(g/1)=N×V2×9.8三. 硫磺和铝的联合测定计算:硫磺(g/1)=N×V2×9.8A13+(g/1)=N×(V1-V2) ×1.8着色槽的化验1试剂:(1)0.05N EDTA标液 (2) 浓氨水(3)紫脲酸铵(4)碳酸氢钠(5)浓盐酸(6)淀粉指示剂(7)01.N碘液分析方法:(1)硫酸镍浓度取试样5毫升于25m锥形瓶中并加入50mll蒸馏水。

散热器前处理槽液检测标准、方法及工艺一、试剂的配比1、0.100mol/l Na2S2O3 标准溶液(硫代硫酸钠):称取Na2S2O3·5H2O(5水和硫代硫酸钠)固体25g溶于水500ml 中,转移至1000ml棕色容量瓶中加水稀释至刻度,放置一个星期后标定。
2、0.500mol/l NaOH标准溶液(氢氧化钠):称取氢氧化钠固体40.5g于500ml烧杯中,加纯水300ml,加入0.5-1.0g BaCl2,待冷却后,移于2000ml容量瓶中,加水稀释至刻度,放置数小时后取清澈液后,浑浊液静置过滤。
3、0.100mol/l NaOH标准溶液:称取4.05克NaOH于500ml烧杯中,加纯水300ml,加入0.5-1.0g BaCl2待冷却后,移于1000ml容量瓶中,加水稀释至1000ml摇匀,放置数小时,取清澈液后,浑浊液静置过滤。
4、50% H2SO4溶液(硫酸):取500ml水于1000mL烧杯中,把烧杯放在冷水,沿着玻璃棒慢慢加入浓硫酸并不断搅拌下加入500ml浓硫酸混匀,再稀释至1000ml。
5、25% H2SO4溶液(硫酸):取500ml水于1000mL烧杯中,把烧杯放在冷水,沿着玻璃棒慢慢加入浓硫酸并不断搅拌下加入250ml浓硫酸混匀,再稀释至1000ml。
6、酚酞指示剂(1%):称取1.0g酚酞指示剂,用95%无水乙醇稀释至100mL,让其完全溶解备用。
7、淀粉指示剂(1%):取100ml纯水加热煮沸倒入已用少许水湿润过的1.0g淀粉杯中,放在电炉加热煮沸1-2min(分钟)8、溴酚蓝指示剂:①、0.1克溴酚蓝溶于20ml酒精中,再加80ml水,倒入容器中备用。
②、0.1克溴酚蓝溶于100ml无水乙醇(酒精)中,转移入滴瓶中,贴标签备用。
9、Pa酸指示剂(N-苯基邻氨基苯甲酸)0.2 克N-苯基邻氨基苯甲酸和0.2克硫酸钠用水溶解后定容到100毫升的容量瓶中,混匀过滤使用。

前处理槽液检验指导书前处理槽液检验指导书前处理槽液检验时主要检验三部分:①游离酸②总酸度③促进剂C,具体检验方法和步骤如下:1.游离酸①检验方法;取移液管10ml待测磷化液放入锥形瓶中,加入50ml的蒸馏水后滴加3~4滴酚兰,用25ml的滴定管加标准液滴定,直至锥形瓶中的溶液变兰为止,用去标准液的量(以ml为单位)即为所测游离酸的酸度值。
②游离酸的范围应在1~2个点之间,1.5个点数时最好。
在检测的过程中,如果游离酸过高或过低,可加适量的调整液B去调整。
一般情况下提高或降低一个点数加1.8公斤(每吨)的调整液B.2.总酸度:①检验方法:取移液管10ml待测磷化液放入锥形瓶+50ml的蒸馏水滴加3~4滴酚酞,用25ml的滴定管加标准液滴定,直至锥形瓶中的溶液变粉红色为止,用去标准液的量(以ml为单位)即为所测总酸度的酸度值。
②总酸度的范围应在30~40个点数之间,35个点数时最好。
在检测的过程中,如果总酸度过高或过低,可加适量的磷化调整液A去调整。
一般情况下提高或降低一个点数加3.8公斤(每吨)的调整液A3.促进剂C:①检验方法:用三角管丛磷化槽中取满磷化液,同时取0.5g的氨基磺酸,待三角管放平之后把氨基磺酸从管口放入,同时用拇指堵住,直至反应完毕为止,此时三角管中减少的液体量即为促进剂C 的测定点数②促进剂C的范围应在5~7个点数之间。
在检测的过程中,如果促进剂C的值过高或过低,可加适量的促进剂C去调整。
一般情况下提高或降低一个点数加2公斤(每吨)的促进剂C.电泳漆槽液检验指导书电泳漆槽液主要有四部分组成:①树脂②色膏③溶剂④水,所以检测时主要检测以下几部分:①PH值②电导③固体份④灰份,由这几部分的含量可以推测出槽液的哪部分出现问题,从而采取相应的措施来调整槽液。
1.PH值的测定●判定标准:电极平时要放在3mol/L的KCl溶液中浸泡,测定槽液的PH值为5.8~6.4时符合作业要求。
●检测方法:①按照PH计使用说明书的要求,安装调试好PH计,并进行PH=4.00和PH=6.86的溶液校正。
氧化、电泳槽液试验规程1.除油槽液1.1测定项目:AC为浓度1.2试剂氢氧化钠标准溶液:(0.5mol/L) 1 %酚酞指示剂1.3分析步骤移取20 ml槽液于锥形瓶中,加50ml纯水,滴加2—3滴酚酞指示剂,用0.5N氢氧化钠标准溶液滴定至由无色变成粉红色为终点,记下氢氧化钠标准溶液的所耗数(V)。
1.4计算公式:AC%=0.265×V× f = (0.265×V×N) / 0.5=0.53×N×V式中:f ——氢氧化钠标准溶液的标准系数;N——氢氧化钠标准溶液的摩尔浓度;V——消耗氢氧化钠标准的亳升数。
2.碱洗槽液2.1测定项目:游离氢氧化钠浓度、铝离子浓度。
2.2试剂氟化钾 1%酚酞指示剂盐酸标准溶液(1N)2.3分析步骤:移取5ml槽液,加入少许葡萄糖酸钠,再加入2—3滴酚酞指示剂,用1N盐酸标准溶液滴定,当溶液由红色变为无色时,记下此时盐酸标准溶液的消耗量(V1),即为第一终点;在以上试液中,加入氟化钾1~3g,摇溶,继续用1N的盐酸标准溶液滴至红色刚好消失为止,再加入少许氟化钾,如变红色,则继续滴至红色刚好消失为第二终点,记下加氟化钾之后的盐酸标准溶液的消耗量(V2)。
2.4计算公式:游离子NaoH(g/L)=[N×(V1-V2/3×40)/ 5=2.66×(3 V1-V2)×NAl3+ = 1.8×N×VV1——第一终点消耗盐酸溶液毫升数;V2——第二终点消耗盐酸溶液毫升数;40 ——氢氧化钠的毫克当量。
3.中和槽液氧化槽液3.1测定项目游离酸浓度铝离子浓度3.2试剂氢氧化钠标准溶液:(1.0mol/L) 0.1%甲基橙指示剂 1%酚酞指示剂3.3分析步骤:吸取25ml槽液于250ml锥形瓶中,加入50ml去离子水,滴加数滴甲橙的毫升数(V1);指示剂,用1N NaoH滴至溶液由红色变为橙黄色为终点,记下所耗氢氧化钠标准溶液在以上反应液中,再滴加1%酚酞指示剂数滴,继续用1N NaoH滴定,滴至粉红色不消失为止(V2)。
铝合金型材氧化槽液成份分析工艺规程1 目的范围本文规定了铝合金形材阳极氧化槽液分析的要求,以确保形材的质量。
本文适用于铝合金阳极氧化各种槽液成份的分析。
2工作工序分析方法:参见氧化槽液的分析。
a)氟化钾:固体 b)酚酞指示剂:1% c)盐酸标准溶液:1N2.2.2碱蚀槽液游离氢氧化钠和铝离子的分析a)分析步骤移取碱蚀槽液2mL于250mL锥形瓶中,加50mL纯水,滴加2-3滴酚酞指示剂,用1N 盐酸标准溶液滴至溶液由红色变为无色,即为第一终点。
读取消耗盐酸标液的毫升数V1。
向上述试液中,加入3g氟化钾,摇动使其溶解,此时溶液应为红色,继续用1N的盐酸滴定至溶液红色消退。
此时可再加少许氟化钾验证,似为无色则为第二终点。
(若呈红色继续滴定至无色为止)。
读取消耗盐酸标准溶液的毫升数V2。
b)计算游离 NaOH(g/L)=20×(V1-V2/3)×N HClAl3+(g/L)=4.5×V2×N HCl2.3中和槽液的分析分析方法:参见氧化槽液分析2.4 氧化槽液的分析2.4.1试剂a)氟化钾:20% b)酚酞指示剂1% c)氢氧化钠标准溶液:1N2.4.2氧化槽液中游离硫酸的分析a)分析步骤移取5mL氧化槽液于250mL锥形瓶中,加50mL纯水,摇匀。
加20%氟化钾溶液10-15mL,滴加3-4滴酚酞指示剂,用1N氢氧化钠标准溶液滴定至无色变为粉红色为终点。
读取消耗氢氧化钠标准溶液的毫升数V1。
b)计算游离H2SO4=9.8×V1×N naOH2.4.3总酸浓度的分析a)分析步骤移取5mL氧化槽液于250mL锥形瓶中,加50mL纯水,滴加3-4滴酚酞指示剂,用1N 氢氧化钠标准溶液滴定至试液由无色变为粉红色,且30秒不褪色为终点。
读取消耗氢氧化钠标准溶液的毫升数V2.b)计算总酸浓度(g/L)=9.8×V2×N naOH2.4.4铝离子的分析根据游离硫酸消耗氢氧化钠标准溶液的毫升数V1和总酸消耗氢氧化钠标准溶液的毫升数V2即可计算槽液中的铝离子浓度。
氧化车间槽液分析方法一、氧化槽液的分析1.游离硫酸的测定(1) 准确吸取氧化槽液5ml于250ml锥形瓶中,加水100ml摇匀;(2) 加10%的氟化钾溶液5ml摇匀;(3)滴加酚酞指示剂3~5滴;(4)用1mol/L的氢氧化钠标准溶液滴定至淡红色为终点;(5)计算:游离硫酸含量=标准氢氧化钠消耗的毫升数×9.8(g/L)2.总硫酸的测定(1)准确吸取氧化槽液5ml于250ml锥形瓶中,加水100ml摇匀;(2)滴加酚酞指示剂3~5滴;(3)用1mol/L的氢氧化钠标准化液滴定至淡红色为终点;(4)计算:总硫酸含量(g/L)=消耗氢氧化钠标准液的毫升数×9.8。
3. 游离硫酸及铝的连续测定(1)准确吸取氧化槽液5ml于250ml锥形瓶中,加水50ml摇匀;(2) 滴加甲基橙指示剂2滴;(3)用1mol标准氢氧化钠溶液滴定至由红色转为橙色为终点;(4)在(3)中滴加酚酞指示剂4~5滴;(5)以1mol/L氢氧化钠标准液滴定至粉红色不消失为终点(速度要慢);(6) 计算游离硫酸含量(g/L)=(3)消耗的氢氧化钠的毫升数×9.8铝的含量(g/L)=(5)的毫升数-(3)的毫升数×1.8二、碱洗槽液的测定(1)准确吸取槽液5ml于250ml锥形瓶中;(2)加水50ml;(3)滴加酚酞指示剂2~3滴;(4)用1mol H2SO4标准溶液滴定至溶液红色消失为终点;(5)计算:氢氧化钠含量(g/L)=消耗硫酸标准液的毫升数×8三、中和槽液的测定(1)准确吸取槽液5ml于250ml锥形瓶中;(2)加水50ml;(3)滴加酚酞指示剂3~5滴;(4)用1mol氢氧化钠标准液滴定至溶液变淡红色为终点;(5)计算:硝酸的含量(g/L)=消耗氢氧化钠标准液的毫升数×12.6。
四、染色槽液的测定1.PH—玻璃电极法(1) PH计使用前须进行PH=4.008和PH=6.86的标准液的两点校准;(2) 取少许槽液于烧杯或直接在槽液中进行测定。
碱槽的化验1.试剂:(1)1N盐酸标液(2)葡糖糖酸钠(2)氟化钾(KF)(4)1%酚酞指示剂2.分析方法:吸槽液2ml→2g葡萄糖酸钠→50ml水→2滴酚酞→用1N HCL滴至红色消失为终点,记下读数V1毫升,然后1匙约4g KF 溶解,此时在显红色,继续用1N HCL 滴至消失为终点记下读数V2毫升。
3.计算总碱 NaOH=N×V1×0.04×1000 (1×V1×20 )铝离子 A13+=N×V2×0.009×1000 (1×V2×9÷2)游离子 NaOH=NaOH-(A1 3+1.48) 游离碱:总碱-(铝离子×1.48﹚N — HCL标液浓度V1 —滴定总碱时耗用的HCL标液的ml数V2 —滴定总碱和铝离子时耗用的HCL标液的ml数氧化、中和、除油槽的化验1.试剂(1)1N氢氧化钠标液(2)氟化钾(KF)(3)酚酞指示剂一. 硫酸总量的测定取5毫升试样于250毫升锥形瓶中,加入70毫升蒸馏水及数滴P.P(酚酞)指示剂,以1.0mol/1-NaOH滴定,当溶液由无色变为粉红色30秒钟内不退时为终点,并记录滴定所使用毫升数为V1。
计算:总硫酸(g/l)=N×V1×9.8二. 游离硫酸的测定铝含量在27g/1以内。
取5毫升试样于250毫升锥形瓶中,加入70毫升蒸馏水及数滴P.P(酚酞)指示剂,价3gKF,充分摇匀。
以1.0mol/1-NaOH滴定,当溶液有无色变为粉红色30秒钟内不退时为终点,并记录滴定所使用毫升数为V2.计算:游离硫磺(g/1)=N×V2×9.8三. 硫磺和铝的联合测定计算:硫磺(g/1)=N×V2×9.8A13+(g/1)=N×(V1-V2) ×1.8着色槽的化验1试剂:(1)0.05N EDTA标液 (2) 浓氨水(3)紫脲酸铵(4)碳酸氢钠(5)浓盐酸(6)淀粉指示剂(7)01.N碘液分析方法:(1)硫酸镍浓度取试样5毫升于25m锥形瓶中并加入50mll蒸馏水。
氧化、电泳槽液试验规程
1.除油槽液
1.1测定项目:AC为浓度
1.2试剂
氢氧化钠标准溶液:(0.5mol/L) 1 %酚酞指示剂
1.3分析步骤
移取20 ml槽液于锥形瓶中,加50ml纯水,滴加2—3滴酚酞指示剂,用0.5N氢氧化钠标准溶液滴定至由无色变成粉红色为终点,记下氢氧化钠标准溶液的所耗数(V)。
1.4计算公式:
AC%=0.265×V× f = (0.265×V×N) / 0.5=0.53×N×V
式中:f ——氢氧化钠标准溶液的标准系数;
N——氢氧化钠标准溶液的摩尔浓度;
V——消耗氢氧化钠标准的亳升数。
2.碱洗槽液
2.1测定项目:游离氢氧化钠浓度、铝离子浓度。
2.2试剂
氟化钾 1%酚酞指示剂盐酸标准溶液(1N)
2.3分析步骤:
移取5ml槽液,加入少许葡萄糖酸钠,再加入2—3滴酚酞指示剂,用1N盐酸标准溶液滴定,当溶液由红色变为无色时,记下此时盐酸标准溶液的消耗量(V
1
),即为第一终点;在以上试液中,加入氟化钾1~3g,摇溶,继续用1N的盐酸标准溶液滴至红色刚好消失为止,再加入少许氟化钾,如变红色,则继续滴至红色刚好消失为第二终点,记下加氟化钾之
后的盐酸标准溶液的消耗量(V
2
)。
2.4计算公式:
游离子NaoH(g/L)=[N×(V
1-V
2
/3×40)/ 5=2.66×(3 V
1
-V
2
)×N
Al3+ = 1.8×N×V
V
1
——第一终点消耗盐酸溶液毫升数;
V
2
——第二终点消耗盐酸溶液毫升数;
40 ——氢氧化钠的毫克当量。
3.中和槽液氧化槽液
3.1测定项目游离酸浓度铝离子浓度
3.2试剂
氢氧化钠标准溶液:(1.0mol/L) 0.1%甲基橙指示剂 1%酚酞指示剂
3.3分析步骤:
吸取25ml槽液于250ml锥形瓶中,加入50ml去离子水,滴加数滴甲橙的毫升数(V
1
);
指示剂,用1N NaoH滴至溶液由红色变为橙黄色为终点,记下所耗氢氧化钠标准溶液在
以上反应液中,再滴加1%酚酞指示剂数滴,继续用1N NaoH滴定,滴至粉红色不消失为止(V
2
)。
3.4计算公式:
H
2SO
4
(g/L) = [(N×V
1
×0.049×1000)/ 5=9.8×N×V
1
Al3+ (g / L) = [N×(V
2-V
1
)×0.009×1000]/ 5=1.8×N×(V
2
-V
1)
4.着色槽液(1)
测定项目:硫酸亚锡浓度、游离酸浓度、硫酸镍浓度
4.1试剂及仪器
淀粉指示剂、碘标准溶液(0.1mol/L)、30%酒石酸、紫脲酸胺指示剂、氢氧化钠标准液(0.1mol/L)、EDTA(0.05mol/L)
4.2分析步骤:
4.2.1硫酸亚锡浓度
吸取槽液10ml于250ml三角瓶中,加入50ml纯水,10ml30%的酒石酸,2 ml淀粉指示剂,用0.1mol/L碘标准溶液滴定至溶液变成蓝色为终点,记下所耗的碘标准溶液的毫升数(V
1
)。
计算硫酸亚锡浓度:
H
2SO
4
(g/L) =(N×V
1
×107.4)/ 10=10.74×N×V
式中:V
1
——碘标准溶液的消耗数;
N——碘标准溶液的摩尔浓度。
4.2.2游离酸浓度
移取50ml槽液于400ml烧杯中,加200ml蒸馏水,摇匀,插入PH计的电极(有磁力搅拌),用1mol/L氢氧化钠标准溶液滴至PH值达到2.1为止,记下氢氧化钠标准溶液的消耗量
(V
1
)。
计算其浓度:
游离H
2SO
4
(g/L) = (N×V×49)/ 50=0.98×N×V
4.2.3硫酸镍浓度
移取5ml槽液于250ml锥形瓶中,加50ml纯水,加10ml PH=10缓冲液,少量紫脲酸胺指示剂,用0.05mol/L的EDTA滴定有至溶液由橙黄色变为紫红色为止,记下消耗的EDTA毫升数(V
1
)。
计算公式:
式中:V
1
—— EDTA标准溶液的消耗体积数;
N —— EDTA标准溶液的浓度。
5.着色槽液(2)
测定项目、GD电解着色剂浓度、游离酸(F.A)浓度。
5.1试剂及仪器
氟化钾、紫脲酸铵指示剂、氨-氯化铵缓冲液(PH=10)、EDTA(0.01mol/L)、氢氧化钠标准溶液(1.0mol/L)
5.2分析步骤:
5.2.1GD电解着色剂浓度
移取10ml槽液于250ml三角瓶中,加100ml纯水,加1—2g氟化钾,少量紫脲酸胺指示剂,摇匀,滴加PH=10缓冲液至试液呈绿色,用0.01(mol/L)EDTA滴定,试液突变成紫红色为终点,记下EDTA的消耗量(V)。
计算公式:
GD(g/L) = 312×N×V
式中:
N—— EDTA标准溶液摩尔浓度;
V
1
—— EDTA标准溶液消耗的毫升数。
5.2.1游离酸(F〃A)
移取25ml槽液于250ml三角瓶中,加入100ml纯水,以PH计直接置入1.0 mol/L氢氧气钠标准溶液于上述试液中,直至PH=2.1时,记下氢氧气钠标准溶液所消耗的体积数(V)。
计算方式:
游离酸(g/L)式盐= 1.96×N×V
6.封孔槽液
测定项目:镍离子浓度、氟离子浓度。
6.1试剂及仪器
紫脲酸胺指示剂、氨水、EDTA(0.01mol/L)、酸度计、甘汞电极、参比电极、氟化钠。
6.1.1镍离浓度标准曲线绘制
移取5ml槽液,放入250ml锥形瓶中,加50ml纯水,10ml浓氨水,摇匀,加放适量紫脲酸胺指示剂,用0.01mol/L的EDTA滴至溶液由橙黄变为紫红色为终点,记下消耗EDTA的毫升数(V)。
按下列公式算其浓度:
Ni2+(g/L) = (58.69×N×V)/ 5=11.74×N×V
式中:V—— EDTA标准液的消耗体积数;
N—— EDTA标准液摩尔浓度。
6.1.2 F-浓度
用移液管分别移取20ml,0.0001、0.001、0.01、0.1mol/L,F—标准溶液于四个50ml塑料杯中,分别加入20ml TISAB溶液,以浓度由低到高为顺序,分别插入电极,并用磁力搅拌
3min,读取电位值E
1、E
2
、E
3
、E
4
,在二级单对数坐标上,以电位E[对(mv)]为纵坐标,以
F—浓度为对数横坐标(F—mol/L),作标准曲线。
6.1.3样品测定
用移液管移取20ml槽液于烧杯中,加入20ml TISAB溶液,插入电极,用磁力搅拌3min,读取电位值(EX),根据测得的电位值,在标准曲线上查得CF—的摩尔浓度。
F—含量按下列公式计算:
F—(g/L) = CF—×19
7.电泳槽液
测定项目:固成份、酸值
7.1试剂及仪器
酸价液:1:1苯与无水乙醇、1%酚酞指示剂、烘箱、分析天平
7.1.1固成份测定
称取试样5~10g(精确至0.0002g),经烘箱180℃加热恒温1小时,取出试样,置于干燥器中冷却后称量。
计算公式:
固成份% = (G
2 / G
1
)×100%
式中:G
1
——烘干前质量
G
2
——烘干后质量
7.1.2酸值
称取试样10g,(精确至0.0002g),溶于50 ml酸价液中,移入250ml三角瓶中加入2~3滴1%酚酞指示剂,用KOH标准液滴至溶液由乳白色变为粉红色为终点,读取所耗KOH标准溶液的毫升数(V)。
计算公式:
酸值勤 =( V×f×5.61)/(G×固成份)
式中f —— KOH校准系数,
G ——试样量
5.61—— KOH分子量。
注:正常生产时每12小时试验一次(8:00/20:00)
2012年11月20日。