第四章-第二节-缓冲溶液PH值得计算
- 格式:ppt
- 大小:6.61 MB
- 文档页数:50


![缓冲溶液ph值计算公式[整理版]](https://uimg.taocdn.com/b6937d08fd4ffe4733687e21af45b307e971f941.webp)
缓冲溶液pH值计算公式裴老师教你学化学许多化学反应(包括生物化学反应)需要在一定的pH值范围内进行,然而某些反应有H+或OH-的生成或消耗,溶液的pH值会随反应的进行而发生变化,从而影响反应的正常进行。
在这种情况下,就要借助缓冲溶液来稳定溶液的pH 值,以维持反应的正常进行。
在无机化学的教学中,为了使学生根据反应所要控制的pH值范围,能正确选择和配制缓冲溶液,就需要要求学生对缓冲溶液pH 值的计算公式熟练掌握并能灵活应用。
缓冲溶液pH值的计算公式,根据缓冲溶液的组成大致可分为两大类型。
1 由弱酸及弱酸盐组成的缓冲溶液设弱酸的浓度为C酸(mol·L-1),弱酸盐的浓度为C盐(mol·L-1),在溶液中存在下列平衡:HA H+ + A- [1](P78)平衡时:C酸-x xC盐+xKa°= x(C盐+x)/(C酸-x)x = [H+]= Ka°(C酸-x)/(C盐+x)由于Ka°值较小,且因存在同离子效应,此时x很小,因而C酸-x≈C酸,C盐+x≈C盐,所以[H+]= Ka°C酸/ C盐将该式两边取负对数:-log[H+]=-logKa°-logC酸/ C盐,所以pH = pKa°-logC酸/ C盐(1)这就是计算一元弱酸及弱酸盐组成的缓冲溶液pH值的通式。
2 由弱碱及弱碱盐组成的缓冲溶液设弱碱的浓度为C碱(mol·L-1),弱碱盐的浓度为C碱(mol·L-1),在溶液中存在下列平衡:B + H2O BH+ + OH- [2]( P140)平衡时:C碱-x C盐+xxKb°= x(C盐+x)/ (C碱-x)x = [OH-]= Kb°(C碱-x)/ (C盐+x)由于Kb°较小,且因存在同离子效应此时x很小,因此C碱-x≈C碱,C 盐+x≈C盐,所以,[OH-]= Kb°C碱/ C盐将该式两边取负对数:-log[OH-]=-logKb°-logC碱/ C盐pOH = p Kb°-logC碱/ C盐又因pH = 14 - pOH,所以pH = 14 -pKb°+ logC碱/ C盐(2)这就是计算一元弱碱及弱碱盐组成的缓冲溶液pH值的通式。

缓冲溶液的ph计算公式
缓冲溶液的pH计算公式可以通过韦恩-黑斯特定律推导得出,公式如下:
pH = pKa + log([A-]/[HA])
其中,pH表示缓冲溶液的pH值,pKa表示缓冲酸的离解常数,[A-]表示共轭碱的浓度,[HA]表示缓冲酸的浓度。
需要特别注意的是,缓冲溶液的pH值可以被pKa和缓冲剂的浓度所控制。
当缓冲溶液中缓冲剂的浓度高于一定程度时,缓冲溶液可以在一定范围内稳定维持pH值不变,从而发挥缓冲作用。
另外,缓冲溶液的选择应该根据所需缓冲范围和缓冲溶液应用的实际情况进行选择。
常见的缓冲剂包括Tris、HEPES、MES、MOPS等。
在实验室中,缓冲溶液通常用于调节pH值,维持生物体系的稳定性,从而保证实验结果的准确性。

缓冲溶液的ph怎么计算例子缓冲溶液是一种具有特定pH值的溶液,具有稳定溶液的性质,能
维持溶液中的H+浓度以保持pH值稳定。
它主要用于生物分类,分子生物学中的技术和实验室实验的稳定溶液。
缓冲溶液的pH值可以采用以
下方法来计算。
1.由缓冲溶液的组成成份计算:缓冲溶液的pH值主要取决于其组
成的化学物质的结构、种类及含量。
它们是涉及到pH值变化的主要原子,可以根据缓冲溶液中化学物质的摩尔浓度及其pK(即质子化常数)做出预测,从而计算这种缓冲溶液的pH值。
比如,0.1mol/L的NH3溶液属于中性,这是由其Kb(即碱化常数)计算出来的。
2.由水热分解计算:借助于热分解,把水分解出H+和OH-,用测
定仪表监测H+的浓度,并与OH-综合,从而计算出pH值。
3.由称量计算:根据缓冲溶液的成分,以及定容容量的方式,称
量酒石酸和碳酸钠的比例,比重相同的情况下,将他们混合溶解,可
以得出具体的pH值。
缓冲溶液的pH计算是一个比较复杂的过程,一般都是用一种以上
的方法搭配使用,从而得出精准的结果。
例如,同时使用由组成成份
计算和热分解计算这两种方法,以获得更精确的pH值。
当然,如果只
有基本的实验条件,可以使用称量计算的方法来衡量pH值。
缓冲溶液的pH值计算是实验室中非常官方的。
在实验室实验中,
缓冲溶液的pH值是必须正确测定的,因为它们直接影响着实验的结果。
而计算出精准的pH值是一个不可缺少的步骤。
因此,正确计算缓冲溶
液的pH值对于确保实验质量至关重要。



缓冲溶液通常由共轭的酸碱对组成,如醋酸和醋酸钠,草酸氢钠和草酸钠,邻苯二甲酸氢钾和邻苯二甲酸钾等,能有效抵御酸碱的少量加入,保持pH的基本稳定。
下面以1mol/L 醋酸和1mol/L醋酸钠的缓冲对为例,介绍缓冲溶液pH值的计算方法:
- 公式:pH=pKa+lg(c(醋酸根)/c(醋酸))。
- 计算过程:
- Ka=c(氢离子)·c(醋酸根)/c(醋酸)。
- 两边取负对数,得:-lg Ka=-lg(c(氢离子)·c(醋酸根)/c(醋酸))。
- pKa=-lg(c(氢离子)·c(醋酸根)/c(醋酸)),即为该缓冲溶液的pKa值。
- pH=pKa+lg(c(醋酸根)/c(醋酸)),即可计算出该缓冲溶液的pH值。
一般来说,缓冲溶液的浓度越大,酸碱浓度的比例越接近1:1,缓冲效果越好。
但缓冲溶液的作用是有限的,超过一定限度,上述两个有利因素就会被破坏,缓冲范围一般在上下1个pH单位左右。
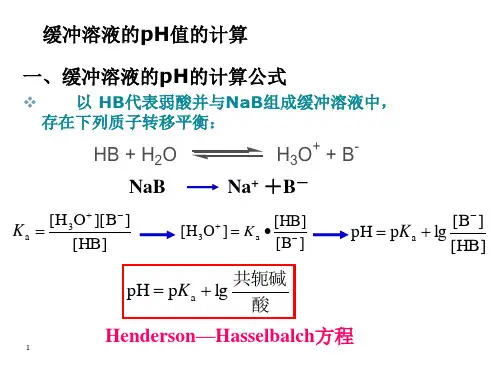
缓冲溶液pH 值的计算一、缓冲公式缓冲溶液实际上是一个酸碱共轭体系,在共轭酸〔HB 〕及其共轭碱(B -)组成的缓冲溶液中,HB 和B -之间存在质子转移平衡,那么为:HB + H 2O H 3O + + B -平衡时,按照化学平衡原理,存在平衡常数,可以写成HB][]B ][O [H 3a -+=K][B HB][a ]O H [3-+=K 两边取负对数,得:[HB]][B lg p pH -a K += 即][][lg p pH 共轭酸共轭碱+=a K 此式为计算缓冲溶液pH 的亨德森-哈塞尔巴赫方程式,又称为缓冲公式。
应用此公式,可以计算各种缓冲溶液的pH 。
式中,[B -]和[HB] 指的是溶液中共轭碱和共轭酸的平衡浓度。
由于共轭碱对共轭酸产生了同离子效应,共轭酸的平衡浓度[HB]可近似等于它在混合溶液中的浓度,共轭碱的平衡浓度[B -]也可近似等于它在混合溶液中的浓度,即:[HB]= c (HB),[B ‾]= c (B ‾),亨德森-哈塞尔巴赫方程式可以写成:)()B (lg P pH -HB c c K a += 从上式可以看出,缓冲溶液的pH 大小主要取决于缓冲溶液中共轭酸HB 的a K 和缓冲比]HB []B [-。
对于统一缓冲系,a K 为定值,溶液的pH 主要取决于缓冲比。
使用公式计算式,注意缓冲系中对应的a K 值。
例如,在H 2CO 3-HCO 3-缓冲系中,用1a K ,在HCO 3--CO 32-缓冲系中,用2a K 。
在NH 4+-NH 3缓冲系中,共轭酸NH 4+与共轭碱NH 3的电离常数的关系为w b a K K K =⋅ )NH ()NH (34b w a K K K =+ )NH (p 14)NH (p 34b a K K -=+几种常见的缓冲对的pH 计算公式为:二、决定缓冲溶液pH 大小的因素缓冲溶液的pH 取决于缓冲系中弱酸HB 的pK a , 温度对其有影响缓冲比[B -]/[HB] 。