最新高中化学《铝及其化合物》
- 格式:doc
- 大小:173.50 KB
- 文档页数:2



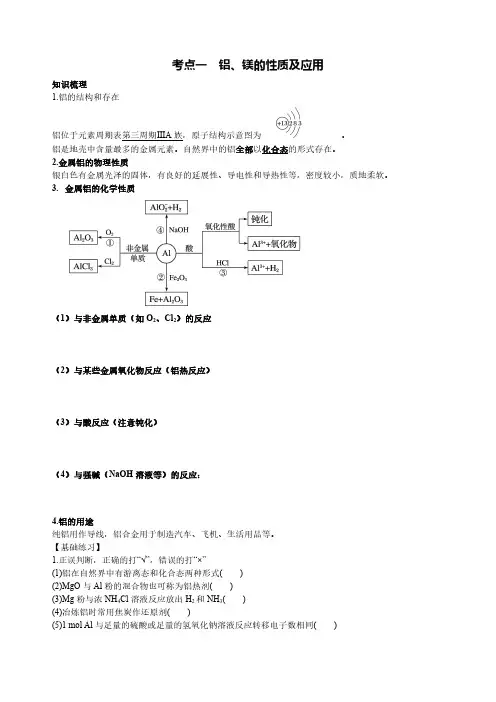
考点一铝、镁的性质及应用知识梳理1.铝的结构和存在铝位于元素周期表第三周期ⅢA族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质(1)与非金属单质(如O2、Cl2)的反应(2)与某些金属氧化物反应(铝热反应)(3)与酸反应(注意钝化)(4)与强碱(NaOH溶液等)的反应:4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
【基础练习】1.正误判断,正确的打“√”,错误的打“×”(1)铝在自然界中有游离态和化合态两种形式()(2)MgO与Al粉的混合物也可称为铝热剂()(3)Mg粉与浓NH4Cl溶液反应放出H2和NH3()(4)冶炼铝时常用焦炭作还原剂()(5)1mol Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同()(6)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()题组一对比掌握铝、镁的性质1.镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。
工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是A.①和②B.②和③C.③和④D.④和⑤2.下列关于铝单质的叙述中正确的是A.由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长B.由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属C.常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层D.由于铝的导电性能比铜强,所以常用铝制造电线、电缆题组二铝与酸或碱反应的计算3.(2016·河北衡水中学高三模拟)将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是A.3mol/L HClB.4mol/L HNO3C.8mol/L NaOHD.18mol/LH2SO44.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。


点燃 铝及其化合物 知识点一. 铝单质的性质1.物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2.化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3 铝热剂是Al 和 Fe 2O 3(4)与沸水微弱反应:2Al+6H 2O Δ 2Al (OH )3 + 3H 2↑(5)与酸反应::2Al+6HCl ====== 2AlCl 3+H2↑2Al+3H 2SO 4 ====== Al 2(SO 4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:②Al(OH)3+NaOH ======== NaAlO 2+2H 2O知识点二. 铝的重要化合物1. 氧化铝(Al 2O 3)化合价降低,被还原,得6e —①2Al+6H 2O ====== 2Al(OH)3 + 3H 2↑化合价升高,被氧化,失6e —2Al+6H 2O+2NaOH = 2NaAlO 2+3H 2↑+4H 2O失2×3 e —得6×e —(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
常作耐火材料。
刚玉的主要成分是Al 2O 3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。

高中化学铝及其化合物知识点
高中化学铝及其化合物知识点
一、铝的基本性质
铝是一种具有典型金属性的轻金属,具有许多良好的物理化学性质,例如具有较高的导热性和电导率,低密度和良好的可塑性等。
二、铝的制备方法
1. 金刚砂法
2. 电解法
三、铝的氧化物——氧化铝
氧化铝是一种常见的氧化物,也是铝的重要产物。
它具有很高的熔点和硬度,在高温环境下能保持极好的稳定性。
四、铝的氢氧化物——氢氧化铝
氢氧化铝是一种白色无定形粉末,容易吸收水分,也是很常见的铝的化合物。
它常用于制备其他铝化合物,如氧化铝等。
五、铝与酸、碱的反应
铝在一定的条件下与酸发生反应,会产生氢气和相应的铝盐。
与碱的反应则会生成相应的铝盐和氢氧化铝。
六、铝的应用领域
1. 金属材料——铝合金
2. 化工领域——氢氧化铝生产
3. 医疗领域——生物医学器械制造
4. 轻工业——食品包装、建筑材料
七、铝在环境中的影响
铝的大量排放对环境和生态系统造成了很大的负担,铝在水体中的存在会导致生态系统的异常变化和动植物死亡。
同时,铝的废弃物也会污染土地和空气,对人类健康造成不良影响。
八、铝及其化合物的安全问题
铝及其化合物存在一定的安全问题,长期接触铝化合物会对人体神经系统产生影响,增加患上老年痴呆症等疾病的概率。
总之,对于高中化学学生而言,学习铝及其化合物的知识点是非常重要的,理解这些知识将有助于他们更好地掌握化学基础理论,从而为未来更深入地研究化学打下坚实的基础。


点燃 铝及其化合物 ❖ 教学目标掌握铝单质及其化合物的相关性质及相关反应❖ 知识梳理知识点一. 铝单质的性质1.物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2.化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3 铝热剂是Al 和 Fe 2O 3(4)与沸水微弱反应:2Al+6H 2O Δ 2Al (OH )3 + 3H 2↑(5)与酸反应::2Al+6HCl ====== 2AlCl 3+H2↑2Al+3H 2SO 4 ====== Al 2(SO 4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:②Al(OH)3+NaOH ======== NaAlO 2+2H 2O知识点二. 铝的重要化合物化合价降低,被还原,得6e —①2Al+6H 2O ====== 2Al(OH)3 + 3H 2↑化合价升高,被氧化,失6e —2Al+6H 2O+2NaOH = 2NaAlO 2+3H 2↑+4H 2O失2×3 e —得6×e —1. 氧化铝(Al 2O 3)(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
常作耐火材料。

第2讲 铝及其重要化合物[考纲要求] 理解铝及其重要化合物的主要性质和应用。
1.铝的结构和存有铝位于元素周期表第三周期ⅢA 族,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于硅。
自然界中的铝全部以化合态存有。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中相关反应的化学方程式或离子方程式:①Al O2⎪⎪⎪⎪――→ 常温 形成致密的氧化膜――→ 点燃 4Al +3O2=====点燃2Al2O3②2Al +3Cl2=====点燃2AlCl3 ③Al 酸⎪⎪⎪⎪――→氧化性酸遇冷的浓硫酸或浓硝酸钝化――→非氧化性酸2Al +6HCl===2AlCl3+3H2↑④2Al +2NaOH +2H2O===2NaAlO2+3H2↑⑤2Al +Fe2O3=====高温Al2O3+2Fe(铝热反应)4铝 镁 与非金属反应能被Cl2、O2氧化 2Mg +O2=====点燃2MgO 3Mg +N2=====点燃Mg3N2 与水反应 反应很困难 能与沸水反应Mg +2H2O=====△Mg(OH)2+H2↑与碱反应能溶于强碱溶液 不反应 与某些氧化物反应 能与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应 能在CO2中燃烧:2Mg +CO2=====点燃2MgO +C5.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
深度思考1.铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能? 答案 铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。
2.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H2SO4或浓HNO3?答案 常温下浓H2SO4、浓HNO3能使铝钝化(在表面形成一层致密的氧化膜),阻止反应继续实行。
3.实验室能否用硫化物与铝盐溶液混合制取Al2S3?用离子方程式说明原因。

铝及其化合物
班级:姓名:小组: .
1.铝箔在空气中加热,金属熔化而不滴落的原因是()
A.熔化的金属铝非常黏稠B.铝的密度小,所受重力也
C.大部分铝已经被氧化D.氧化膜的熔点比铝高,兜住了熔化的铝
2.下列通过制取硫酸铝、氢氧化铝,获得氧化铝的装置和原理能达到实验目的的是()A.制硫酸铝B.制氢氧化铝
C.过滤氢氧化铝D.灼烧制氧化铝
3.对于金属,下列叙述正确的是()
A.点燃镁、铝前应用砂纸打磨,除去表面的氧化膜
B.用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来
C.铁在氧气中燃烧的产物主要成分是Fe2O3
D.金属单质在自然界中都以化合物存在,因为它们都有较强的还原性
4.有关Al与NaOH溶液反应的说法中,正确的是( )
A.Al是还原剂,NaOH及H2O均是氧化剂
B.还原产物是H2,且由H2O还原所得的H2与由NaOH还原所得的H2物质的量之比为2∶1
C.此反应说明铝具有两性,铝的活泼性比只具有金属性的金属弱
D.此反应中,只有H2O是氧化剂,NaOH既不是氧化剂也不是还原剂
5.铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )
A.都有H2O生成B.都有H2生成C.都有AlO2-生成D.都有Al3+生成
6.用铝箔包裹0.1mol金属钠,用针扎若干个小孔,放入水中,完全反应后,放出的气体体积(标准状况)为()
A.无法确定B.1.12L C.大于1.12L D.小于1.12L
7.把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质
量关系如右图,则合金中镁和铝的质量比是()
A.1:1 B. 8:9 C.4:3D.4:9
8.有关铝及其化合物的说法错误的是()
A.用于熔化烧碱的坩埚,可用Al2O3这种材料制成
B.铝能在空气中稳定存在是因为其表面覆盖着一层氧化铝薄膜
C.氧化铝是一种难熔物质,是一种较好的耐火材料 D.氢氧化铝能中和胃酸,可用于制胃药
9.下列离子方程式正确的是()
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.硫酸铝溶液中加入过量氨水:Al3++4OH-=== AlO2-+2 H2O
C.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-
D.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
10.下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是()
A.氧化镁中混有氧化铝 B.氯化铝溶液中混有氯化铁
C.氧化铁中混有二氧化硅D.氯化亚铁溶液中混有氯化铜
11.1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L-1,向混合溶液中滴加0.1 mol·L-1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是()
A.氯化铝、氯化镁、氢氧化钠B.偏铝酸钠、氢氧化钡、硫酸
C.氯化铝、氯化铁、氢氧化钠D.偏铝酸钠、氯化钡、硫酸
12.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加入到足量的下列溶液中,充分反应后放出氢气最多的是 ( )
A.3mol/L 盐酸B.8mol/LNaOH C.4mol/L HNO3 D.18mol/L H2SO4
13.下列说法不正确的是()
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成;②向某溶液中滴入盐酸酸化的BaCl2溶液产
生白色沉淀,证明溶液中一定含有SO42﹣;③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,放入水中,两者放出的氢气质量相等;④氢氧化铝具有弱碱性,可用于制胃酸中和剂。
A.只有②B.只有②③C.①②③D.①②③④
14.将少量的铝投入过量的NaOH溶液中充分反应,所得混合溶液的叙述正确的是()A.该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存
B.该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存
C.向溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图
D.向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图
15.下列各物质既能与强酸溶液反应又能与强碱溶液反应的是()
①Al ②Al2O3 ③AlCl3 ④NaAlO 2 ⑤Al(OH)3 ⑥NaHCO3 ⑦(NH4)2CO3.
A.①②⑤B.①②③④⑤C.①②⑤⑥⑦D.全部
16.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种,已知:① a、c都能与稀硫酸反应放出氢气;② b和d的硝酸盐反应,置换出单质d;③ c与强碱反应放出气体;④ c、e在冷浓硫酸中发生钝化。
由此可判断a、b、c、d、e依次是()
A.Fe Cu Al Ag Mg B.Al Cu Mg Ag Fe C.Mg Cu Al Ag Fe D.Mg Ag Al Cu Fe
17.以下物质之间的每步转化中,都能通过一步实现的是()
①Fe→FeCl2→Fe(OH)2→Fe(OH)3② Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2④ Al→Al2O3→Al(OH)3⑤ Al→NaAlO2→Na2CO3
A.②③④B.①③④⑤C.①②③⑤D.①②③④⑤
18.在加入铝粉能放出氢气的无色溶液中,分别加入下列各组离子,可能大量共存的是A.Ca2+、NO3ˉ、CO32-、Na+ B.Na+、Mg2+、HCO3ˉ、Fe3+
C.NO3ˉ、Cu2+、K+、ClˉD.NO3ˉ、K+、Ba2+、OHˉ
19.用含有少量Mg的Al片制取纯净的Al(OH)3,下列操作中最恰当的组合是()
①加盐酸溶解②加NaOH溶液③过滤④加盐酸生成Al(OH)3
⑤通入过量CO2生成Al(OH)3 ⑥加过量氨水生成Al(OH)3 。
A.②③⑤③B.①③⑥③ C.①⑥③D.②③④③
20.下列物质不能通过化合反应直接制得的是()
A.FeCl2B.NaHCO3C.Al(OH)3 D.Fe3O4
21.甲、乙两烧杯中各盛有100mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙 = 1:2,则加入铝粉的质量为()
A.5.4g B.3.6g C.2.7g D.1.8g
22.以下物质间的每步转化都可以通过一步反应能实现的是()
A.Al﹣Al2O3﹣Al(OH)3﹣NaAlO2B.Fe﹣FeO﹣Fe(OH)2﹣Fe(OH)3
C.Si﹣SiO2﹣H2SiO3﹣Na2SiO3D.Na﹣Na2O2﹣Na2CO3﹣NaOH
23.下列变化不可能通过一步实验直接完成的是()
A.Al(OH)3→ Al2O3 B.Al2O3→ Al(OH)3C.Al → AlO2-D.AlCl3→ Al(OH)3
24.若在加入铝粉能产生氢气的无色溶液中,分别加入下列各组离子,可能共存的是()A.NH4+、NO3﹣、Al3+、Cl﹣B.Na+、AlO2﹣、K+、NO3﹣
C.MnO4﹣、K+、SO42﹣、Na+ D.AlO2﹣、K+、NO3﹣、OH﹣
25.下列除杂的方法不正确的是 ( )
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+中混有的少量Al3+
C.Al(OH)3中混有少量Mg(OH)2:加入烧碱溶液,过滤,向滤液中通入过量CO2后过滤
D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤,洗涤,干燥得到MgO
26.某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:回答下列问题:
(1)写出所含物质的化学式:固体B__ ______,沉淀D___ _____。
(2)写出①、④两个反应的化学方程式:
①_____ ___
④___ _____
(3)写出②、③两个反应的离子方程式:
②_____ ___
③____ ____
(4)设计实验检验溶液F中所含溶质的阳离子:____ ____。
(5)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3︰_____ ___
Fe2O3︰____ ____
27.已知A、B、C为单质和甲、乙、丙、丁为化合物,其中A为地壳中含量最多的金属,C为密度最小的气体,可以电解熔融的甲得到金属A。
(1)写出下列物质的化学式:
A B C ;
甲乙;
丙丁.
(2)写出下列变化的方程式:
○1A与NaOH溶液反应的离子方程式
;
○2A还能与盐酸反应,离子方程式为;
○3甲与NaOH溶液反应的化学方程式;
○4甲还能与盐酸反应,化学方程式为;
○5丁受热会分解得到甲,化学方程式为;
○6丁与盐酸反应的离子方程式;
○7丁与NaOH溶液反应的离子方程式;
○8向乙中通入CO2至过量,化学方程式为。