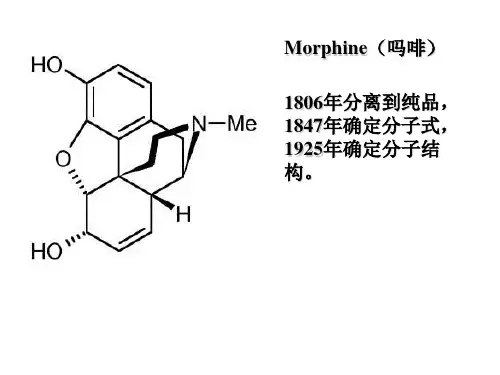
第十三章 波谱学基本知识
- 格式:ppt
- 大小:8.41 MB
- 文档页数:96

波谱分析(spectra analysis)波谱分析的内涵与外延:定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。
特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等)特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等化合物:一般为纯的有机化合物分子结构:分子中原子的连接顺序、位置;构象,空间结构仪器分析(定量),波谱分析(定性)综合性、交叉科学(化学、物理、数学、自动化、计算机)作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。
第一章紫外光谱(ultraviolet spectra,UV)一、电磁波的基本性质和分类1、波粒二象性光的三要素:波长(λ),速度(c),频率 (v)电磁波的波动性电磁波的粒子性光速 c:c=3.0×10^10 cm/s 波长λ:电磁波相邻波峰间的距离。
用 nm,μm,cm,m 等表示频率v:v=c/ λ,用 Hz 表示。
光子具有能量,其能量大小由下式决定:E = hν= hc/λ (式中E为光子的能量,h为普朗克常数,其值为6.624× 10-34j.s )2、分子的能量组成(能级图)E 分子= E平+ E转+ E振+E电子能量大小: E转< E振< E电子远紫外(4~200nm):又叫真空紫外区近紫外(200~400nm):又叫石英紫外区,最为常用。
电子跃迁类型的影响σ→σ*跃迁:150nm左右,真空紫外区n→σ*跃迁:一般小于200nm 弱吸收,ε约100 π→π*跃迁:160~180nm(孤立双键),>200nm (共轭双键)强吸收,ε约104精品文档n→π*跃迁:200~400nm 弱吸收,ε约1002.3.表示方法和常用术语发色团:广义上讲,是分子中能吸收紫外光或可见光的结构系统。

波谱分析(spectra analysis)波谱分析的内涵与外延:定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。
特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等)特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等化合物:一般为纯的有机化合物分子结构:分子中原子的连接顺序、位置;构象,空间结构仪器分析(定量),波谱分析(定性)综合性、交叉科学(化学、物理、数学、自动化、计算机)作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。
课程要求:本课将在学生学习有机化学、分析化学、物理化学等课程的基础上,系统讲授紫外光谱(UV)、红外光谱(IR)、核磁共振光谱(NMR)和质谱(MS)这四大光谱的基本原理、特征、规律及图谱解析技术,并且介绍这四大光谱解析技术的综合运用,培养学生掌握解析简单有机化合物波谱图的能力。
为学习中药化学有效成分的结构鉴定打下基础。
第一章紫外光谱(ultraviolet spectra,UV)一、电磁波的基本性质和分类1、波粒二象性光的三要素:波长(λ),速度(c),频率(v)电磁波的波动性光速c:c=3.0 x 1010 cm/s波长λ :电磁波相邻波峰间的距离。
用nm,μm,cm,m 等表示频率v:v=c/ λ,用Hz 表示。
电磁波的粒子性光子具有能量,其能量大小由下式决定:E = hν = hc/λ(式中E为光子的能量,h为普朗克常数,其值为6.624× 10-34j.s )电磁波的分类2、分子的能量组成(能级图)E 分子= E平+E转+E振+E电子能量大小:E转< E振< E电子不同能级跃迁对应的电磁波区域紫外光谱远紫外(4~200nm):又叫真空紫外区近紫外(200~400nm):又叫石英紫外区,最为常用。



1.不同物质的λmax有时可能相同,但εmax不一定相同;2.有机化合物的紫外—可见吸收光谱,是其分子中外层价电子跃迁的结果(三种):σ电子、π电子、n电子外层电子吸收紫外或可见辐射后,就从基态向激发态(反键轨道)跃迁。
主要有四种跃迁所需能量ΔΕ大小顺序为:n→π*< π→π*< n→σ*< σ→σ*3.σ→σ*跃迁所需能量最大,σ电子只有吸收远紫外光的能量才能发生跃迁。
饱和烷烃的分子吸收光谱出现在远紫外区(吸收波长λ<200nm,只能被真空紫外分光光度计检测到)。
如甲烷的λ为125nm,乙烷λmax为135nm。
n→σ*跃迁所需能量较大。
吸收波长为150~250nm,大部分在远紫外区,近紫外区仍不易观察到。
含非键电子的饱和烃衍生物(含N、O、S和卤素等杂原子)均呈现n →σ*跃迁。
如一氯甲烷、甲醇、三甲基胺n →σ*跃迁的λ分别为173nm、183nm 和227nm。
π→π*跃迁所需能量较小,吸收波长处于远紫外区的近紫外端或近紫外区,摩尔吸光系数εmax一般在104L·mol-1·cm-1以上,属于强吸收。
不饱和烃、共轭烯烃和芳香烃类均可发生该类跃迁。
如:乙烯π→π*跃迁的λ为162 nm,εmax为: 1×104 L·mol-1·cm-1。
n →π*跃迁需能量最低,吸收波长λ>200nm。
这类跃迁在跃迁选律上属于禁阻跃迁,摩尔吸光系数一般为10~100L·mol-1 ·cm-1,吸收谱带强度较弱。
分子中孤对电子和π键同时存在时发生n →π*跃迁。
丙酮n →π*跃迁的λ为275nm εmax为22 L·mol-1·cm -1(溶剂环己烷)。
4.生色团:最有用的紫外—可见光谱是由π→π*和n→π*跃迁产生的。
这两种跃迁均要求有机物分子中含有不饱和基团。
这类含有π键的不饱和基团称为生色团。