实验室制取溴苯优秀课件
- 格式:ppt
- 大小:207.00 KB
- 文档页数:9

制取溴苯和硝基苯制取溴苯需要用剧毒试剂──液溴为原料,因此不宜作为操作的实验,只要求根据反应原理设计出合理的实验方案。
下面是制取溴苯的实验方案与实验步骤:把苯和少量液态溴放在烧瓶里,同时加入少量铁屑作催化剂。
用带导管的瓶塞塞紧瓶口(跟瓶口垂直的一段导管可以兼起冷凝器的作用)。
在常温时,很快就会看到,在导管口附近出现白雾(由溴化氢遇水蒸气所形成)。
反应完毕后,向锥形瓶内的液体里滴入AgNO3溶液,有浅黄色溴化银沉淀生成。
把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有褐色不溶于水的液体。
不溶于水的液体是溴苯,它是密度比水大的无色液体,由于溶解了溴而显褐色。
注意事项:(1)装置特点:长导管;长管管口接近水面,但不接触(2)长导管的作用:导气;冷凝 [冷苯与溴](3)苯,溴,铁顺序加药品(强调:是液溴,不是溴水,苯与溴水只萃取,不反应)(4)铁粉的作用:催化(真正的催化剂是FeBr3)(5)提示观察三个现象:导管口的白雾;烧瓶中的现象;滴入硝酸银后水中生成的沉淀白雾是如何形成的?(长管口与水面位置关系为什么是这样)(6)将反应的混合物倒入水中的现象是什么?[有红褐色的油状液体沉于水底](7)溴苯的物理性质如何?[比水重,不溶于水,油状](8)如何除去溴苯中的溴?[水洗,再用10%烧碱溶液洗,再干燥,蒸馏](9)反应方程式2剧烈反应,有白雾生成,三颈烧瓶底部有褐色油状物出现,加NaOH溶液后有红褐色沉淀生成液体轻微翻腾,有气体逸出.导管口有白雾,溶液中生成浅黄色沉淀。
烧瓶底部有褐色不溶于水的液体1、如何检查装置气密性?2、冷凝管的作用?冷却水进出方向?用于导气和冷凝回流3、插入锥形瓶的长导管不伸入液面,为什么?溴化氢易溶于水,防止倒吸4、碱石灰干燥管的作用5、加NaOH作用是什么?6、能说明反应是取代反应的依据是?7、溴苯应该是无色、密度比水大的液体,但反应得到的溴苯却是褐色的液体,原因何在?能否用溴水与铁反应?(2)制取硝基苯的实验方案与实验步骤:①配制混和酸:先将1.5 mL浓硝酸注入大试管中,再慢慢注入2 mL浓硫酸,并及时摇匀和冷却。


实验探究15 溴苯的制取与提纯[教材实验原型]溴苯的制取:在FeBr3催化作用下,苯环上的氢原子被溴原子所取代生成溴苯。
溴苯是密度比水大的无色液体。
[教材实验原理]1.制取溴苯需要注意的问题:(1)实验用的是液溴而不是溴水。
(2)为减少苯和液溴的挥发,常采用长导管或冷凝管进行冷凝回流。
(3)铁粉和溴易发生反应生成FeBr3,加入的铁粉并不是催化剂,起催化作用的是FeBr3。
(4)HBr极易溶于水,在吸收HBr时要注意防止倒吸。
(5)检验HBr的生成常利用AgNO3溶液,现象是产生不溶于HNO3的淡黄色沉淀。
2.提纯净化溴苯的实验步骤如下:[命题角度探究]1.苯与液溴混合后,不加入铁粉或FeBr3,能否制得溴苯?提示:不加入催化剂时,苯与液溴反应很慢。
2.制取溴苯时,能否用溴水代替液溴?提示:不能。
苯能萃取溴水中的Br2,但不反应。
3.实验室制得的粗溴苯为什么呈红棕色?如何除去?提示:溴苯中溶有Br2而呈红棕色,用NaOH溶液洗涤即可除去Br2。
4.怎样吸收HBr气体?提示:导管末端接一个倒扣的漏斗置于水面上。
5.怎样证明苯与液溴发生的是取代反应?提示:将产生的气体通入AgNO3溶液中,产生浅黄色沉淀,说明有HBr生成,则证明苯与液溴发生了取代反应。
[典题真题体验](高考经典题)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:苯溴溴苯密度/g·cm-30.88 3.10 1.50沸点/℃80 59 156水中溶解度微溶微溶微溶按下列合成步骤回答问题:(1)在a中加入15 mL无水苯和少量铁屑。
在b中小心加入 4.0 mL液态溴。
向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。
继续滴加至液溴滴完。
装置d的作用是________________________________________________________________________。
(2)液溴滴完后,经过下列步骤分离提纯:①向a中加入10 mL水,然后过滤除去未反应的铁屑;②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。
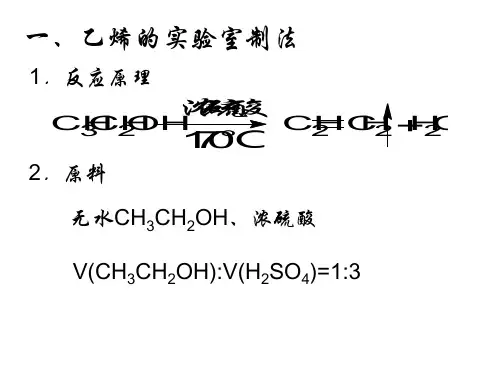

实验室制取溴苯实验室制取溴苯,这个听起来有点复杂的过程,其实并没有那么吓人。
我们先从实验背景说起。
溴苯是有机化学里一个很重要的化合物,广泛用于合成其他有机物,比如染料、农药等。
听起来是不是很有趣?一、实验准备1. 材料准备首先,你得准备好溴和苯。
苯,大家都知道,就是那种芳香的液体,溶于有机溶剂,挥发性强。
溴呢,是一种红褐色的液体,强氧化剂,别碰到皮肤,真是个“刺头”。
此外,你还需要一些催化剂,比如铁粉或者铁氯化物。
2. 器材准备接下来,器材就不能马虎。
需要圆底烧瓶、冷凝器、加热装置和搅拌器。
把这些设备都准备齐全,实验才能顺利进行。
二、实验过程1. 混合反应物首先,把苯倒进圆底烧瓶里,量要合适哦。
然后加入适量的溴。
这个时候,注意安全,最好在通风良好的地方操作。
接着,加入催化剂,这一步很关键,催化剂能加速反应,帮助溴苯的生成。
2. 加热和搅拌开火,加热烧瓶里的混合物。
温度要控制好,一般在60到70摄氏度之间。
这个过程就像做菜,火候掌握得好,菜才能美味。
反应过程中要不断搅拌,让混合物均匀加热。
反应时间大约需要半小时。
3. 观察变化在加热和搅拌的过程中,注意观察混合物的变化。
溴的红褐色会逐渐变浅,说明反应在进行中。
这时可以偷偷期待,心里也会有些小激动。
三、分离和纯化1. 冷却反应完成后,先关火,让烧瓶冷却。
冷却的过程,心里也松了一口气,成功的希望越来越大。
2. 提取然后,利用分液漏斗将生成的溴苯分离出来。
要小心,尽量不让其他杂质混进去。
分离后可以用水洗涤几次,这样能去除残留的催化剂和其他杂质。
3. 蒸馏最后一步,进行蒸馏。
蒸馏能进一步提纯溴苯。
收集到的液体就是我们要的溴苯了。
看着那清澈的液体,心里满是成就感。
四、总结通过这个实验,我们成功制取了溴苯,虽然过程有点繁琐,但每一步都充满了乐趣。
实验不仅仅是技术上的挑战,更是对耐心和细心的考验。
每当看到那些漂亮的实验器材,心里就像开了花一样,仿佛在进行一场小小的化学魔法。


实验室制取溴苯实验目的:本实验旨在通过合成反应,制备出溴苯。
实验原理:溴苯是由苯与溴化亚铁(FeBr3)催化剂进行加成反应制备的。
催化剂会使芳香体系的电子云密度减小,从而提高其电子亲合性。
实验步骤:步骤一:准备实验装置和试剂1. 准备一个干净无水的圆底烧瓶,装入苯(C6H6)和溴化亚铁(FeBr3)催化剂。
2. 准备一只分液漏斗,并在漏斗颈处插入一根游离管。
3. 准备一只带有冷却器的接收瓶,用于收集溴苯产物。
步骤二:反应操作1. 将装有苯和溴化亚铁催化剂的圆底烧瓶连接至分液漏斗,游离管的另一端插入接收瓶。
2. 缓慢滴加溴素(Br2)至分液漏斗,注意滴加速度要适中,以保证反应进行顺利。
滴加速度过快可能导致副反应的发生。
3. 在反应过程中,观察溴素的颜色变化以及反应液的温度变化。
反应结束后,停止滴加。
步骤三:产物提取1. 分离接收瓶中的有机相和无机相。
有机相为溴苯产物,无机相中含有FeBr3催化剂和未反应的溴素。
2. 将有机相倒入干净的干燥漏斗中,用无水氯化钠(NaCl)干燥有机相。
干燥后的溴苯即可得到。
步骤四:纯化溴苯1. 将溴苯再次蒸馏,用以去除残余的杂质。
2. 将纯净的溴苯收集于干净无水的容器中,即可获得制取的溴苯。
实验注意事项:1. 实验操作时要佩戴化学防护手套、实验服、护目镜等安全设备,确保人身安全。
2. 实验条件下,溴素具有刺激性气味和腐蚀性,需要避免直接接触皮肤和呼吸。
实验室应保持通风良好。
3. 操作过程中,需要注意滴加速度,过快的滴加速度可能导致危险情况的发生。
4. 实验结束后,对产生的废液和残留物进行妥善处理,避免对环境造成污染。
实验结果与讨论:通过以上实验操作步骤,制备出了溴苯。
在实验过程中,反应液的颜色和温度发生了变化,说明了反应的进行。
通过溴苯的蒸馏纯化,可以得到纯净的溴苯产物。
总结:本实验通过合成反应,成功制备了溴苯。
溴苯是一种有机溴化合物,常用于有机合成的中间体和溶剂。
通过实验,进一步了解了有机合成实验的操作步骤和注意事项,培养了实验操作的技能和安全意识。


1.药品:苯、液溴、铁屑、水
2.装置:圆底烧瓶、锥形瓶、铁架台、导管、单孔塞
3.步骤:
(1)检验气密性。
在圆底烧瓶内放入铁屑。
(2)将苯和液溴加入圆底烧瓶中,并向其中加入铁屑
(3)经振荡后按下列装置组合
(4)反应后将具支试管里的液体倒入盛有氢氧化钠的溶液
的烧杯里
4.反应原理:
5. 导管出口附近能发现的现象是
6.注意点:
(1)催化剂是
(2)插入锥形瓶中的导管不伸入液面下,其原因
(3)反应生成粗溴苯是颜色,原因,
(4)怎样提纯
①倒入氢氧化钠溶液中,其目的是,②分液,③蒸馏(先逸出的是苯)
(5)烧瓶中连有一个长导管,其作用是,
迁移应用
某化学课外小组用如下图装置制取溴苯。
先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)观察到A中的现象是。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是
,写出有关反应的化学方程式。
(3)C中盛放CCl4的作用是。
(4)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。
另一种验证的方法是向试管D中加入
,现象是。
答案 (1)反应液微沸,有红棕色气体充满A容器
(2)除去溶于溴苯中的溴
Br2+2NaOH=NaBr+NaBrO+H2O(或 3Br2+6NaOH5NaBr+NaBrO3+3H2O)
(3)除去溴化氢气体中的溴蒸气;(4)石蕊试液溶液变红色。

溴苯的制取溴苯是一种有机化合物,化学式为C6H5Br,是由苯环上的一个氢原子被溴原子取代而得到的。
溴苯是一种无色液体,在室温下挥发性较低。
它常用作有机合成的重要原料和溶剂。
溴苯的制备方法有多种,下面将介绍其中的一种常用方法。
溴苯的制备可以通过苯与溴的反应来实现。
具体的反应方程式如下所示:苯 + 溴→ 溴苯 + 氢溴酸在实际制备中,通常会在反应过程中加入一些催化剂,以加快反应速率。
常用的催化剂有铁、铝等。
制备溴苯的实验步骤如下:在一个反应容器中加入适量的苯和溴。
为了控制反应的温度,可以使用冷却器将反应容器冷却。
然后,将催化剂加入到反应容器中,轻轻搅拌使催化剂均匀分散在溶液中。
随着反应的进行,可以观察到溶液的颜色发生变化,由无色变为棕黄色。
这是溴苯生成的表现。
反应完成后,可以将反应产物分离。
一种常用的分离方法是使用分液漏斗,将产物与废液分离。
溴苯的密度较低,可以被分离到有机相中。
废液中则主要含有氢溴酸等。
可以通过进一步的处理和纯化得到纯度较高的溴苯。
常见的纯化方法有蒸馏和结晶等。
溴苯具有较多的应用领域。
首先,它是一种重要的有机合成原料。
溴苯可以被用于制备其他有机化合物,如溴代苯甲酸、溴代苯醇等。
这些化合物在医药、染料、农药等领域具有广泛的应用。
溴苯还可以作为溶剂使用。
它在有机合成反应中可以作为溶剂来促进反应的进行。
同时,溴苯也可以作为萃取剂和萃取溶剂使用,用于分离和提取其他有机化合物。
溴苯是一种常用的有机化合物,可以通过苯与溴的反应制备而得。
它在有机合成和溶剂领域都具有重要的应用价值。
溴苯的制备方法多样,可以根据具体需求选择适合的方法进行制备。
同时,在操作过程中需要注意安全,避免接触到高浓度的溴苯,以免对人体造成伤害。

实验室制取溴苯-资料类关键信息项:1、实验目的:制取溴苯2、实验原理:苯与液溴在铁作催化剂的条件下发生取代反应生成溴苯3、实验仪器与试剂:仪器包括圆底烧瓶、分液漏斗、锥形瓶、导管等;试剂有苯、液溴、铁粉、蒸馏水等4、实验步骤:包括加料、反应、分离提纯等具体操作5、注意事项:如防止溴蒸气挥发、处理尾气等6、实验安全措施:防火、防爆、防中毒等7、产物检验方法:通过化学方法检验生成的溴苯8、实验废弃物处理方式11 实验目的本实验旨在通过化学方法,利用苯与液溴的反应制取溴苯,使实验者深入理解有机化学反应的原理和操作过程。
111 实验原理苯与液溴在铁作催化剂的条件下发生取代反应,生成溴苯和溴化氢。
化学反应方程式为:C₆H₆+ Br₂——(Fe)→ C₆H₅Br + HBr12 实验仪器与试剂121 实验仪器圆底烧瓶、分液漏斗、锥形瓶、导管、铁架台、石棉网、酒精灯、温度计、冷凝管等。
122 实验试剂苯、液溴、铁粉、蒸馏水、氢氧化钠溶液、无水氯化钙。
13 实验步骤131 加料在圆底烧瓶中加入一定量的苯,然后通过分液漏斗缓慢加入液溴,边加边振荡,使反应物充分混合。
再加入少量铁粉。
132 反应安装好实验装置,在石棉网上用酒精灯加热,使反应进行。
控制反应温度在适宜范围内,观察反应现象。
133 分离提纯反应结束后,将反应混合物倒入盛有冷水的烧杯中,使产物溴苯冷却结晶。
然后进行分液操作,分离出有机相。
134 洗涤用氢氧化钠溶液洗涤有机相,以除去未反应的溴和溴化氢。
再用蒸馏水洗涤至中性。
135 干燥加入无水氯化钙干燥有机相。
136 蒸馏通过蒸馏操作,收集纯净的溴苯。
14 注意事项141 液溴具有强腐蚀性和挥发性,操作时应在通风橱中进行,并佩戴防护手套和护目镜。
142 反应过程中产生的溴化氢气体有毒,要做好尾气处理,防止其逸散到空气中。
143 控制反应温度,避免温度过高导致副反应发生。
144 加入铁粉时要少量,过多的铁粉可能会导致副反应增多。
实验室制取溴苯
1.药品:苯、液溴、铁粉、蒸馏水
2.装置:圆底烧瓶、锥形瓶、铁架台、导管、单孔塞
3.步骤:
(1)检验气密性。
在圆底烧瓶内放入铁屑。
(2)将苯和液溴加入圆底烧瓶中,并向其中加入铁屑(3)?经振荡后按下列装置组合
(4)反应后将具支试管里的液体倒入盛有氢氧化钠的溶液的烧杯里
4.反应原理:
5. 导管出口附近能发现的现象是产生白雾
6.注意点:
(1)催化剂是FeBr3
(2)插入锥形瓶中的导管不伸入液面下,其原因防止倒吸(3)反应生成粗溴苯是红棕色颜色,原因含有少量溴单质,(4)怎样提纯
1、水洗除去溴化铁,氢溴酸
2、NaOH洗涤除去溴单质
3、水洗除去NaOH等无机物
4、分液、干燥除去水分
5、蒸馏除去苯
(5)烧瓶中连有一个长导管,其作用是导气、冷凝。