沪教版初中化学方程式(上册)整理
- 格式:doc
- 大小:48.50 KB
- 文档页数:1

化学方程式默写
碳酸氢铵受热分解:
碱式碳酸铜受热分解:
碱式碳酸铜和盐酸反应:
磷在氧气中燃烧:
木炭在氧气中完全燃烧:
铁丝在氧气中燃烧:
木炭在氧气中不完全燃烧:
硫磺在氧气中燃烧:
氢气在空气中燃烧:
镁条在空气中燃烧:
实验室用高锰酸钾制取氧气:
实验室用双氧水和二氧化锰制取氧气:
实验室用氯酸钾和二氧化锰制取氧气:
实验室用大理石和稀盐酸制取二氧化碳:
二氧化碳能使澄清石灰水变浑浊:
二氧化碳与水反应:
光合作用:
碳酸受热分解:
水通电分解:
铝和硫酸反应:
镁和硫酸反应:
铁和硫酸反应:
锌和硫酸反应:
铝和盐酸反应:
镁和盐酸反应:
铁和盐酸反应:
锌和盐酸反应:
铁和硫酸铜反应:
铝和硫酸铜反应:
一氧化碳还原氧化铁:
一氧化碳在氧气中燃烧:
一氧化碳还原氧化铜:
氢气还原氧化铜:
木炭还原氧化铜:
一氧化碳在氧气中燃烧:
甲烷在氧气中燃烧:。

1沪教版初中化学上册全册化学方程式总结一、几种物质在空气或氧气中燃烧: 1、★铁丝燃烧: 3Fe + 2O 2 ==== Fe 3O 4 (化合) 2、▲镁条燃烧: 2Mg + O 2 ==== 2MgO (化合) 3、▲红磷燃烧: 4P + 5O 2 === 2P 2O 5(化合) 4、木炭燃烧: C + O 2 === CO 2(完全燃烧)(化合) 2C + O 2 ==== 2CO (不完全燃烧) 5、▲氢气燃烧: 2H 2 + O 2 === 2H 2O (化合反应)6、硫燃烧: S + O 2 === SO 2(化合反应)7、铜丝加热及生锈: 2Cu + O 2 === 2CuO ;(化合反应)8、▲铝丝加热或形成氧化膜:4Al + 3O 2 === 2Al 2O 3(化合反应)9、二氧化碳被碳还原: C + CO 2 === 2CO (化合反应) 10、▲ 一氧化碳燃烧 2CO + O 2 ==== 2 CO 2(化合反应)二、制氧气的3个反应:1、★加热高锰酸钾制氧气:高锰酸钾−−→−加热锰酸钾 +二氧化锰+氧气 2KMnO 4===K 2MnO 4 +MnO 2 +O 2 ↑(分解) 2、★双氧水在二氧化锰作催化剂的条件下制氧气:过氧化氢−−−→−二氧化锰水 + 氧气 2H 2O 2 2H 2O + O 2↑(分解反应) 3、氯酸钾和二氧化锰加热制氧气:二氧化锰 氯酸钾 ————→ 氯化钾 + 氧气 2KClO 3 2KCl +3 O 2 ↑ (分解反应) 加热三、有关二氧化碳的反应:1、★二氧化碳的实验室制法:碳酸钙+盐酸→氯化钙+二氧化碳+水 CaCO 3 + 2HCl= CaCl 2 + CO 2 ↑+ H 2O2、★二氧化碳和水反应:二氧化碳 + 水 —→ 碳酸 CO 2 + H 2O == H 2CO 3(化合反应)3、加热碳酸的反应:碳酸−−→−加热二氧化碳 + 水 H 2CO 3 === CO 2 ↑ + H 2O (分解反应)4、★二氧化碳和澄清石灰水反应; 即二氧化碳气体的检验:二氧化碳 + 氢氧化钙 → 碳酸钙 + 水 CO 2 + Ca(OH)2 == CaCO 3 ↓+ H 2O5、 ★二氧化碳和氢氧化钠溶液反应; 即氢氧化钠变质的原因 点燃 高温点燃 点燃 点燃 点燃 点燃 点燃 点燃△MnO 2 === MnO 2 === △ △ △2CO 2 +2NaOH == Na 2CO 3 + H 2O四、置换反应:1.镁与盐酸、硫酸反应制氢气:Mg + 2HCl == MgCl 2 + H 2↑;Mg + H 2SO 4 == MgSO 4 + H 2↑2.★铁与盐酸、硫酸反应制氢气:Fe + 2HCl == FeCl 2 + H 2↑Fe + H 2SO 4 == FeSO 4 + H 2↑3.锌与盐酸、硫酸反应制氢气:Zn + 2HCl == ZnCl 2 + H 2↑;★实验室制取氢气 Zn + H 2SO 4 == ZnSO 4 + H 2↑4.铝与盐酸、硫酸反应制氢气:2Al + 6HCl == 2AlCl 3 + 3H 2↑;2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑5.★湿法炼铜法,铁与硫酸铜溶液反应:Fe + CuSO 4 == FeSO 4 + Cu五、复分解反应:1.酸碱中和反应:HCl + NaOH == NaCl + H 2O ;2.金属氧化物与酸溶液反应:Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O ; Fe 2O 3 + 3H 2SO 4 ==Fe 2(SO 4)3 + 3H 2O3.碳酸盐与酸溶液反应:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O Na 2CO 3 + 2HCl == 2NaCl+ CO 2↑+ H 2O4.盐溶液与碱溶液反应:Na 2CO 3 + Ca(OH)2 == CaCO 3↓+ 2NaOH ; CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 4 CuSO 4 + Ca(OH)2 == CaSO 4+ Cu(OH)2↓5.纯碱与氯化钙溶液反应:Na 2CO 3 + CaCl 2 == CaCO 3↓+ 2NaCl6.铵盐与碱反应产生氨气:NH 4NO 3 + NaOH NaNO 3 + NH 3↑+ H 2O (NH 4)2SO 4 + Ca(OH)2 CaSO 4 + 2NH 3↑+ 2H 2O六、其他反应类型:1、 水−−→−通电氢气+氧气 2H 2O 2H 2↑+ O 2↑(分解反应)2、★一氧化碳还原氧化铁: Fe 2O 3 + 3CO 2Fe + 3CO 2 ;一氧化碳还原四氧化三铁 Fe 3O 4 + 4CO 3Fe + 4CO 2; 一氧化碳还原氧化铜: CuO + CO Cu + CO 2 3、碳酸钙高温煅烧分解:CaCO 3 CaO + CO 2↑(分解反应)4、生石灰溶于水:CaO + H 2O == Ca(OH)2(化合反应)5、金属镁与二氧化碳反应:2Mg + CO 2 ==== 2MgO + C (置换反应)6、甲烷燃烧 CH 4 +2 O 2 ==== CO 2 +2H 2O7.绿色植物光合作用:6CO 2 + 6H 2O C 6H 12O 6 + 6O 2 高温 === △== 叶绿素△ == 酶 == 高温 === 点燃 点燃 高温 ===光照 === 通电 === 高温 ===8. 呼吸作用:C6H12O6 + 6O26CO2 + 6H2O3。
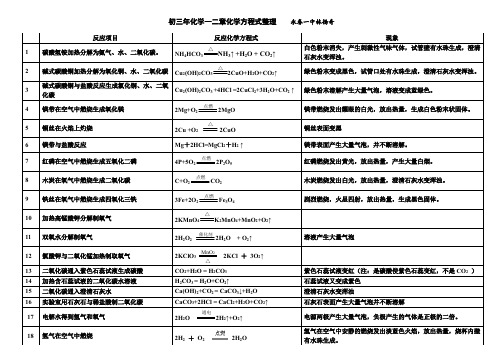
初三年化学一二章化学方程式整理永春一中林扬奇反应项目反应化学方程式现象1碳酸氢铵加热分解为氨气、水、二氧化碳。
NH4HCO3NH3↑ +H2O + CO2↑白色粉末消失,产生刺激性气味气体,试管壁有水珠生成,澄清石灰水变浑浊。
2碱式碳酸铜加热分解为氧化铜、水、二氧化碳Cu2(OH)2CO32CuO+H2O+CO2↑绿色粉末变成黑色,试管口处有水珠生成,澄清石灰水变浑浊。
3碱式碳酸铜与盐酸反应生成氯化铜、水、二氧化碳Cu2(OH)2CO3 +4HCl =2CuCl2+3H2O+CO2 ↑绿色粉末溶解产生大量气泡,溶液变成蓝绿色。
4镁带在空气中燃烧生成氧化镁2Mg+O22MgO镁带燃烧发出耀眼的白光,放出热量,生成白色粉末状固体。
5铜丝在火焰上灼烧2Cu +O22CuO铜丝表面变黑6镁带与盐酸反应Mg+2HCl=MgCl2+H2↑镁带表面产生大量气泡,并不断溶解。
7红磷在空气中燃烧生成五氧化二磷4P+5O22P2O5红磷燃烧发出黄光,放出热量,产生大量白烟。
8木炭在氧气中燃烧生成二氧化碳C+O2CO2木炭燃烧发出白光,放出热量,澄清石灰水变浑浊。
9铁丝在氧气中燃烧生成四氧化三铁3Fe+2O2Fe3O4剧烈燃烧,火星四射,放出热量,生成黑色固体。
10加热高锰酸钾分解制氧气2KMnO4K2MnO4+MnO2+O2↑11双氧水分解制氧气2H2O22H2O + O2↑溶液产生大量气泡12氯酸钾与二氧化锰加热制取氧气2KClO32KCl +3O2↑13二氧化碳通入紫色石蕊试液生成碳酸CO2+H2O = H2CO3紫色石蕊试液变红(注:是碳酸使紫色石蕊变红,不是CO2)14加热含石蕊试液的二氧化碳水溶液H2CO3 = H2O+CO2↑石蕊试液又变成紫色15二氧化碳通入澄清石灰水Ca(OH)2+CO2 = CaCO3↓+H2O澄清石灰水变浑浊16实验室用石灰石与稀盐酸制二氧化碳CaCO3+2HCl = CaCl2+H2O+CO2↑石灰石表面产生大量气泡并不断溶解17电解水得到氢气和氧气2H2O 2H2↑+O2↑电源两极产生大量气泡,负极产生的气体是正极的二倍。


九年级化学上册沪教版化学方程式小结Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】九年级化学上册(沪教版)化学方程式整理小结1、碳酸氢铵受热分解:NH4HCO3△NH3↑+ CO2↑+ H2O2、碱式碳酸铜(铜绿受热分解):Cu2(OH)2CO3△2CuO+ CO2↑+ H2O3、镁带在空气中燃烧:2Mg + O2点燃 2MgO4、铁丝在氧气中燃烧:3Fe + 2O2点燃 Fe3O45、磷在空气中燃烧: 4P + 5O2点燃 2P2O56、加热高锰酸钾制取氧气:2KMnO4△K2MnO4+ MnO2+ O2↑7、二氧化锰催化双氧水制氧气:2H2O2MnO2 2H2O+ O2↑8、加热氯酸钾制取氧气:2KClO3MnO2 2KCl + 3O2↑9、二氧化碳溶于水CO2 + H2O === H2CO310、碳酸不稳定易分解H2CO3△CO2↑+H2O11、实验室制取二氧化碳:CaCO3+2HCl==CaCl2+H2O+CO2↑12、二氧化碳通入澄清石灰水:CO2 +C a(O H)2==CaCO3↓+ H2O13、电解水:2H2O 通电 2H2↑+ O2↑14、氢气燃烧或爆炸: 2H2 + O2点燃2H2O15、碳的不完全燃烧: 2C + O2点燃2CO16、碳的完全燃烧:C + O2点燃 CO217、一氧化碳在空气中燃烧 2CO + O2点燃 2CO218、氢氧化钠与硫酸铜反应 Ca(OH)2+ CuSO4==CaSO4+ Cu(OH)2↓19.、铜丝在空气中加热: 2Cu + O2△ 2CuO20.、铝丝在常温时形成氧化膜:4Al+ 3O2 ==2Al2O321、镁与硫酸反应:Mg+H2SO4==MgSO4+H2↑22.、镁与盐酸反应: Mg+2HCl==MgCl2+H2↑23.、铝与盐酸反应:2Al+6HCl==2AlCl3+3H2↑?24.、铝与硫酸反应:2Al+3H2SO4==Al2(SO4)3+3H2↑25、铁与盐酸反应制氢气: Fe + 2HCl==FeCl2 + H2↑26、铁与硫酸反应制氢气: Fe+H2SO4==FeSO4+H2↑27.、锌与盐酸反应制氢气(实验室制取氢气): Zn + H2SO4==ZnSO4+ H2↑28.、湿法炼铜法:Fe+CuSO4==Cu+FeSO429、工业炼铁的原理(以赤铁矿为例):3CO+ Fe2O3高温2Fe + 3CO2。

九年级上化学(沪教版)化学方程式(上册)整理小结888班级 姓名一.化合反应1.镁带在空气或氧气中燃烧: 2Mg + O 2点燃 2MgO(氧化镁) 2.铁丝在氧气中燃烧: 3Fe + 2O 2点燃 Fe 3O 4 (四氧化三铁) 3.铜丝加热变黑: 2Cu + O 22CuO (氧化铜)4. 铜丝生铜绿: 2Cu + O 2 + H 2O + CO 2 = Cu 2(OH)2CO 3(碱式碳酸铜) 5.铝丝加热形成氧化膜:4Al + 3O 22Al 2O 3(氧化铝)6.氢气燃烧或爆炸: 2H 2 + O 2点燃 2H 2O 7.碳的燃烧:2C + O 2点燃 2CO (氧气不足);C + O 2点燃CO 2 (氧气充足)8.硫在空气中燃烧:S + O 2点燃 SO 29.磷在空气中燃烧:4P + 5O 2点燃 2P 2O 5(五氧化二磷) 10.二氧化碳被碳还原:C + CO 2高温2CO11.生石灰溶于水:CaO + H 2O = Ca(OH)2(氢氧化钙、熟石灰) 12.二氧化碳跟水反应:CO 2 + H 2O = H 2CO 3(碳酸) 13.二氧化硫跟水反应:SO 2 + H 2O =H 2SO 3(亚硫酸) 15.三氧化硫跟水反应:SO 3 + H 2O = H 2SO 4(硫酸)16.工业上制盐酸(氢气在氯气中燃烧):H 2 + Cl 2点燃 2HCl 17.金属钠在氯气中燃烧:2Na + Cl 2点燃2NaCl 二.分解反应1.碳酸氢铵(碳铵)受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O2.碱式碳酸铜(铜绿受热分解):Cu 2(OH)2CO 3 2CuO + H 2O + CO 2↑3.实验室加热高锰酸钾制氧气:2KMnO 4K 2MnO 4(锰酸钾) + MnO 2 + O 2↑4 实验室加热氯酸钾和二氧化锰的混合物制取氧气2KClO 32MnO 2KCl (氯化钾)+3O 2↑5. 实验室用 过氧化氢(双氧水)制取氧气:2H 2O 2 2H 2O + O 2↑6.电解水:2H 2O 2MnO 2H 2↑+ O 2↑ 7.碳酸分解:H 2CO 3CO 2↑+ H 2O8.石灰石(主要成分碳酸钙)高温煅烧分解:CaCO 3高温CaO + CO 2↑MnO 2 ===三.置换反应1 氢气还原金属氧化物:Fe2O3(氧化铁) + 3H2高温 2Fe + 3H2O;Fe3O4(四氧化三铁)) + 4H2高温 3Fe + 4H2O; CuO(氧化铜)+ H2 Cu + H2O 2.碳粉还原金属氧化物:2Fe2O3 + 3C高温 4Fe + 3CO2↑;Fe3O4 + 2C高温3Fe + 2CO2↑; 2CuO + C 高温 2Cu + CO2↑4 铝与盐酸、硫酸反应制氢气 2Al + 6HCl(盐酸) = 2AlCl3(氯化铝)+ 3H2↑2Al + 3H2SO4(硫酸) = Al2(SO4)3(硫酸铝) + 3H2↑5.镁与盐酸、硫酸反应制氢气: Mg + 2HCl = MgCl2(氯化镁) + H2↑;Mg + H2SO4(硫酸)= MgSO4(硫酸镁) + H2↑6.铁与盐酸、硫酸反应制氢气 Fe + 2HCl = FeCl2(氯化亚铁)+ H2↑;Fe + H2SO4 = FeSO4(硫酸亚铁)+ H2↑7.实验室用锌与盐酸、硫酸反应制氢气: Zn + 2HCl = ZnCl2(氯化锌) + H2↑;Zn + H2SO4 = ZnSO4(硫酸锌) + H2↑8.湿法炼铜法,铁与硫酸铜溶液反应:Fe + CuSO4 = FeSO4(硫酸亚铁) + Cu 9.铜与硝酸银溶液反应: Cu + 2AgNO3= Cu(NO3)2(硝酸铜)+ 2Ag 五.其他反应类型:1.一氧化碳还原氧化铁:Fe2O3(氧化铁) + 3CO 高温 2Fe + 3CO2;2. 一氧化碳还原四氧化三铁:Fe3O4 + 4CO 高温 3Fe + 4CO2;3. 一氧化碳还原氧化铜:CuO + CO 高温 Cu + CO24.天然气或沼气(主要成分是甲烷)在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O;5.酒精在空气中燃烧: C2H5OH + 3O2点燃 2CO2 + 3H2O6. 二氧化碳通入澄清石灰水中CO2 + Ca(OH)2 == CaCO3↓(碳酸钙)+ H2O;7. 硫酸铜跟氢氧化钠反应CuSO4 + 2NaOH== Cu(OH)2↓(氢氧化铜)+Na2SO4(硫酸钠)8. 实验室用石灰石(或大理石)与稀盐酸制二氧化碳CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O;9、盐酸与碳酸钠溶液反应 Na2CO3 +2HCl==2NaCl+ CO2↑ + H2O。
沪教版九年级化学上册化学方程式(烟雨朦胧整理)九年级化学上册(沪教版)化学方程式整理小结1、碳酸氢铵受热分解:NH4HCO3△NH3↑+ CO2↑+ H2O2、碱式碳酸铜(铜绿受热分解):Cu2(OH)2CO3△2CuO+ CO2↑+ H2O3、镁带在空气中燃烧:2Mg + O2点燃2MgO4、铁丝在氧气中燃烧:3Fe + 2O2点燃Fe3O45、磷在空气中燃烧:4P + 5O2点燃2P2O56、加热高锰酸钾制取氧气:2KMnO4△K2MnO4 + MnO2 + O2↑7、二氧化锰催化双氧水制氧气:2H2O2MnO2 2H2O+ O2↑8、加热氯酸钾制取氧气:2KClO3MnO2 2KCl + 3O2↑9、二氧化碳溶于水CO2 + H2O === H2CO310、碳酸不稳定易分解H2CO3 △CO2↑+H2O11、实验室制取二氧化碳:CaCO3+2HCl==CaCl2+H2O+CO2↑12、二氧化碳通入澄清石灰水:CO2 +C a(O H)2 ==CaCO3↓+ H2O13、电解水:2H2O 通电2H2↑+ O2 ↑14、氢气燃烧或爆炸:2H2 + O2点燃2H2O15、碳的不完全燃烧:2C + O2点燃2CO16、碳的完全燃烧:C + O2点燃CO217、一氧化碳在空气中燃烧2CO + O2点燃2CO218、氢氧化钠与硫酸铜反应Ca(OH)2+ CuSO4 ==CaSO4+ Cu(OH)2↓19.、铜丝在空气中加热:2Cu + O2△2CuO20.、铝丝在常温时形成氧化膜:4Al+ 3O2==2Al2O321、镁与硫酸反应:Mg+H2SO4==MgSO4+H2↑22.、镁与盐酸反应:Mg+2HCl==MgCl2+H2↑23.、铝与盐酸反应:2Al+6HCl==2AlCl3+3H2↑24.、铝与硫酸反应:2Al+3H2SO4==Al2(SO4)3+3H2↑25、铁与盐酸反应制氢气:Fe + 2HCl==FeCl2 + H2↑26、铁与硫酸反应制氢气:Fe+H2SO4==FeSO4+H2↑27.、锌与盐酸反应制氢气(实验室制取氢气):Zn + H2SO4 ==ZnSO4 + H2↑28.、湿法炼铜法:Fe+CuSO4==Cu+FeSO429、工业炼铁的原理(以赤铁矿为例):3CO+ Fe2O3高温2Fe + 3CO2。
课题沪教版九年级化学上册知识点整理学情分析九年级化学上册知识多为基础,中考考察以中等难度题为主教学目标考点分析熟练掌握相关化学式、反应方程式的应用;理解氧气、二氧化碳、金属矿物性质;了解化学变化实质,熟练掌握化学语言教学重点化学式、化学方程式等;金属非金属性质等教学方法面授法、归纳总结法学习内容与过程第一章开启化学之门1.物理变化:没有新物质生成的变化(物质仅是形状、状态改变)化学变化:有新物质生成的变化物理性质:颜色、状态、密度、熔沸点、硬度、气味、导电性等化学性质:通过化学变化表现出来的性质。
如:可燃性、毒性等【性质是物质固有的属性,描述性质用词:能、是、有、可以、会等。
性质决定物质能否发生某种变化。
变化是正在发生或已经发生的事件,体现了物质有何性质】下列各组变化中,前者属于物理变化,后者属于化学变化的是()A.铁丝生锈,轮胎爆炸B.灯泡发光,食物腐烂C.烧制陶瓷,红磷燃烧D.玻璃碎裂,工业制氧气下列物质的性质属于物理性质的是()A.木炭的可燃性B.汽油的挥发性C.氧气的氧化性D.碳酸氢铵的不稳定性2.空气中氧气的含量按右图组装仪器,关闭止水夹,通电使红磷燃烧。
(1)燃烧的现象是 ; (2)红磷不足,对实验结果的影响是 ; 若反应后立即松开止水夹,对测定结果(3)化学方程式 (4)空气中,氧气约占总体积的 ,氮气约占 第二章 身边的化学1. 电解水 2H2O ==== 2H2↑ + O2 ↑ (负氢正氧二比一) 活性炭:吸附作用 明矾:沉降作用 过滤:固液分离用肥皂水区分软、硬水; 煮沸、蒸馏可降低水的硬度 2. O2物理性质:密度比 , 溶于水O2化学性质:很活泼,有 性,物质与氧气的反应称为氧化反应 C + O2 === CO2 2H2 + O2 === 2H2O S + O2 === SO2(刺激性气味、有毒气体,大气污染物) 2Mg + O2 === 2MgO (在空气中剧烈燃烧,发出耀眼白光,生成白色固体) 3Fe + 2O2 === Fe3O4 (在氧气中剧烈燃烧,火星四射,生成黑色固体) 4Al + 3O2 === 2Al2O3 2Cu + O2 === 2CuO (黑色固体) 物理性质:密度 , 溶于水,固态CO2俗称 CO2化学性质:H2O + CO2 === H2CO3 (CO2 使紫色石蕊试液变红) Ca(OH)2 + CO2 === CaCO3 ↓+ H2O (用石灰水检验CO2)点燃通电点燃点燃点燃点燃点燃加热CO2用途:人工降雨 、 制碳酸饮料 、 灭火(不可燃、不助燃,密度比空气大)氧气的实验室制法 药品 高锰酸钾(紫黑色固体) 双氧水、二氧化锰(黑色固体) 反应2KMnO4 === K2MnO4 + MnO2 + O2 ↑2H2O2 === 2H2O + O2 ↑发生 装置酒精灯、试管、铁架台长颈漏斗或分液漏斗、锥形瓶收集 装置 集气瓶、水槽法 向上排空气法操作 要点查气密性 导管放入水中,双手握住试管,导管口有气泡,不漏气关闭止水夹,向长颈漏斗加水,水不持续流下,不漏气收集有大量、连续气泡产生时开始收集,集气瓶外有气泡产生,收集满将带火星木条放到集气瓶口,木条复燃,集满其它棉花作用:防止KMnO4 粉末进入导管分液漏斗优点:能控制反应速度实验结束后,先将导管移出水面,后熄灭酒精灯,防止水倒吸进试管长颈漏斗下端要伸入液面以下,防止气体从长颈漏斗跑出 催化剂特点:1. 2. 3.验证O2 将带火星木条伸入集气瓶中,木条复燃,是氧气CO2实验室制法加热MnO 2药品石灰石或大理石、稀盐酸反应CaCO3 + 2HCl === CaCl2 + H2O + CO2 ↑发生装置长颈漏斗或分液漏斗、锥形瓶收集装置向上排空气法将燃着的木条放在集气瓶口,木条熄灭,集满第三章物质构成的奥秘1、化学符号中数字的含义左边:分子、原子、离子的个数右上:阴、阳离子所带电荷数上边:(化合物中)元素的化合右下:1个分子中含原子的个数1个氢原子2个氧原子1个双氧水分子2个氮气分子3个氯离子1个铝离子2个硫酸根离子n个氢氧根离子五氧化二磷中磷元素是正五价双氧水中氧元素是负一价2、写出下列元素、原子团的符号,并标出化合价化合价Na Cl OH Cu Fe Fe SO4离子符号Na + Cl - OH - C2+ Fe 2+ Fe 3+ SO4 2-氢钠钾银钙镁钡锌氯氧铜铝铁碳硫氮磷锰锡汞氢氧根硝酸根碳酸根硫酸根铵根3、根据化合价写化合物化学式的步骤第1步:正价元素符号写在左面,负价元素符号写在右面,并标出化合价原子团(..根)要加括号第2步:将化合价数字前后交换,写在元素符号右下角第3步:右下角数字约分成最简比,数字‘1 ’省略不写原子团个数为‘1 ’,一定要去掉括号4、化合物的命名规则某化某(化合物中含两种元素)氢氧化某(化合物中含氢氧根OH )某酸某(化合物中含硝酸根NO3、碳酸根CO3 、硫酸SO4等)某酸(HNO3 、H2CO3 、H2SO4 )酸→氯化氢HCl 硝酸HNO3碳酸H2CO3硫酸H2SO4过氧化氢H2O2 氢氧化钠NaOH氯化钠NaCl硝酸钠NaNO3碳酸钠Na2CO3硫酸钠Na2SO4二氧化锰MnO2 氢氧化钾KOH氯化钾KCl硝酸钾KNO3碳酸钾K2CO3硫酸钾K2SO4四氧化三铁Fe3O4 氯化银AgCl硝酸银AgNO3五氧化二磷P2O5氯化铵NH4Cl硝酸铵NH4NO3碳酸铵(NH4)2CO3硫酸铵(NH4)2SO4氧化钙CaO 氢氧化钙Ca(OH)2氯化钙CaCl2硝酸钙Ca(NO3)2碳酸钙CaCO3硫酸钙CaSO4氧化镁氢氧化镁氯化镁硝酸镁碳酸镁硫酸镁MgO Mg(OH)2 MgCl2 Mg(NO3)2 MgCO3 MgSO4氢氧化钡Ba(OH)2 氯化钡BaCl2硝酸钡Ba(NO3)2碳酸钡BaCO3硫酸钡BaSO4 氯化锌ZnCl2硝酸锌Zn(NO3)2硫酸锌ZnSO4氧化铜CuO 氢氧化铜Cu(OH)2氯化铜CuCl2硝酸铜Cu(NO3)2硫酸铜CuSO4氧化汞HgO 硝酸汞Hg(NO3)2氧化亚铁FeO 氢氧化亚铁Fe(OH)2氯化亚铁FeCl2硝酸亚铁Fe(NO3)2硫酸亚铁FeSO4氧化铁Fe2O3 氢氧化铁Fe(OH)3氯化铁FeCl3硝酸铁Fe(NO3)3锰酸钾K2MnO4硫酸铁Fe2(SO4)3氧化铝Al2O3 氢氧化铝Al(OH)3氯化铝AlCl3硝酸铝Al(NO3)3高锰酸钾KMnO4硫酸铝Al2(SO4)3↑氧化物↑碱↑盐5.化学式有关计算(1)计算化学式中加点元素化合价例:计算H2O2 (+1)×2+2x=0 x=-1Na2S2O3O2Cu2(OH)2CO3(2)计算相对分子质量Mr相对原子质量Al : 27 S : 32 O : 16Mr[Al2(SO4)3] = 27 ×2 + 32 ×3 + 16 ×4 ×3 = 342练习:计算CaCO3 Ca(OH)2 NH4NO3 Cu(NO3)2 的相对分子质量Mr[CaCO3 ] =Mr[Ca(OH)2 ] =Mr[NH4NO3] =Mr[Cu(NO3)2 ] =(3)计算化合物中各元素的质量比、元素的质量分数Fe2O3中,铁原子和氧原子的个数比为Fe2O3中,铁元素和氧元素的质量比=Fe2O3中铁元素的质量分数= ×100%100克Fe2O3中含多少克铁元素?140克Fe2O3中含多少克铁元素?NH4NO3中,氮原子、氢原子和氧原子的个数比为NH4NO3中,氮、氢、氧元素的质量比=NH4NO3中氮元素的质量分数=100克NH4NO3中含多少克氮元素?多少克NH4NO3中含100克氮元素?6、化学式意义宏观:表示一种物质;表示该物质的元素组成微观:表示一个分子和一个分子的构成(物质由分子构成)或物质中所含原子、离子的个数比(物质由原子或离子构成)例:H2O :表示物质水;水是由氢元素和氧元素组成一个水分子;一个水分子由两个氢原子和一个氧原子构成NaCl :表示物质氯化钠:氯化钠由钠元素和氯元素组成氯化钠中钠离子和氯离子个数比为1:1“CO2”的含义:下列关于维生素C(C6H8O6)的说法正确的有()A. 维C由6个碳原子、8个氢原子、6个氧原子构成的B. 1个维C分子是由6个碳原子、8个氢原子、6个氧原子构成的C. 维C由碳元素、氢元素、氧元素组成D. 维C由6个碳元素、8个氢元素、6个氧元素组成E. 维C中C、H、O元素的质量比为3:4:3F. 维C中C、H、O元素的质量比为12:1:16G.维C中C、H、O元素的质量比为(12×6):(1×8):(16×6)H.维C是氧化物7、物质的分类分类纯净物有机物: CH4、酒精等化合物金属氧化物:MgO、MnO2、Fe2O3等氧化物无机物非金属氧化物H2O、CO、P2O5等酸:HCl、H2CO3、H2SO4、HNO3等碱:NaOH、Ca(OH)2等盐:Na2CO3、FeSO4、AgNO3等8、其他知识点质子:每个质子带1个单位正电荷。
沪教版九年级化学上册化学方程式(烟雨朦胧整理)九年级化学上册(沪教版)化学方程式整理小结1、碳酸氢铵受热分解:NH 4 HCO 3△NH 3 ↑+ CO 2 ↑ + H 2O2、碱式碳酸铜(铜绿受热分解): Cu 2(OH) 2 3 △2CuO+ CO 2↑+ H 2CO O 3、镁带在空气中燃烧: 2Mg + O 2 点燃 2MgO4、铁丝在氧气中燃烧: 3Fe + 2O 2 点燃 Fe 3 O 45、磷在空气中燃烧: 4P + 5O 2点燃 2P 2 O 5 6、加热高锰酸钾制取氧气: 2KMnO 4 △K 2 MnO 4 + MnO 2 + O 2 ↑7、二氧化锰催化双氧水制氧气:2H 2O 2 MnO2 2H 2O+ O 2 ↑ 8、加热氯酸钾制取氧气: 2KClO 3 MnO2 2KCl + 3O 2↑9、二氧化碳溶于水 CO 2 + H 2O === H 2CO 310、碳酸不稳定易分解 H 2CO 3 △ CO 2↑ +H 2O11、实验室制取二氧化碳: CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑12、二氧化碳通入澄清石灰水: CO +C a( O H ) 2 ==CaCO ↓ + H O2 3 2 13、电解水: 2H 2 O 通 电 ↑+ O 2 ↑2H 214、氢气燃烧或爆炸: 2H 2 + O 2 点燃 2H 2 O15、碳的不完全燃烧: 点燃 2CO2C + O 216、 碳的完全燃烧: C + O 2 点燃 CO 217、一氧化碳在空气中燃烧 2CO + O 2 点燃 2CO 218、氢氧化钠与硫酸铜反应Ca(OH) 2+ CuSO 4 ==CaSO 4+ Cu(OH) 2↓ 19.、铜丝在空气中加热:2Cu + O 2 △ 2CuO20.、铝丝在常温时形成氧化膜: 4Al + 3O 2 == 2Al 2O 321、镁与硫酸反应: Mg+H 2SO 4==MgSO 4+H 2↑22.、镁与盐酸反应: Mg+2HCl==MgCl 2+H 2↑23.、铝与盐酸反应: 2Al+6HCl==2AlCl 3+3H 2↑24.、铝与硫酸反应: 2Al+3H 2SO 4==Al 2(SO 4)3+3H 2 ↑25、铁与盐酸反应制氢气: Fe + 2HCl ==FeCl 2 + H 2 ↑26、铁与硫酸反应制氢气:Fe+H 2SO 4==FeSO 4+H 2↑ 27.、锌与盐酸反应制氢气(实验室制取氢气): Zn + H 2 SO 4 ==ZnSO 4 + H 2↑28.、湿法炼铜法: Fe+CuSO 4==Cu+FeSO 4 高温29、工业炼铁的原理(以赤铁矿为例): 3CO+ Fe 2O 3 2Fe + 3CO 2。
课题沪教版九年级化学上册知识点整理学情分析九年级化学上册知识多为基础,中考考察以中等难度题为主教学目标考点分析熟练掌握相关化学式、反应方程式的应用;理解氧气、二氧化碳、金属矿物性质;了解化学变化实质,熟练掌握化学语言教学重点化学式、化学方程式等;金属非金属性质等教学方法面授法、归纳总结法学习内容与过程第一章开启化学之门1. 物理变化:没有新物质生成的变化(物质仅是形状、状态改变)化学变化:有新物质生成的变化物理性质:颜色、状态、密度、熔沸点、硬度、气味、导电性等化学性质:通过化学变化表现出来的性质。
如:可燃性、毒性等【性质是物质固有的属性,描述性质用词:能、是、有、可以、会等。
性质决定物质能否发生某种变化。
变化是正在发生或已经发生的事件,体现了物质有何性质】下列各组变化中,前者属于物理变化,后者属于化学变化的是()A.铁丝生锈,轮胎爆炸B.灯泡发光,食物腐烂C.烧制陶瓷,红磷燃烧D.玻璃碎裂,工业制氧气下列物质的性质属于物理性质的是()A. 木炭的可燃性B.汽油的挥发性C.氧气的氧化性D.碳酸氢铵的不稳定性2. 空气中氧气的含量按右图组装仪器,关闭止水夹,通电使红磷燃烧。
(1) 燃烧的现象是; (2) 红磷不足,对实验结果的影响是;若反应后立即松开止水夹,对测定结果(3) 化学方程式(4) 空气中,氧气约占总体积的,氮气约占第二章 身边的化学通电1. 电解水 2H2O ==== 2H2↑ + O2 ↑ (负氢正氧二比一)活性炭:吸附作用 明矾:沉降作用过滤:固液分离用肥皂水区分软、硬水; 煮沸、蒸馏可降低水的硬度2. O2 物理性质:密度比,溶于水O2 化学性点质燃:很活泼,有点燃性,物质与氧气的反应称为氧化反应C + O2 =点=燃= CO22H2 + O2 === 2H2OS + O 点2燃=== SO2(刺激性气味、有毒气体,大气污染物)2Mg + O2点=燃== 2MgO (在空气中剧烈燃烧,发出耀眼白光,生成白色固体)3F e+ 2O=== Fe3O4(在氧气中加剧热 烈燃烧,火星四射,生成黑色固体)4Al + 3O2 === 2Al2O3 2Cu + O2 === 2CuO (黑色固体)3. CO2 物理性质:密度,溶于水,固态CO2 俗称CO2 化学性质:H2O + CO2 === H2CO3 (CO2 使紫色石蕊试液变红)Ca(OH)2 + CO2 === CaCO3 ↓+ H2O (用石灰水检验CO2)CO2 用途:人工降雨、制碳酸饮料、灭火(不可燃、不助燃,密度比空气大)氧气的实验室制法药品高锰酸钾(紫黑色固体)双氧水、二氧化锰(黑色固体)反应加热MnO 22KMnO4 === K2MnO4 + MnO2 + O2 ↑2H2O2 === 2H2O + O2 ↑发生装置酒精灯、试管、铁架台长颈漏斗或分液漏斗、锥形瓶收集集气瓶、水槽装置法向上排空气法查气导管放入水中,双手握住试管,关闭止水夹,向长颈漏斗加水,水不操作密性要点收集导管口有气泡,不漏气有大量、连续气泡产生时开始收集,集气瓶外有气泡产生,收集满棉花作用:防止KMnO4 粉末进入导管持续流下,不漏气将带火星木条放到集气瓶口,木条复燃,集满分液漏斗优点:能控制反应速度其它实验结束后,先将导管移出水面,后熄灭酒精灯,防止水倒吸进试管长颈漏斗下端要伸入液面以下,防止气体从长颈漏斗跑出催化剂特点:1.2. 3.验证O2 将带火星木条伸入集气瓶中,木条复燃,是氧气CO2 实验室制法药品石灰石或大理石、稀盐酸反应CaCO3 + 2HCl === CaCl2 + H2O + CO2 ↑发生装置长颈漏斗或分液漏斗、锥形瓶收集装置向上排空气法将燃着的木条放在集气瓶口,木条熄灭,集满第三章物质构成的奥秘1、化学符号中数字的含义左边:分子、原子、离子的个数右上:阴、阳离子所带电荷数上边:(化合物中)元素的化合右下: 1 个分子中含原子的个数1 个氢原子 2 个氧原子 1 个双氧水分子 2 个氮气分子3 个氯离子 1 个铝离子 2 个硫酸根离子n 个氢氧根离子五氧化二磷中磷元素是正五价双氧水中氧元素是负一价2、写出下列元素、原子团的符号,并标出化合价化合价Na Cl OH Cu Fe Fe SO4离子符号Na + Cl - OH - C2+ Fe 2+ Fe 3+ SO4 2-氢钠钾银钙镁钡锌氯氧铜氢氧根铝铁硝酸根碳硫碳酸根氮磷硫酸根锰锡铵根汞3、根据化合价写化合物化学式的步骤第1 步:正价元素符号写在左面,负价元素符号写在右面,并标出化合价原子团(..根)要加括号第2 步:将化合价数字前后交换,写在元素符号右下角第3 步:右下角数字约分成最简比,数字‘ 1 ’省略不写原子团个数为‘ 1 ’,一定要去掉括号4、化合物的命名规则某化某(化合物中含两种元素)氢氧化某(化合物中含氢氧根OH )某酸某(化合物中含硝酸根NO3、碳酸根CO3 、硫酸SO4 等)某酸(HNO3 、H2CO3 、H2SO4 )氯化氢硝酸碳酸硫酸酸→HCl HNO3 H2CO3 H2SO4 过氧化氢氢氧化钠氯化钠硝酸钠碳酸钠硫酸钠H2O2 二氧化锰NaOH氢氧化钾NaCl氯化钾NaNO3硝酸钾Na2CO3碳酸钾Na2SO4硫酸钾MnO2 KOH KCl KNO3 K2CO3 K2SO4 四氧化三氯化银硝酸银铁Fe3O4 五氧化二磷AgCl氯化铵AgNO3硝酸铵碳酸铵硫酸铵O4P2O5氧化钙氢氧化钙NH4Cl氯化钙NH4NO3硝酸钙(NH4)2CO3 (NH4)2S碳酸钙硫酸钙CaO Ca(OH)2 CaCl2 Ca(NO3)2 CaCO3 CaSO4 氧化镁氢氧化镁氯化镁硝酸镁碳酸镁硫酸镁MgO Mg(OH)2 MgCl2 Mg(NO3)2 MgCO3 MgSO4 氢氧化钡氯化钡硝酸钡碳酸钡硫酸钡Ba(OH)2 BaCl2 Ba(NO3)2 BaCO3 BaSO4氯化锌ZnCl2 硝酸锌Zn(NO3)2硫酸锌ZnSO4氧化铜氢氧化铜氯化铜硝酸铜硫酸铜CuO Cu(OH)2 CuCl2 Cu(NO3)2 CuSO4 氧化汞硝酸汞HgO Hg(NO3)2氧化亚铁氢氧化亚铁氯化亚铁硝酸亚铁硫酸亚铁FeO Fe(OH)2 FeCl2 Fe(NO3)2 FeSO4 氧化铁氢氧化铁氯化铁硝酸铁锰酸钾硫酸铁Fe2O3 氧化铝Fe(OH)3氢氧化铝FeCl3氯化铝Fe(NO3)3硝酸铝K2MnO4高锰酸钾Fe2(SO4)3硫酸铝Al2O3 Al(OH)3 AlCl3 Al(NO3)3 KMnO4 Al2(SO4)3↑氧化物↑碱↑盐5.化学式有关计算(1)计算化学式中加点元素化合价例:计算H2O2 (+1) ×2+2x=0 x=-1Na2S2O3O2Cu2(OH)2CO3(2)计算相对分子质量Mr相对原子质量Al : 27 S : 32 O : 16Mr[Al2(SO4)3] = 27 ×2 + 32 ×3 + 16 ×4 ×3 = 342练习:计算CaCO3 Ca(OH)2 NH4NO3 Cu(NO3)2 的相对分子质量Mr[CaCO3 ] =Mr[Ca(OH)2 ] =Mr[NH4NO3] =Mr[Cu(NO3)2 ] =(3) 计算化合物中各元素的质量比、元素的质量分数Fe2O3 中,铁原子和氧原子的个数比为Fe2O3 中,铁元素和氧元素的质量比=Fe2O3 中铁元素的质量分数= ×100%100 克Fe2O3 中含多少克铁元素?140 克Fe2O3 中含多少克铁元素?NH4NO3 中,氮原子、氢原子和氧原子的个数比为NH4NO3 中,氮、氢、氧元素的质量比=NH4NO3 中氮元素的质量分数=100 克NH4NO3 中含多少克氮元素?多少克NH4NO3 中含100 克氮元素?6、化学式意义宏观:表示一种物质;表示该物质的元素组成微观:表示一个分子和一个分子的构成(物质由分子构成)或物质中所含原子、离子的个数比(物质由原子或离子构成)例:H2O :表示物质水;水是由氢元素和氧元素组成一个水分子;一个水分子由两个氢原子和一个氧原子构成NaCl :表示物质氯化钠:氯化钠由钠元素和氯元素组成氯化钠中钠离子和氯离子个数比为1:1“CO2”的含义:下列关于维生素C(C6H8O6)的说法正确的有()A. 维C 由6 个碳原子、8 个氢原子、6 个氧原子构成的B. 1 个维C 分子是由 6 个碳原子、8 个氢原子、6 个氧原子构成的C. 维C 由碳元素、氢元素、氧元素组成D. 维C 由6 个碳元素、8 个氢元素、6 个氧元素组成E. 维C 中C、H、O 元素的质量比为3:4:3F. 维C 中C、H、O 元素的质量比为12:1:16G.维C 中C、H、O 元素的质量比为(12×6):(1×8):(16×6)H.维C 是氧化物7、物质的分类A B C【A 和B 中都只有一种分子,是纯净物, C 中含有两种分子,是混合物A 中只含有一种原子(一种元素),是单质,B 中含有两种原子(一种元素),是化合物,B 还可能是氧化物】混合物:由两种或两种以上物质混合而成(由不同种微粒构成)纯净物:只由一种物质组成(由同一种微粒构成)单质:由同种元素组成的纯净物化合物:由两种或两种以上元素组成的纯净物氧化物:只由两种元素组成,且其中一种是氧元素的化合物练习:将下列物质进行分类⑴冰水混合物⑵氧化铜⑶稀有气体⑷高锰酸钾⑸液氮⑹干冰⑺硫⑻大理石⑼碳酸钙⑽铁⑾氦气⑿澄清石灰水⒀氢氧化钙⒁纯净水⒂二氧化锰⒃碳酸氢铵⒄蒸馏水⒅稀盐酸混合物有纯净物有单质有化合物有氧化物有混合物(无化学式):空气、海水、溶液等金属单质:M g 、Al 、Zn、Fe、Cu 等物质单质非金属单质:C、P、S、H2、O2、N2 等分类纯净物有机物: CH4、酒精等化合物金属氧化物:MgO 、MnO2、Fe2O3 等氧化物10无机物非金属氧化物H2O、CO、P2O5 等酸:HCl 、H2CO3、H2SO4、HNO3 等碱:NaOH、Ca(OH)2 等盐:Na2CO3、FeSO4、AgNO3 等8、其他知识点质子:每个质子带 1 个单位正电荷。
1-5章化学方程式整理小结
一.化合反应 1.镁带燃烧: 2Mg + O 2 ==== 2MgO (耀眼白光,照明弹) 2.铁燃烧及生锈:3Fe + 2O 2 ==== Fe 3O 4(火星四射,得黑色固体);*4Fe + 3O 2 ===== 2Fe 2O 3(缓慢氧化)
3.铜丝加热: 2Cu + O 2 === 2CuO ;
4.铝丝常温形成致密氧化膜:4Al + 3O 2 === 2Al 2O 3
5.氢气燃烧或爆炸: 2H 2 + O 2 === 2H 2O 6.碳的燃烧:2C + O 2 ==== 2CO (不完全燃烧);C + O 2 === CO 2(完全燃烧)
7.硫的燃烧:S + O 2 === SO 2 (空气中微弱的淡蓝色火焰,氧气中明亮的蓝紫色火焰)
8.磷的燃烧:4P + 5O 2 === 2P 2O 5 (浓厚白烟,烟幕弹)
9.二氧化碳被碳还原:C + CO 2 === 2CO (吸热反应,高炉炼铁中制还原剂CO )
10.二氧化碳溶于水:CO 2 + H 2O == H 2CO 3 (制碳酸饮料) 11.CO 燃烧:2CO+O 2=== 2CO 2 (CO 是煤气的主要成分,有毒)
二.分解反应
1.碳酸氢铵(碳铵)受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O (特点:固体受热后消失)
2.碱式碳酸铜(铜绿受热分解):Cu 2(OH)2CO 3 2CuO + H 2O + CO 2↑(特点:分解得3种氧化物)
3.加热高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑
4.二氧化锰催化双氧水制氧气:2H 2O 2 2H 2O + O 2↑ (实验室制氧气) 5.氯酸钾制氧气:2KClO 3 2KCl+3O 2↑
6.电解水:2H 2O 2H 2↑+ O 2↑ 7.碳酸分解:H 2CO 3 CO 2↑+ H 2O
三.置换反应
*1.氢气还原金属氧化物: CuO + H 2 Cu + H 2O *2.碳粉还原金属氧化物: 2CuO + C 2Cu + CO 2↑ 3.铝与盐酸、硫酸反应制氢气:2Al + 6HCl == 2AlCl 3 + 3H 2↑;2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑
4.镁与盐酸、硫酸反应制氢气:Mg + 2HCl == MgCl 2 + H 2↑;Mg + H 2SO 4 == MgSO 4 + H 2↑
5.铁与盐酸、硫酸反应制氢气:Fe + 2HCl == FeCl 2 + H 2↑;Fe + H 2SO 4 == FeSO 4 + H 2↑
6.锌与盐酸、硫酸反应制氢气:Zn + 2HCl == ZnCl 2 + H 2↑;Zn + H 2SO 4 == ZnSO 4 + H 2↑(实验室制氢气)
7.湿法炼铜法,铁与硫酸铜溶液反应:Fe + CuSO 4 == FeSO 4 + Cu
*8.铜与硝酸银溶液反应:Cu + 2AgNO 3 == Cu(NO 3)2 + 2Ag
四.复分解反应:
*1.金属氧化物与酸溶液反应:Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O(除锈);Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O (除锈)
CuO + H 2SO 4 == CuSO 4 + H 2O
2.实验室制CO 2:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O (原理:碳酸盐与酸都能反应生成CO 2)
3.硫酸铜溶液和氢氧化钠溶液混合生成蓝色沉淀:CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 4
五.其他反应类型: 1.一氧化碳还原金属氧化物:Fe 2O 3 + 3CO 2Fe + 3CO 2(赤铁矿炼铁) Fe 3O 4 + 4CO 3Fe + 4CO 2;(磁铁矿炼铁)
* CuO + CO Cu + CO 2 2.二氧化碳通入澄清石灰水:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O (验CO 2); *3.天然气燃烧:CH 4 + 2O 2 CO 2 + 2H 2O
4..铜绿和盐酸反应:Cu 2(OH)2CO 3 + 4 HCl = 2CuCl 2 + 3H 2O + CO 2↑
打*的为拓展内容 潮湿空气 △ 点燃 点燃 点燃 点燃 点燃 点燃 点燃 高温 △ === △ === △ === MnO 2 === 通电 === 高温 === 高温 === 高温 === 高温 === 高温 === 点燃 === MnO 2 === △ △
=== 点燃。