高中化学必修一专题一:物质的分类及转化
- 格式:doc
- 大小:36.00 KB
- 文档页数:36

第一章物质及其变化一、物质的分类及转化1.同素异形体:由同一种元素形成的几种性质不同(物理性质不同,化学性质相似)的单质。
常见的实例:金刚石、石墨和C60;氧气和臭氧;红磷和白磷。
注:同素异形体之间的转化有单质参与,但不属于氧化还原反应!2.酸性氧化物与碱性氧化物的理解(1)酸性氧化物定义:与碱反应只生成一种对应价态的盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO、NO2。
(2)碱性氧化物定义:与酸反应只生成一种对应价态的盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
(只有“碱金”这一组关系是一定的!)②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是特殊氧化物。
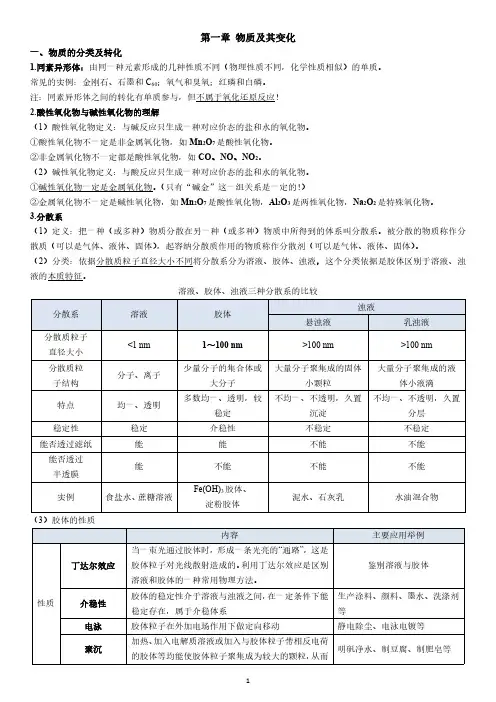
3.分散系(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
(2)分类:依据分散质粒子直径大小不同将分散系分为溶液、胶体、浊液,这个分类依据是胶体区别于溶液、浊液的本质特征。
溶液、胶体、浊液三种分散系的比较(3)胶体的性质形成沉淀从分散剂中析出提纯渗析由于胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜,用此法将胶体提纯用于分离溶液和胶体(4)胶体部分易错归纳①胶体的本质是胶体粒子的直径介于1~100nm之间,而不是丁达尔效应。
②胶体本身并不带电,而是由于胶体粒子吸附溶液中的离子而带电。
④电泳现象是由于胶体粒子吸附溶液中的离子而带电,通电后胶体粒子定向移动,所以并非所有胶体都有电泳现象(如淀粉胶体)。
(5)Fe(OH)3胶体的制备在小烧杯中,加入40mL蒸馏水,加热至沸腾,向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,立即停止加热,即可得到Fe(OH)3胶体,整个过程不能搅拌。

专题01 物质的分类及转化【知识导图】【目标导航】物质的分类的考查方式主要是判断各选项的正误,考查角度是对概念的辨析;单质、氧化物、酸、碱、盐之间的转化会结合与社会热点相关的物质、材料、工业流程等进行考查;分散系的相关知识主要侧重胶体性质与应用的考查。
题型为选择题1、物质的分类、物质的性质与变化常与其他知识综合考查,一般以选择题形式出现。
2、分散系的知识考查频率不高,难度不大,一般出现在选择题的个别选项中。
【重难点精讲】一、物质的分类(一)根据物质的组成和性质分类(1)同一种可以组成不同的单质,由同一种元素组成的不同单质之间互称为同素异形体;不同元素可以组成化合物,100多种元素可以能成种类繁多的物质。
我们可以采用树状分类法和交叉分类法来认识和研究物质的组成、性质、用途、制备等。
(2)树状分类法和交叉分类法A.树状分类法对同类事物按某种标准再进行分类的方法叫树状分类法,根据物质的组成可以采用树状分类法对物质进行分类如下:B.交叉分类法对同一种物质按不同的标准分类的方法叫交叉分类法,从不同的标准对同一物质进行分类,可以采用交叉分类法对物质进行分类。
(3)根据物质的性质也可以对物质进行分类根据氧化物质的性质可对氧化物进行分类,能与酸反应生成盐和水的氧化物叫碱性氧化物,如CaO;能与碱反应生成盐和水的氧化物叫酸性氧化物,如CO2;既能与酸反应生成盐和水又能与碱反应生成盐和水的氧化物叫两性氧化物,如Al2O3;既不能与酸反应生成盐和水又不能与碱反应生成盐和水的氧化物叫不成盐氧化物,如NO、CO;大多数非金属氧化物是酸性氧化物,大多数金属氧化物是碱性氧化物。
特别提醒:(1)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸或碱,如SiO2、Fe2O3。
(2)能与酸反应生成盐和水的氧化物不一定是碱性氧化物,如Al2O3。
(3)能与碱反应生成盐和水的氧化物不一定是酸性氧化物,如NO2、Al2O3。
(4)碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物。





高中化学必修一专题一:物质的分类及转化(经典实用)
物质的分类及转化是高中化学必修一的重要内容,该专题主要介绍了物质的分类方法和物质的转化规律。
以下是该专题的经典实用内容:
一、物质的分类方法:
1.按性质分类:可以根据物质的物理性质、化学性质、生物性
质等进行分类,如固体、液体、气体;酸、碱、盐等。
2.按组成分类:可以根据物质的基本组成单位进行分类,如元素、化合物、混合物等。
3.按来源分类:可以根据物质的来源进行分类,如天然物质和
人工合成物质等。
二、物质的转化规律:
1.物理变化:指物质在不改变其化学成分的情况下,发生形状、颜色、状态等方面的改变。
如溶解、汽化、凝固等。
2.化学变化:指物质在发生化学反应过程中,形成新的物质,
即产生化学变化。
如燃烧、酸碱中和、金属与酸反应等。
三、化学方程式:
1.化学方程式用化学符号和化学式表示化学反应的物质的种类
和数量关系。
反应物在化学方程式的左边,生成物在右边,用箭头分隔。
2.化学方程式还可以表示反应的摩尔比例关系和反应的能量变化。
四、化学反应的计算:
1.摩尔与质量的转化:可以利用化学方程式中物质的摩尔比例关系,通过已知物质的摩尔数或质量,计算其他物质的摩尔数或质量。
2.气体体积与摩尔数的关系:在一定的温度和压强下,气体的体积与物质的摩尔数成正比关系。
可以利用这一关系,计算反应物或生成物的摩尔数或体积。



---------------------------------------------------------------最新资料推荐------------------------------------------------------ 高中化学必修一专题一:物质的分类及转化zxxkw学科网学.科.网1/ 36物质的分类分类是为了便于科学研究,同类物质特点相同或相似,不同类物质特点不相同。
我们通过分类便于举一反三,由此及彼---------------------------------------------------------------最新资料推荐------------------------------------------------------ 分类的方法:? 单一分类法 ? 交叉分类法 ? 树状分类法注意:单一分类法是交叉分类法和树状分类法的基础3/ 36单一分类法:? 1、根据物质存在的状态: ? 气态物质:空气、氢气 ? 液态物质:乙醇、食盐水、碘酒 ? 固态:硫酸铵、铜、碘、石墨 ? 2、根据物质的导电性: ? 导体:铜、石墨、食盐水、 ? 绝缘体:空气、乙醇、碘、氢气、碘酒 ? 硫酸铵晶体不导电,其水溶液能导电 ? 3、根据物质在水中的溶解性: ? 易溶:乙醇、食盐水、硫酸铵 ? 微溶:碘 ? 难溶:空气、氢气、铜、石墨---------------------------------------------------------------最新资料推荐------------------------------------------------------ 交叉分类法:5/ 36树状分类法:学科网---------------------------------------------------------------最新资料推荐------------------------------------------------------ 物质的分类物质混合物单质纯净物金属非金属有机物化合物无机物氧化物酸碱元素的存在状态:游离态、化合态盐7/ 361.氧化物分类zxxkw氧酸性氧化物化物碱性氧化物酸性氧化物:能与碱反应生成盐和水的氧化物包括:大多数非金属氧化物如:CO2、SO2、SO3、SiO2、P2O5等? 碱性氧化物:能与酸反应生成盐和水的氧化物包Fe括2O:3、大C多u数O、金M属g氧O化等物如:Na2O、CaO、---------------------------------------------------------------最新资料推荐------------------------------------------------------ 2.酸分类强酸:HCl H2SO4 HNO3 酸弱酸:H2CO3 H2SO3 H3PO4 CH3COOH H2S含氧酸:H2SO4 HNO3 H2CO3 H2SO3 H3PO4酸CH3COOH无氧酸:HCl H2S9/ 363.碱分类强碱:NaOH KOH Ca(OH)2 Ba(OH)2 碱弱碱:Mg(OH)2 Fe(OH)3 Cu(OH)2 NH3.H2O……碱可溶性碱:NaOH KOH Ca(OH)2 Ba(OH)2 NH3.H2O不溶性碱:Mg(OH)2 Fe(OH)3 Cu(OH)2---------------------------------------------------------------最新资料推荐------------------------------------------------------ 4.盐分类正盐:NaCl CaCO3 BaSO4 Na2CO3 CuSO4 zxxkwBa(NO3)2……盐酸式盐:NaHCO3 NaHSO4 NaHS NaH2PO4 Na2HPO4碱式盐:Cu2(OH)2CO3含氧酸盐:CaCO3 BaSO4 Ba(NO3)2 NaHCO3盐NaHSO4……无氧酸盐:NaCl K2S KI AgCl11/ 36[练习]? 1、下列物质:①含CaO99%的生石灰②CaO刚好与水反应的生成物③水银④浓盐酸⑤含铁70%的三氧化二铁,用编号填入下列空格:属混合物的是,属单质的是,? 属化合物的是。
? 2、从H、C、O、Na四种元素种,选择适当的元素,按要求写出各物质的化学式。
? ①金属单质、非金属单质;? ②酸性氧化物、碱性氧化物;?③酸、碱、盐。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ ? “垃圾是放错了位置的资源”,应该分类回收,生活中废弃的铁锅、铅制易拉罐,铜导线等可以归为一类加以回收,它们属于()A、氧化物 B、盐C、金属或合金 D、碱13/ 36物理性质酸、碱、盐的溶解性钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠氨钡溶。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 化学性质1金属的化学性质 2 碱性氧化物通性 3 酸性氧化物通性4.盐的通性 5. 酸的通性 6.碱的通性15/ 361.金属的化学性质:(1)与非金属反应:(2)与酸反应:(3)与zxxkw 盐溶液反应:金属活动顺序表应用:①在金属活动顺序表中,只有排在氢前面的金属才能置换出酸中的氢(金属越活泼,反应越剧烈)②在金属活动顺序表中,排在前面的金属一般能把排在后面的金属从它们的盐溶液中置换出来---------------------------------------------------------------最新资料推荐------------------------------------------------------2 .碱性氧化物通性(1)与酸反应Na2O + 2HCl = 2NaCl + H2O (2)与水反应:CaO + H2O = Ca(OH)2 (3)与酸性氧化物:Na2O + CO2 = Na2CO3 注意:一般可溶性的碱对应的碱性氧化物才能与水反应(常见的有:Na2O 、K2O、 CaO、BaO)17/ 363 .酸性氧化物通性(1)与碱反应: CO2 + Ca(OH)2 = CaCO3 + H2O (2)与水反应:CO2 + H2O = H2 CO3 (3)与碱性氧化物反应: K2O + CO2 = K2CO3注意:大多数酸性氧化物能与水反应生成相应的酸,但SiO2不能与水反应---------------------------------------------------------------最新资料推荐------------------------------------------------------ 4 酸的通性先介绍电离的概念酸:电离产生的阳离子全都是氢离子HCl == H+ +Cl- H2SO4 == 2H+ + SO42-因为酸的溶液中都含有氢离子所以酸具有相同的化学性质酸的化学性质实质是溶液中氢离子和酸根离子的性质19/ 36①酸碱指示剂石蕊变红、酚酞不变色②金属酸③碱性氧化物④碱⑤盐盐 + 氢气盐+水盐+水盐+酸---------------------------------------------------------------最新资料推荐------------------------------------------------------ 5 碱的通性碱:电离产生的阴离子全都是氢氧根离子NaOH == Na+ +OH -Ca(OH)2 == Ca2+ +2OH-因为碱的溶液中都含有氢氧根离子所以碱具有相同的化学性质碱的化学性质实质是溶液中金属离子和氢氧根离子的性质21/ 36①酸碱指示剂石蕊变蓝、酚酞变红②酸性氧化物盐+水碱③酸④盐盐+水盐+碱---------------------------------------------------------------最新资料推荐------------------------------------------------------ 6.盐的通性①与酸反应酸与盐反应的一般规律:强酸 + 弱酸盐 = 强酸盐 + 弱酸②与碱反应注意:碱和盐反应不仅要求生成物中有沉淀、气体、水三者之一,还要求反应物均溶于水③与盐反应注意:盐和盐反应不仅要求生成物中有沉淀、气体、水三者之一,还要求反应物均溶于水④与金属反应23/ 36物质间的转化1.按物质的类别研究物质的转化---------------------------------------------------------------最新资料推荐------------------------------------------------------ (1).物质的转化类型(不同类别物质相互转化)物质的转化类型化学方程式单质化合物金属氧化物氢氧化物酸盐非金属氧化物酸碱化合物盐单质单质单质盐无机物氧化物有机物2H2+O2=点==燃=2H2OCaO +H2O====Ca(OH)2 H2SO4 +2NaOH====Na2SO4 +2H2OCO2+H2O====H2CO3NaOH +HCl====NaCl+H2O 2KClO3=点=燃==2KCl+3O2Fe +CuSO4====FeSO4+Cu碳酸钙生成氧化钙二氧化碳生成葡萄糖25/ 36(2)不同类别的含钙物质的相互转化CaCO3CO2CO2或Na2CO3CaOH2O HCl Ca(OH)2HClO2 CaH2O HCl或Cl2 电解NaOH HClCaCl2---------------------------------------------------------------最新资料推荐------------------------------------------------------ 物质间的转化1.按物质的类别研究物质的转化(1).物质的转化类型(不同类别物质相互转化) (2)不同类别的含钙物质的相互转化2.按反应类型研究物质的转化27/ 36(1). 四种基本类型的化学反应整理与归纳反应类型实例A+B=AB 化合反应 AB=A+B 分解反应 AB+C=A+BC 置换反应2H2+O2=点==燃=2H2O 2KMnO4====K2MnO4+MnO2 +O2H2SO4 +Zn====ZnSO4 +2H2AB+CD=AD+CB 复分解反应 H2SO4 +2NaOH====Na2SO4 +2H2O---------------------------------------------------------------最新资料推荐------------------------------------------------------ 整理与归纳2在水溶液中,酸、碱、盐之间发生复分解反应的条件:是否有沉淀、气体或难电离的物质生成(水)在水溶液中,一种金属能与另一种金属的盐溶液发生置换反应的条件:活动性强的金属置换活动性弱的金属。